紫薯花色苷提取及稳定性研究
2020-07-27赵国瑜田亚萍周崇银范方宇
赵国瑜,田亚萍,巫 丹,周崇银,李 晗,范方宇
(西南林业大学生命科学学院,云南 昆明 650224)
紫薯(Ipomoea batatasL.)属旋花科一年生草本植物,薯肉呈紫色至深紫色,根茎含丰富的花色苷[1-2]。紫薯花色苷是一种水溶性天然花青素类红色素[3],花色苷具有较强的抗肿瘤、抗氧化、降血脂、降血压、保护肝脏、延缓人体衰老等生理活性功能[4],是理想的天然食用色素。目前,研究者开展了相关紫薯花色苷提取及稳定性的研究,如王玲等[5]对紫薯色素的pH、温度、光照进行了稳定性研究;孙欣等[6]研究了pH 和温度对紫薯花色苷稳定性的影响;石双妮等[7]对紫薯花色苷热稳定性进行了研究。研究表明,紫薯花色苷在加工与储藏过程中色泽和性质会发生变化和破坏,因此花色苷稳定性的研究可为最大限度地保护紫薯花色苷提供参考[8-9]。目前对紫薯花色苷稳定性研究中,一般从pH、温度、光等这几方面考虑,但色素加工与使用过程复杂,如氧化还原剂、金属离子、常用食品添加剂等也对其稳定性有重要影响。
基于此,以紫薯粉为原料,酸醇为提取剂,研究紫薯花色苷的最佳提取工艺,并对紫薯花色苷粗提液在光、温度、pH、氧化剂/还原剂、食品添加剂和金属离子中的稳定性展开研究,为紫薯花色苷的提取与利用提供理论依据。
1 材料与方法
1.1 材料与设备
1.1.1 材料与试剂
紫薯:购于云南昆明农贸市场。
柠檬酸、氯化钠(食品级)由云南盐化股份有限公司提供;碳酸氢钠(食品级)由云南云钟工贸有限公司提供;山梨酸钾(食品级)由宁波王龙科技股份有限公司提供;D-异抗坏血酸钠(食品级)由江西省德兴市百勤异VC 钠有限公司提供;盐酸、95%乙醇、冰醋酸、氢氧化钠(分析纯)、氯化镁、三氯化铝、三氯化铁、30%过氧化氢、亚硫酸氢钠(分析纯)由天津市风船化学试剂科技有限公司提供;氯化钾、氯化钙(分析纯)由提供广东省化学试剂工程技术研究开发中心提供;氯化锌(分析纯)由天津市致远化学试剂有限公司提供。
1.1.2 仪器与设备
DT-1 型电子天平,DZKW-D-V 型电子恒温水浴锅,DHG-9240A 型电热恒温鼓风干燥箱,UV-2600型紫外可见分光光度计,A10 型多功能台式高速冷冻离心机。
1.2 方法
1.2.1 紫薯预处理
紫薯清洗去皮,切厚度约2 mm 的薄片,50 ℃干燥36 h。粉碎,过80 目筛,取筛下样品,4 ℃密封保存。
1.2.2 紫薯花色苷提取
紫薯粉→浸提→离心(5 500 r/min,20 min)→取上清液→花色苷粗提液
1.2.3 提取剂与最大吸收波长选择
分别将质量浓度0.3%柠檬酸、0.3%盐酸、0.3%冰醋酸、蒸馏水按照体积比1∶1 加入到95%乙醇中制成4 种提取剂。称取一定质量紫薯粉,以提取时间30 min,提取温度 50 ℃,料液比 1∶5(g/mL),分别在配制的四种提取剂中提取,确定最佳提取剂。花色苷粗提液用相应提取剂稀释,200~700 nm 分析花色苷吸光值,确定最大吸收波长,根据朗伯-比尔定律A=K×C×L(K 消光系数,C为色素浓度,L 比色皿光程),随着色素浓度增加吸光度增大,因此在此波长下吸光值与提取率呈正相关,吸光值可反映提取率的高低[10]。参考文献[11-15],以吸光值为考察指标,通过比较吸光值大小考察其对紫薯花色苷提取率的影响。
式中:A329为 329 nm 处吸光值;V为提取液体积(mL);n为稀释倍数;98.2 为消光系数;m为样品质量(g)。
1.2.4 紫薯花色苷提取的单因素试验设计
将花色苷粗提液使用相应提取剂稀释,在最大吸收波长处测定吸光值,并以吸光值为指标,考察酸醇比、提取温度、提取时间、料液比对花色苷提取效果的影响。所有试验均进行三次,结果取平均值。
1.2.4.1 酸醇比筛选
以提取温度50 ℃,提取时间30 min,料液比1∶5(g/mL),考察酸醇比 2∶1、1∶1、1∶2、1∶3、1∶4(V/V)对提取效果的影响。
1.2.4.2 提取温度筛选
确定酸醇比 1∶1(V/V),提取时间 30 min,料液比1∶5(g/mL),考察提取温度 30、40、50、60、70 ℃对提取效果的影响。
1.2.4.3 提取时间筛选
确定酸醇比 1∶1(V/V),提取温度 50 ℃,料液比1∶5(g/mL),考察提取时间 6、12、18、24、30 min 对提取效果的影响。
1.2.4.4 料液比筛选
确定酸醇比 1∶1(V/V),提取温度 50 ℃,提取时间30 min,考察料液比 1∶1.5、1∶2、1∶3、1∶4、1∶5(g/mL)对提取效果的影响。
1.2.5 正交试验设计
在单因素试验结果基础上,以酸醇比、提取温度、提取时间、料液比为主要影响因素,以吸光值为考察指标进行L9(34)正交试验,优化紫薯花色苷提取条件,正交试验因素水平见表1。
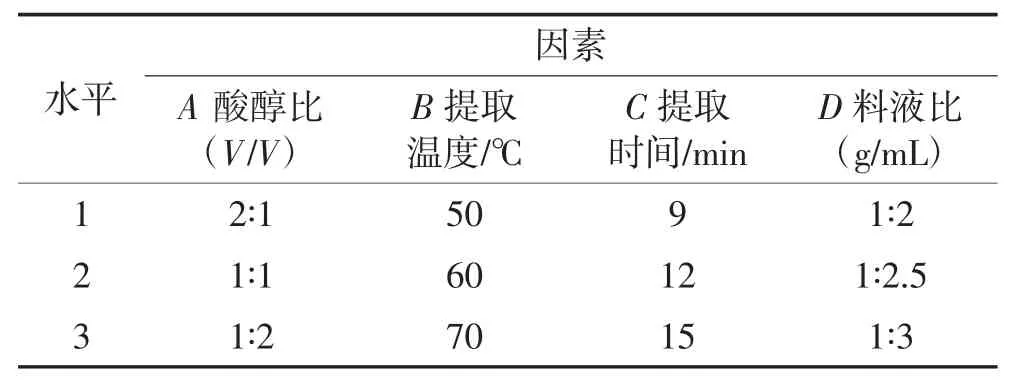
表1 L(934)正交试验因素水平表Table 1 Factors and levels of L(934)orthogonal test
1.2.6 紫薯花色苷的稳定性研究
1.2.6.1 光照对紫薯花色苷稳定性的影响
取100 mL 容量瓶,加入0.4 mL 粗提液,稀释定容至100 mL,摇匀后密封。分别于光照和避光环境下静置5 d,每隔1 d 观察溶液颜色变化并在329 nm 处测定吸光值。
1.2.6.2 温度对紫薯花色苷稳定性的影响
取2 mL 粗提液于1 L 容量瓶中稀释定容。取100 mL 容量瓶,各加入5 mL 稀释溶液,分别于20、30、40、50、60、70、80、90 ℃水浴锅中静置 30 min,观察溶液颜色变化并在329 nm 处测定吸光值。
1.2.6.3 pH 对紫薯花色苷稳定性的影响
取50 mL 小烧杯,加入8 mL 粗提液,调节pH 为1、2、3、4、5、6、7、8、9、10,吸取 1 mL 溶液于比色管中,稀释定容,避光静置30 min,观察溶液颜色变化并在329 nm 处测定吸光值。
1.2.6.4 食品添加剂对紫薯花色苷稳定性的影响
取1 mL 粗提液于500 mL 容量瓶中稀释定容。取20 mL 稀释后花色苷液于锥形瓶中,分别加入2 mL浓度为3%的氯化钠、柠檬酸、山梨酸钾、碳酸氢钠、D-异抗坏血酸钠,等量蒸馏水作空白,避光静置1 d,观察溶液颜色变化并在329 nm 处测定吸光值。
1.2.6.5 氧化剂/还原剂对紫薯花色苷稳定性的影响
配制 1%、2%、3%、4%H2O2溶液 20 mL,分别吸取7 mL 于50 mL 锥形瓶中,再加入3 mL 粗提液,等量蒸馏水作空白,避光静置1.5 h,每隔30 min 振荡一次,观察溶液颜色变化并在329 nm 处测定吸光值。
分别称取 0.2、0.4、0.6、0.8 g NaHSO3溶于 20 mL蒸馏水中,各取7 mL 于50 mL 锥形瓶中,再加入3 mL粗提液,等量蒸馏水作空白,避光静置1.5 h,每隔30 min 振荡一次,观察溶液颜色变化并在329 nm 处测定吸光值。
1.2.6.6 金属离子对紫薯花色苷稳定性的影响
取粗提液1 mL 于50 mL 容量瓶中,分别用浓度0.01、0.02、0.03 mol/L 的 Na+、K+、Mg2+、Zn2+、Ca2+、Al3+、Fe3+金属溶液定容,等量蒸馏水作空白,避光静置1 h,观察溶液颜色变化并在329 nm 处测定吸光值。
1.2.7 数据处理
采用Excel 软件统计处理数据,Origin 软件进行分析。
2 结果与分析
2.1 最佳提取剂及最大特征吸收波长的确定
由图1 可见,0.3%柠檬酸-乙醇和0.3%盐酸-乙醇波长扫描图几乎重合且峰值最大,47.5%乙醇水溶液峰值次之,0.3%冰醋酸-乙醇峰值最小。表明酸化乙醇提取率高于乙醇水溶液,原因为酸破坏了紫薯细胞壁,使其中花色苷充分释放并与乙醇最大限度混合,在二者的相互作用下,花色苷提取率达到最高。冰醋酸易溶于乙醇,混合后酸性减弱,破坏细胞壁能力减弱,提取率不如0.3%柠檬酸-乙醇和0.3%盐酸-乙醇,而47.5%乙醇水溶液中水分较多,色素溶解性较差,会损失较大一部分花色苷。因此,适宜的提取剂为0.3%柠檬酸-乙醇和0.3%盐酸-乙醇。由于本试验提取的色素主要用于食品工业,而柠檬酸为常用的酸性食品添加剂,因此选取0.3%柠檬酸-乙醇溶液作为提取剂较好。紫薯花色苷在紫外光区275~290 nm、可见光区465~530 nm 处均有有最大吸收波长。紫薯花色苷可分为两类:矢车菊素和芍药素,这两类组分糖基上的羟基与一个或几个分子的羟基肉桂酸衍生物和脂肪酸通过酯基形成酰基化的花色苷[16],从而形成了紫薯花色苷。与其他非酰基化天然色素相比,紫薯花色苷稳定性更强。花色苷发生酰基化,300~340 nm 范围内的紫外光波段也会产生特征吸收峰。由图1 可见,紫薯花色苷在329 nm 处有特征吸收峰,发生酰基化,吸收强度最大。这与王和才等[17]的研究结果相似。因此,本试验选择最大吸收波长为329 nm 进行花色苷测定。
2.2 单因素试验结果
2.2.1 酸醇比对花色苷吸光值的影响
由图2 可见,紫薯花色苷吸光值随乙醇含量的增加呈先上升后下降的趋势,吸光值在酸醇比为1∶1(V/V)时出现最大值,为 1.396。当酸醇比为 2∶1(V/V)时,柠檬酸-乙醇溶液中柠檬酸浓度偏高,一定程度上破坏了花色苷结构;而酸醇比为 1∶1(V/V)时,柠檬酸-乙醇溶液为花色苷提供了一个维持稳定的pH 环境,同时乙醇经酸化处理后,使花色苷与金属离子间的络合键、多糖和蛋白质的离子键以及本身所含的氢键发生断裂,促进花色苷溶出,吸光值增加。另一方面,随着乙醇浓度逐渐增加,溶液环境逐渐变为中性,外界环境影响花色苷的溶解,并且在花色苷溶出的过程中,一些醇溶性杂质、亲脂性强的成分也随之溶出减弱花色苷与提取剂的结合能力,导致吸光值降低[12]。因此在正交试验中,选择酸醇比 2∶1、1∶1、1∶2(V/V)较为适宜。
2.2.2 提取温度对花色苷吸光值的影响
由图3 可见,紫薯花色苷吸光值随着提取温度的升高逐渐增大,提取温度由40 ℃升至50 ℃,吸光值增大了0.137;提取温度50 ℃时吸光值为1.396,超过此温度后吸光值的增长趋势逐渐平缓,相比50 ℃,70 ℃下的吸光值仅增大0.031。在提取温度升高的过程中,紫薯花色苷溶出速度加快,吸光值随之快速增加。根据分子运动学说,随着温度的不断升高,分子热运动加快,在渗透、扩散、溶解上的速度也加快,更易转移到溶剂中[13];提取温度超过50 ℃,热运动趋于平稳,且较高温度下花色苷的稳定性低,易发生降解。因此,正交试验中,提取温度选择50、60、70 ℃比较适宜。
2.2.3 提取时间对花色苷色素吸光值的影响
由图4 可见,不同提取时间得到的紫薯花色苷吸光值的变化呈现不同的趋势。提取时间为6~12 min,吸光值随时间的延长逐渐升高。提取12 min 时,得到的花色苷吸光值最大,为1.409;提取时间为12~30 min,随提取时间的延长吸光值变化平缓,这表明提取时间过长对花色苷吸光值的增加没有显著影响。因此,为防止长时间提取可能会导致对花色苷的破坏,同时从节约时间、提高试验效率和最大程度保护花色苷角度考虑,选择适宜提取时间为9、12、15 min。
2.2.4 料液比对花色苷吸光值的影响
由图5 可见,随着料液比的增加,紫薯花色苷提取量逐渐增加。当料液比由1∶1.5(g/mL)增加到1∶3 时,花色苷提取量显著增加。结果表明,在一定范围内增加提取剂的用量,有利于色素的溶出[14]。与 1∶2(g/mL)的溶液相比,料液比 1∶1.5(g/mL)过于浓稠和浑浊;当料液比大于1∶3 时,花色苷提取量增加缓慢,表明在料液比1∶3(g/mL)时已足够提取紫薯中花色苷。为降低紫薯花色苷提取成本和提高效率,同时又能较大程度地将色素提取出来,选择适宜料液比为 1∶2、1∶2.5、1∶3(g/mL)。
2.3 正交试验结果
根据单因素试验结果,确定稀释体积相同的情况下,以吸光值为评价指标,酸醇比(A)、提取温度(B)、提取时间(C)、料液比(D)四个因素进行正交试验优化工艺参数。
由表2 可见,影响紫薯花色苷吸光值各因素的主次顺序为:料液比(D)>酸醇比(A)>提取时间(C)>提取温度(B);花色苷提取的最佳工艺为A3B3C2D1,即酸醇比 1∶2(V/V),提取温度 70 ℃,提取时间 12 min,料液比 1∶2(g/mL),此时吸光值最高,为 3.026。

表2 正交试验结果Table 2 Result of orthogonal experiments
2.4 花色苷稳定性研究结果
2.4.1 光照
由图6 可见,光照和避光条件下的紫薯花色苷均出现了不同程度的降解。花色苷在光照条件下,吸光值的变化较大,5 d 后吸光值由1.235 降到0.582,降低了52.9%,花色苷溶液颜色变浅且浑浊;而在避光条件下,5 d 后吸光值由1.235 降到0.924,降低了25.2%,花色苷溶液颜色无明显变化且清澈。造成这种现象的原因为:一方面,光照强度加大使得紫薯花色苷2、4 位的C 原子活性增大,从而易受亲水攻击发生反应,花色苷容易出现酰基脱落的情况,加速花色苷降解,花色苷出现褪色现象[5,15];另一方面,光照可以引起花色苷降解生成查尔酮,查尔酮快速降解成苯甲酸及2,4,6-三羟基苯甲醛等产物,且花色苷属于类黄酮化合物,其含有不饱和键,因此可能在光照射下易降解损失致使稳定性降低[18]。试验结果表明,光照降低了紫薯花色苷的稳定性。因此,应当避光储藏以保持花色苷的颜色及稳定性。
2.4.2 温度
由图7 可见,低于50 ℃时,随温度的升高,紫薯花色苷吸光值增加,提取液颜色均为玫红色;50 ℃时,花色苷吸光值达到最大,为0.050;高于50 ℃后,花色苷吸光值下降,提取液颜色变为淡粉色。结果表明,紫薯花色苷在20~50 ℃稳定,可以耐受一般食品加工的热处理过程。紫薯花色苷在60~90 ℃进行提取时,随着温度的升高,提取率增加。色素有部分在高温下可能被降解,但提取过程中色素不断溶出,提取率大于降解率,所以只考虑提取温度下的提取率。而在温度稳定性的研究中,色素是定量的,随加温度增加,花色苷发生热降解,所以吸光值变化大,花色苷结构向查尔酮结构转化,导致颜色褪色,稳定性降低[7,19]。结果表明,花色苷的耐热性差。因此,在储存、加工时要注意温度的控制,不宜用长时间的高温食品加工。
2.4.3 pH
由图8 可见,当pH 为1~5,溶液由酸性向弱酸性转变,吸光值随之增加,最大值为0.622,颜色由鲜红色变为深紫色,花色苷化学结构随着pH 的变化也相应发生改变[20],在此区间,主要以红色的吡喃型阳离子结构存在。pH 为6~7 时,溶液由弱酸性向中性转变,吸光值下降,花色苷主要以无色的查尔酮结构存在,溶液的颜色由紫色变为紫蓝色。pH 为7~10 时,溶液由弱碱性向碱性转变,颜色变化较大,从紫蓝色→深蓝色→深绿色→深灰色,在这个过程中花色苷主要以蓝色醌型结构存在;蓝色的醌型结构不稳定,会脱去质子形成共振稳定的醌型阴离子[6]。结果表明,花色苷在偏酸性介质中较为稳定,在偏碱性介质中极不稳定,同时pH 对花色苷呈色效果也有影响。食品加工的pH 多在3~5 范围内,故该色素可作为食品着色剂,也适宜作为酸性食品的添加剂。
2.4.4 食品添加剂
如图9 所示,柠檬酸、山梨酸钾、D-异抗坏血酸钠、氯化钠加入溶液后吸光值增加,其中D-异抗坏血酸钠吸光值最高,为0.587;颜色分别呈现淡粉色、粉色、淡紫色、淡蓝色。加入碳酸氢钠后,颜色呈现绿色且吸光值下降。原因为柠檬酸、山梨酸钾和D-异抗坏血酸钠呈弱酸性,氯化钠呈中性,花色苷色素在酸性至中性条件中较稳定,且具有一定的增色效果;而碳酸氢钠呈弱碱性,花色苷色素在弱碱性至碱性条件中极不稳定[21],且褪色明显。因此花色苷与食品添加剂共存时,D-异抗坏血酸钠稳定性最好,柠檬酸、氯化钠、山梨酸钾次之,碳酸氢钠最差,说明该色素可作为食品、饮料加工过程中的增色剂。
2.4.5 氧化剂/还原剂
如图10 所示,随着H2O2浓度逐渐增加,色素吸光值平缓下降。因为花色苷属于多酚物质,氧化剂与花色苷色素的酚羟基发生反应导致花色苷降解,且氧化剂H2O2易使紫薯花色苷色素褪色;随着H2O2浓度的增加,色素颜色逐渐由深红色变为玫红色、橘色、乳黄色。低浓度还原剂NaHSO3对紫薯花色苷色素稳定性影响较小;当NaHSO3浓度超过2.0%时,色素吸光值急剧下降,发生了明显的褪色现象,颜色由深红色变为黄色、乳白色。这是因为酸性环境下,HSO3-与花色苷反应生成无色复合盐,影响稳定性[22]。结果表明,紫薯花色苷色素有一定的耐还原能力,而耐氧化能力较弱。
2.4.6 不同浓度的金属离子溶液
如图11 所示,随着金属离子Na+、K+浓度的增加,紫薯花色苷的吸光值和颜色均无明显变化,呈淡紫色,说明其对花色苷的稳定性无影响。Mg2+、Ca2+离子浓度逐渐增加,花色苷吸光值呈上升趋势,并有增色效应。Zn2+、Fe3+离子浓度逐渐增加,花色苷吸光值增加,但低于对照样品,且色素溶液颜色变化较大,分别为灰色和棕黄色,具有一定褪色作用。这表明Zn2+、Fe3+离子对于花色苷稳定性的影响较大,应避免紫薯花色苷与这两种离子混合。Al3+的加入使紫薯花色苷的吸光值低于对照样品,但随着浓度的增加,花色苷吸光值增加且颜色加深为紫色,原因是金属离子与花色苷中的官能团或取代基发生络合反应,形成较为稳定的络合物,因而起增色或褪色的作用[23]。结果表明,加工和储藏紫薯花色苷时应尽量避免与金属离子Mg2+、Ca2+、Zn2+、Fe3+、Al3+及其器皿接触,但可在含Mg2+、Ca2+、Al3+的食品中作为增色剂。
3 结论与讨论
(1)紫薯花色苷提取最佳工艺参数为:酸醇比为1∶2(V/V)、提取温度 70 ℃、提取时间 12 min、料液比为1∶2(g/mL)。此条件下色素提取液吸光值达到最佳值,为 3.026。
(2)紫薯花色苷在温度50 ℃以下较稳定,可以耐受一般食品饮料的热处理;对光敏感,应避光储藏;在偏酸性介质中较为稳定,在碱性介质中极不稳定;食品添加剂对于稳定性影响不大;色素对H2O2有一定的耐受性且强于还原剂NaHSO3;金属离子Na+、K+、Ca2+对色素溶液的稳定性无明显影响,Mg2+、Ca2+、Al3+具有增色作用,但不宜与含有Fe3+、Zn2+的物质共存。
