肿瘤免疫治疗研究的新进展
——免疫检查点阻断及CAR-T治疗*
2020-07-26王宇飞贾安娜王悦心杨秋立刘光伟
余 青 王宇飞 贾安娜 王悦心 杨秋立 刘光伟
(北京师范大学生命科学学院,教育部细胞增殖与调控生物学重点实验室 北京 100875)
肿瘤是危害人类健康的最重要疾病之一,由于肿瘤的异质性和不稳定性,目前仍缺乏治疗肿瘤的有效手段。机体的免疫系统在抗肿瘤中发挥着重要的作用,基于免疫系统的免疫治疗通过药物或体外基因编辑技术调节活化免疫系统,增强机体免疫系统对肿瘤细胞的杀伤作用或控制肿瘤细胞的生长。肿瘤免疫治疗已成为目前备受关注的热点研究领域。2018年,美国科学家詹姆斯·艾利森和日本科学家本庶佑因对免疫治疗研究作出卓越贡献而获得诺贝尔生理学或医学奖。本文结合诺奖研究成果,总结了目前免疫检查点阻断疗法和CAR-T 细胞过继移植免疫疗法研究中取得的新进展,并初步展望了未来的发展前景。
1 肿瘤免疫治疗简介
肿瘤免疫治疗泛指各种利用免疫系统诱导或恢复细胞毒性T 细胞和其他免疫效应细胞的能力,从而识别和消除癌症的治疗方法。与传统的化疗或分子靶向治疗不同,肿瘤免疫疗法针对效应免疫细胞,而不是肿瘤细胞,这是肿瘤免疫治疗最为独特新颖之处。肿瘤免疫治疗通过诱导、激活和扩增肿瘤特异性细胞毒性T 细胞和其他类型免疫细胞,导致持久的临床免疫应答。随着人们对免疫系统和免疫监视的理解加深,肿瘤免疫治疗得到很好的发展。
在肿瘤免疫应答反应中,自然杀伤细胞(natural killer,NKs)和T 细胞是主要的免疫效应细胞,这些效应细胞能被肿瘤细胞及肿瘤细胞附近的巨噬细胞和基质细胞分泌的促炎细胞因子所活化,由于肿瘤细胞的高度异质性,具有较低免疫原性的肿瘤细胞能逃脱效应细胞的清理,并在特定条件下扩增。在此过程中,肿瘤细胞的抗原变异能逃避宿主的免疫防御系统。针对逃逸的肿瘤细胞可能具有较低的免疫原性特征,临床上可采用改变T 细胞表面受体的结构,从而提高T 细胞对肿瘤细胞的识别能力,发挥清除肿瘤细胞的作用。
较低的免疫原性是肿瘤细胞逃逸效应T 细胞清理作用的机理之一。此外,肿瘤细胞可调节活化抑制检查点途径,降低效应T细胞活性。也可通过肿瘤组织中浸润的抑制性免疫细胞,例如,调节性T 细胞(regulatory T cells,Tregs)、髓系免疫抑制细胞(myeloid-derived suppressor cells,MDSCs)等,以及分泌免疫抑制性细胞因子,例如,转化生长因子β1(transforming growth factor β1,TGFβ1)和白细胞介素10(interleukin 10,IL-10)等,构建有利于肿瘤生长的微环境。T 细胞和NKs 细胞的完全活化需要多个表面受体的协同参与,这些受体通过免疫突触与其同源配体结合,活化T 细胞。免疫检查点是T 细胞产生免疫耐受的主要机制,能调节T 细胞反应的幅度和持续时间,防止组织损伤。由于肿瘤细胞可利用免疫检查点抑制T细胞的活性,因此,临床上通过阻断免疫检查点,就可有效调节T 细胞的免疫活性,从而增强T细胞对肿瘤细胞的杀伤作用。
2 肿瘤免疫治疗的机理
基于肿瘤细胞逃逸T 细胞杀伤作用的机理,科学家开发了多种激活T 细胞活性的免疫治疗方法。近期,免疫检查点阻断疗法和嵌合抗原受体T 细胞免疫疗法,取得了显著的进展,也受到广泛关注。
2.1 免疫检查点阻断疗法 免疫检查点是指免疫系统中存在的各种抑制性信号,这种抑制作用对于维持自身耐受,调节外周组织中正常生理免疫反应至关重要。肿瘤细胞利用免疫检查点抑制T 细胞的活性,是肿瘤免疫逃逸的主要机制之一。临床上阻断免疫检查点的免疫疗法在肿瘤治疗中取得了很好的效果,其中效果显著的是针对细胞毒性T 细胞相关蛋白4(cytotoxic-T-lymphocyte associated protein 4,CTLA4)和程序性细胞死亡蛋白1(programmed cell death 1,PD1)这2类免疫检查点蛋白的阻断剂,而针对PD1 阻断剂的肿瘤治疗效果优于针对CTLA4 阻断剂的治疗效果。
CTLA4 是T 细胞表面重要的免疫检查点受体,表达于T 细胞和NKs 细胞表面,是激活或抑制T 细胞介导的免疫应答的一个关键分子[1]。CTLA4 能与抗原提呈细胞(antigen-presenting cells,APCs)表面的配体B7-1(CD80)和B7-2(CD86)结合(图1)。在正常生理条件下,CTLA4 与CD80/CD86 的结合能抑制T 细胞活化,从而抑制细胞内的免疫应答反应。阻断CTLA4 蛋白位点,一方面能抑制Tregs 对T 细胞的活性抑制作用,同时能阻断其与抗原提呈分子表面的配体B7 结合,因而能有效活化T 细胞,增强T 细胞抗肿瘤效应[2]。2010年,CTLA4 抗体获得美国食品药品管理局许可,这是应用免疫检查点阻断疗法研发的第1 个获得许可的药物。
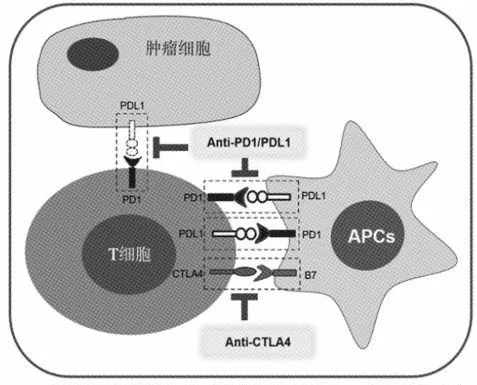
图1 免疫检查点阻断疗法的机理
PD1 是广泛表达于多种免疫细胞表面的蛋白,例如,活化的T 细胞、B 细胞、NK 细胞、单核细胞和树突状细胞等。在正常淋巴组织中,PD1 能与其配体PDL1/PDL2 结合,抑制T 细胞增殖、细胞因子的分泌和细胞毒活性[3-4]。PDL1 持续性地表达于多种细胞表面,例如,T 细胞、B 细胞、树突状细胞、巨噬细胞、间充质干细胞和骨髓来源的肥大细胞,同时也表达于肿瘤细胞表面。表达于肿瘤细胞表面的PDL1 能抑制局部T 细胞的抗肿瘤免疫应答,使肿瘤细胞可逃逸NK 细胞或T 细胞的免疫监视。在肿瘤微环境中,肿瘤细胞与免疫细胞之间存在复杂的分子相互作用及共刺激配体受体之间的相互作用。肿瘤细胞中固有的致癌信号,例如,AKT、EGFR、KRAS 等,能上调PDL1 的表达;而炎症信号却能促进肿瘤细胞或其他细胞表面高表达PDL1 配体蛋白(图1)。临床前研究表明,阻断PD1/PDL1 之间的相互作用能增加效应T 细胞的数量,增强肿瘤特异性T 细胞的细胞毒活性,促进促炎细胞因子的产生,同时减少肿瘤位点Treg的数量,有效发挥抑制肿瘤的效应[3]。
2.2 嵌合抗原受体T 细胞免疫治疗 细胞过继移植免疫疗法是取患者自身的免疫细胞(主要是T 细胞),体外进行基因修饰、扩大培养,从而提高免疫细胞对肿瘤细胞的识别和杀伤能力,最后将这些经过修饰的免疫细胞回输患者体内,发挥对体内的肿瘤细胞进行清除的效应。随着对T 细胞遗传操作方法的改进,目前已能通过基因编辑方法在体外对能识别肿瘤细胞特定抗原的T 细胞进行大量扩增。嵌合抗原受体(chimeric antigen receptor,CAR)是一种人工合成的T 细胞受体,能指导T 细胞识别肿瘤细胞特异性抗原,是细胞过继移植免疫治疗的方法之一[4]。通过嵌合抗原受体(CAR)的导入,T 细胞的生物特性可被重新定向,以靶向肿瘤细胞特异性表达的抗原。大多数的CAR 利用抗体单链可变区片段(a short-chain fragment from the variable region,scFv)识别其相应的特异性抗原,而不依赖于MHC 表达,具有类似于抗体的结合特性,该抗原结合域通过一个额外的细胞铰链和跨膜结构域与细胞内信号基序(通常源自CD3-ζ 链)相连(图2)。CD3-ζ 是TCR 信号传导的蛋白中心,其内域包含3 个基于免疫受体酪氨酸的激活基序(immunoreceptor tyrosine -based activation motifs,ITAMs),在TCR 信号传递级联启动过程中磷酸化,是T 细胞活化的核心。第2 代和第3 代CAR结构体将CD28、41BB(CD137)或OX40 等共刺激分子的信号域与CD3-ζ 域串联(图2),从而在临床前和临床均增强了疗效。通过这种设计,CAR分子能通过内源性TCRs 的信号域将不同T 细胞群体的抗原特异性重定向到CAR 同源抗原,随后激活抗原依赖的T 细胞。

图2 T 嵌合抗原受体(CARs)的结构示意图
3 目前肿瘤免疫治疗的临床效果
随着人类对细胞免疫和肿瘤与宿主免疫系统之间相互作用的理解逐渐加深,过去几十年来,免疫治疗取得重大突破,多种免疫检查点阻断药物已获得美国食品药品管理局的许可(表1),CAR-T细胞免疫疗法在临床上也取得很好的治疗效果。

表1 已上市免疫检查点药物汇总
3.1 免疫检查点阻断治疗的临床效果 在过去的10年中,免疫检查点抑制剂已经完全改变了几种实体癌症的治疗策略。6 种免疫检查点抑制剂派姆单抗(pembrolizumab,anti-PD1 单抗制剂)、纳武单抗(nivolumab,anti-PD1 单抗制剂)、伊匹单抗(ipilimumab,anti-CTLA4 单抗制剂)、德瓦鲁单抗(durvalumab,anti-PD1/PDL1 单抗制剂)、阿特珠单抗(atezolizumab,anti-PDL1 单抗制剂)和最新上市的anti-PDL1 单抗制剂BAVENCIO(avelumab,暂无中文名)已被批准用于治疗黑色素瘤、非小细胞肺癌(non-small-cell lung cancer,NSCLC)、肾细胞癌、尿路上皮癌和头颈癌,其中在黑色素瘤和NSCLC 中取得了尤其显著的结果。anti-PD1 和anti-PDL1 单独使用,或与anti-CTLA4 结合使用,在癌症晚期患者的治疗中都获得了很好的效果。Keynote-024 研究表 明,在高 表达PDL1 的晚期NSCLC 患者中,中位存活期(the median overall survival,OS)达到30 个月(95%置信区间为18.3 个月以上)[5]。近期,Keynote-001 的5年期随访结果表明,无论PDL1 评分如何,接受派姆单抗治疗的初治性NSCLC 患者平均OS为22.3 个月(95%置信区间为17.1~32.3 个月)[6]。同样的,在CheckMate067 研究中,一线治疗中使用纳武单抗治疗的晚期黑色素瘤患者在的OS 值为36.9 个月(95% 置信区间为28.3 个月以上),而使用纳武单抗联合伊匹单抗治疗的患者OS 值尚未达到36.9 个月[7]。
在治疗过程中,患者可能会因为疾病的进展或毒性反应而停止使用。针对那些对免疫检查点抑制剂反应时间较长的患者,且临床表现无明显毒性,用相同的或另一个免疫检查点抑制剂再次进行治疗可能是一个有吸引力的选择。但由于潜在的毒性反弹和/或新的副作用,大多数医生并不很支持这种选择。尽管没有得到广泛的认可,国家综合癌症网络(the National Comprehensive Cancer Network,NCCN)指南允许考虑对进展期患者再次使用免疫检查点抑制剂,但在考虑免疫相关的重大不良事件后恢复免疫治疗时,建议谨慎。再次使用免疫检查点抑制剂的策略主要包括再次使用相同的药物(anti-CTLA4 或anti-PD1/PDL1),或依次使 用anti-CTLA4 和anti-PD1/PDL1 药 物。在Keynote-010 研究中,PDL1 阳性的晚期NSCLC 患者先接受派姆单抗治疗,然后接受了派姆单抗的第二疗程治疗,根据事后分析的初步结果,他们中的大多数(78%)表现出部分应答或稳定的疾病[8]。在CheckMate 064 研究中,第1 组先使用伊匹单抗治疗,再使用纳武单抗治疗,第2 组使用相反的药物治疗顺序,结果在2 个序列策略中显示出相似的治疗相关的副作用等级[9]。
此外,除了CTLA4 和PD1,其他免疫检查点分子在肿瘤免疫治疗中也具有很好的应用前景,目前已有多种针对检查点分子的抗体进入临床试验,例如淋巴细胞活化基因3(lymphocyte activation gene-3,LAG-3)抗体[10]、T 细胞免疫球蛋白-3(T cell immunogloulin-3,TIM-3)抗体、T 细胞免疫球蛋白和ITIM 结构域蛋白(T cell immunogloulin and ITIM domain protein;TIGIT)抗体、V 域免疫球蛋白抑制T 细胞活化(V-domain immunogloulin-containing suppressor of T cell activation,VISTA)抗体[11]等。
3.2 CAR-T 细胞治疗的临床效果 表达嵌合抗原受体(CARs)的T 细胞过继转移在临床试验中表现出显著的效果,也提高了基于免疫新方法治疗癌症的前景。基因编辑的CAR-T 细胞疗法在肿瘤治疗中具有很大的潜力,在恶性血液肿瘤和实体瘤中都表现出很好的治疗效果[12-13]。
CAR-T 细胞疗法的最大进展是在血液恶性肿瘤的治疗上,目前已有2 种治疗方法获得FDA批准。靶向CD19 抗原的CAR-T 细胞疗法(以前被称为CTL019),最先被批准用于治疗25 岁以下的B 细胞前体急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)患者,这些都是难治性的,或是在2 次或多次复发的患者[14]。相关的研究结果表明,在重度预处理、复发/难治性B 细胞ALL的患者中,完全缓解率在60%~90%之间。随后,另一种靶向CD19 抗原的CAR-T 细胞治疗药物KTE-C19(axicabtagene ciloleucel,暂无中文名)被批准用于至少2 次治疗失败的大B 细胞淋巴瘤患者[15]。在B 细胞性非霍奇金淋巴瘤患者中,50%以上的患者在靶向CD19 抗原的CAR-T 治疗后产生了很好的治疗效果。近期,FDA 批准了Kymriah(tisagenlecleucel,暂无中文名)用于2 种或2 种以上系统疗法后复发或难治性大B 细胞淋巴瘤的成人患者,包括弥漫性大B 细胞淋巴瘤、高等级B 细胞淋巴瘤和滤泡性淋巴瘤的弥漫性大B细胞淋巴瘤[16]。此外,CAR-T 细胞疗法在慢性淋巴细胞性白血病和CAR-T 细胞疗法治疗多发性骨髓瘤的早期试验中,取得了成功,说明CAR-T细胞疗法在治疗B 细胞源性恶性肿瘤方面具有巨大研究前景。
CAR-T 细胞疗法在多种实体恶性肿瘤的治疗中也取得较好的研究进展,例如,胃肠道腺癌、生殖泌尿系恶性肿瘤等[13]。在结直肠癌中,靶向癌胚抗原(carcino-embryonic antigen,CEA)的CAR-T 细胞疗法已进入临床第1 阶段试验。此外,临床试验目前已在多种实体恶性肿瘤中开展,包括胰腺导管腺癌、肾细胞癌、前列腺癌、卵巢癌、乳腺癌、肺癌等恶性实体瘤。
4 目前肿瘤新免疫治疗存在的问题及其展望
肿瘤免疫治疗已在多种肿瘤类型的患者中显示出令人印象深刻和持久的疾病控制和良性反应。尽管肿瘤免疫治疗目前已取得了很好的进展,但只有一小部分患者受益于肿瘤免疫治疗。利用肿瘤免疫治疗根治癌症目前还面临巨大的挑战。
4.1 免疫检查点阻断免疫疗法面临的问题 CTLA4 抑制剂使用常会伴发皮疹、腹泻和内分泌异常等不良反应。此外,在CTLA4 抑制剂的治疗期间可能会伴发自身免疫反应等副作用,包括自身免疫性结肠炎[2]等。这一系列问题限制了CTLA4 抑制剂的使用,也提出了未来研发新型制剂面临的挑战。
PD1/PDL1 免疫检查点阻断疗法在多种癌症治疗中取得了突出的效果,但只有少数患者适合采用PD1/PDL1 免疫检查点阻断疗法。因此,目前的研究重点集中在适合这一治疗方法的人群,进行特异的生物标志物筛选。这样,就可在癌症治疗前明确潜在治疗有效的人群。另一个面临的挑战是,目前用于癌症标准治疗的近期疗效标准可能不适用于新兴的癌症免疫治疗。在癌症标准的治疗方法中,每6~8 周会通过各种放射学和实验室测试检测肿瘤反应,而在接受免疫检查点阻断治疗的癌症患者中,由于效应T 细胞活化和发挥功能需要的时间较长,因而肿瘤反应也经常会延迟。在一些患者中,停止PD1 阻断治疗后,肿瘤会继续消退。因此,迅速建立适当的评估癌症近期免疫治疗的标准,也是肿瘤免疫治疗面临的亟待解决的重要问题。
转化生物标志物的研究是克服PD1/PDL1 免疫检查点阻断疗法局限性的一种方法。生物标志物的研究在理解患者发病的潜在机制,以及有针对性地筛选适合不同治疗方法的患者等方面起着至关重要的作用。近年来,相关研究报道了多种肿瘤生物标志物,包括PDL1 在肿瘤细胞上的表达、高肿瘤突变负荷和新抗原。此外,几种免疫细胞来源的生物标志物与临床效果有较好的相关性。进一步评价突变负荷作为一种潜在的生物标志物,开发有效的肿瘤抗原特异性T 细胞检测方法,以区分免疫原性新表位和推测的新表位,具有重要意义。无论是单一治疗还是联合治疗,转化免疫生物标志物研究对于个性化癌症免疫治疗都是至关重要的。
4.2 CAR-T 细胞治疗面临的问题 随着随访时间的延长和适用疾病范围的扩大,CAR-T 细胞疗法的临床经验逐渐成熟,同时也发现了很多的问题,限制了CAR-T 细胞治疗的潜在优势。CAR-T细胞治疗相对于传统的细胞毒性治疗的一个主要优势是由CAR-T 介导的持续的抗肿瘤活性。T 细胞在激活后能持续数年至数10年,这是T 细胞的固有特性,CAR-T 细胞也显示出这种能力,并已被发现在多个患者中持续数年[4]。然而,这种持久性并不是普遍存在的,尽管患者的病情已得到初步控制,但仍有部分患者出现CAR-T 细胞过早丢失。这种情况在使用靶向CD19 的CAR-T 细胞治疗急性淋巴细胞性白血病患者中更为常见。在临床试验中,首次治疗得到缓解的患者中,虽然其体内的癌细胞仍保留CD19 抗原的表达,但是15%~25%的患者将经历白血病复发。
CAR-T 细胞治疗后复发是影响CAR-T 细胞疗法作为独立治疗整体疗效的主要障碍,肿瘤细胞保留目标抗原的表达,并伴有CAR-T 细胞的早期丢失,这只是CAR-T 细胞治疗后复发的第1 种模式。复发的第2 种模式包括表达靶抗原的恶性细胞的复发,其水平低于CAR-T 细胞治疗前的水平,尽管存在功能性CAR-T 细胞,这种抗原调控的复发仍然发生,因为靶抗原的表达水平低于激活剩余CAR-T 细胞所需的阈值。复发的第3 种模式是目标抗原(或表位)的表达完全丧失,CAR-T细胞的功能持续存在,但不再能识别恶性细胞。CAR-T 细胞免疫疗法的第1 种和第2 种模式表明,基因编辑的CAR-T 不能满足T 细胞反应的预期性质,即建立一个能对同一抗原的重新出现作出反应的持久的细胞群(第1 种模式),以及对微量抗原有反应的能力(第2 种模式)。这表明CAR-T 细胞的生物特征不能完全反映传统TCR驱动的T 细胞生物特性。第3 种复发模式表明,在一种已知具有适应能力的疾病中,对单一抗原产生强有力的T 细胞反应是有缺陷的。通过对CAR-T 细胞生物学的进一步了解,可解决CAR-T细胞持久性和抗原敏感性的问题,并可设计新的方法降低抗原丢失的风险,提高CAR-T 细胞免疫治疗的特异性[4]。另外,可采用全外显子组测序和生物信息学分析相结合的方法,构建具有新抗原特异性的CAR-T 细胞。
肿瘤免疫治疗是目前肿瘤治疗领域最有前景的治疗方法,人类寄希望于肿瘤免疫治疗根除癌症疾病。在临床前研究和临床结果中,多种肿瘤免疫治疗取得了突出的成效,但由于肿瘤的多样性和异质性,仍有多数癌症病例没有得到很好的治疗。一方面,现已应用的肿瘤免疫治疗面临着很多亟需解决的问题,随着人类对免疫系统和免疫细胞与肿瘤细胞相互作用的认识加深以及科技的不断进步,更好的方案将被提出;另一方面,根据肿瘤细胞免疫逃逸机制及免疫系统的抗肿瘤免疫机理,更多的治疗方案将被提出,例如,针对肿瘤细胞及相应成分的各种疫苗、诱导机体特异性免疫应答反应的的树突状细胞疫苗等。此外,针对自然杀伤细胞的多种肿瘤免疫治疗也已进入临床试验阶段[17]。
