牦牛DQA2基因单核苷酸多态性及其生物信息学分析
2020-07-24李倬陈朗姜涛刘丽霞张丽王瑞李耀东
李倬,陈朗,姜涛,刘丽霞,张丽,王瑞,李耀东
(西北民族大学生命科学与工程学院,兰州730030)
牦牛(Bos mutus)是一种古老而原始的物种,家养牦牛由野生牦牛经过长期的自然进化和人工驯化而来,属于牛科(Bovidae)牛亚科(Bovinae)牛属(Bos)牦牛亚属(Poephagus),是唯一能在青藏高原的高寒牧区繁衍的牛亚科动物,具有耐寒、耐粗、耐劳、耐缺氧等特点[1-2]。
主要组织相容性复合体(major histocompatibility complex,MHC)是一组紧密连锁的基因簇,在对病原体抗原的免疫反应过程中发挥重要作用,具有高度的遗传多态性,与哺乳动物对许多传染病和代谢疾病的抗性或易感性有关[3-4]。牛MHC被称为牛白细胞抗原(bovine lymphocyte antigen,BoLA),位于牛的第23 号常染色体上[5],结构与其他哺乳动物的MHC相似,包括Ⅰ、Ⅱ和Ⅲ类基因,其中BoLAⅡ类基因通过向T细胞呈递连接在肽结合槽上的加工肽抗原而发挥作用[6]。BoLA-DQA基因位于BoLAⅡ类基因的α亚区,编码α1功能区,是BoLA抗原分子的重要组成部分,由紧密相连的重复基因簇组成,包含5个基因座,其中DQA1、DQA2和DQA3基因是高度多态的[7-9]。牛DQA基因具有高度多态性,尤其是在抗原相关的结合区内[10],迄今为止,IPD数据库(https://www.ebi.ac.uk/ipd/mhc/)中牛的DQA等位基因有65个。牛DQA基因与疾病的易感性和抗性相关[11-13],也可作为乳腺免疫应答和牛结核病感染相关的候选基因[14-15]。
单核苷酸多态性(single nucleotide polymorphism,SNP)是在基因组水平上由单个核苷酸的变异(碱基的缺失、插入、转换和颠换等)所引起的DNA序列多态性,是最具有潜力的第3代分子标记方法,而直接测序法是最直接、最准确的检测SNP位点的方法[16]。本研究以青海大通牦牛为研究对象,采用基因组DNA混合池扩增产物直接测序的方法,对DQA2基因的SNP进行分析,并对其mRNA和蛋白质二级结构进行预测和分析,为牦牛MHC基因的深入研究提供基础资料,也为MHC基因的致病机制和免疫机制探究提供有利条件,还为牦牛抗病分子标记筛选提供理论基础。
1 材料与方法
1.1 试验材料
从青海省大通种牛场购买牦牛55头,采集其尾静脉血液各10 mL,并立即于-20 ℃条件下冷冻保存,带回实验室。采用传统的酚-三氯甲烷(氯仿)抽提法提取牦牛血液基因组DNA,利用UV1800 紫外分光光度计(苏州岛津仪器有限公司)和0.8%的琼脂糖凝胶电泳检测基因组DNA的浓度和纯度。
1.2 引物设计
根据GenBank 数据库中普通牛DQA2基因(登录号:XM_024983852)序列,利用NCBI(https://www.ncbi.nlm.nih.gov)在线软件Primer-BLAST 设计引物,引物信息见表1,分段扩增获得牦牛DQA2基因全部外显子和部分内含子序列,引物由苏州金唯智生物科技有限公司合成。

表1 DQA2基因引物信息Table 1 Primer information of DQA2 gene
1.3 基因组DNA 混合池的构建和聚合酶链式反应扩增
将每个基因组DNA质量浓度调整至100 ng/µL,等量混合后构建DNA 混合池,以混合池DNA 为模板进行聚合酶链式反应(polymerase chain reaction,PCR)扩增。PCR反应体系(20µL):混合DNA 1 μL,2×PowerTaq反应聚合酶(北京百泰克生物技术有限公司)11 μL,上、下游引物(10 μmol/L)各0.4 μL,灭菌超纯水7.2 µL。扩增条件:94 ℃预变性5 min;94 ℃变性30 s,退火(退火温度见表1)30 s,72 ℃延伸30 s,30 个循环;最后,72 ℃延伸10 min;4 ℃保存。扩增产物利用1%琼脂糖凝胶电泳进行检测。
1.4 DQA2 基因扩增序列测定与分析
选取扩增效果良好的牦牛DQA2基因4段引物的PCR 扩增产物送至苏州金唯智生物科技有限公司进行双向测序,利用Editseq软件对测序峰图进行检测后筛选SNP 位点,并利用MEGA 6.0 软件进行核苷酸和氨基酸序列比对。
1.5 等位基因频率估算
利用软件MWSnap的标尺工具测量DQA2基因SNP 位点峰图的峰高,对各等位基因频率进行估算,估算公式为fi=hi/(ha+hb)。其中:i=a/b,fi表示SNP位点中a/b等位基因的频率,hi表示SNP位点中a/b等位基因的峰高,ha和hb分别表示测序峰图上等位基因a和b的峰高。
1.6 mRNA 和蛋白质二级结构预测
利用RNAfold 网页服务器(http://rna.tbi.univie.ac.at/cgi-bin/RNAWebSuite/RNAfold.cgi)和NPS(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)在线软件预测牦牛DQA2基因mRNA和编码的蛋白质二级结构。
2 结果与分析
2.1 牦牛DQA2 基因扩增结果
利用1%琼脂糖电泳检测牦牛DQA2基因的PCR 扩增产物,结果(图1)显示,DQA2基因各扩增片段大小均与预期相符,且条带清晰,特异性良好。
2.2 牦牛DQA2 基因SNP 位点筛选和等位基因频率估算
序列测定结果表明,牦牛DQA2基因共有14个SNP 位点,测序峰如图2 所示。牦牛DQA2基因的SNP 位点分别位于内含子1(g.135T>C)、外显子2(g.4296A>G 和g.4374A>C)、外显子3(g.5103G>A、g.5127C>A、g.5137T>C、g.5141G>A和g.5187C>T)和外显子4(g.5527A>G、g.5576G>C、g.5602C>T、g.5606G>A、g.5659C>T 和g.5666C>A)上,其中外显子2上的2个SNP、外显子3上的4个SNP和外显子4上的3个SNP是错义突变,共导致DQA2基因的9个氨基酸发生改变,具体突变信息见表2。对各SNP位点突变前后的等位基因频率进行估算,结果表明:仅有外显子3上的g.5137T>C位点突变前后等位基因频率相同,其余SNP位点突变前频率均大于突变后(表2)。
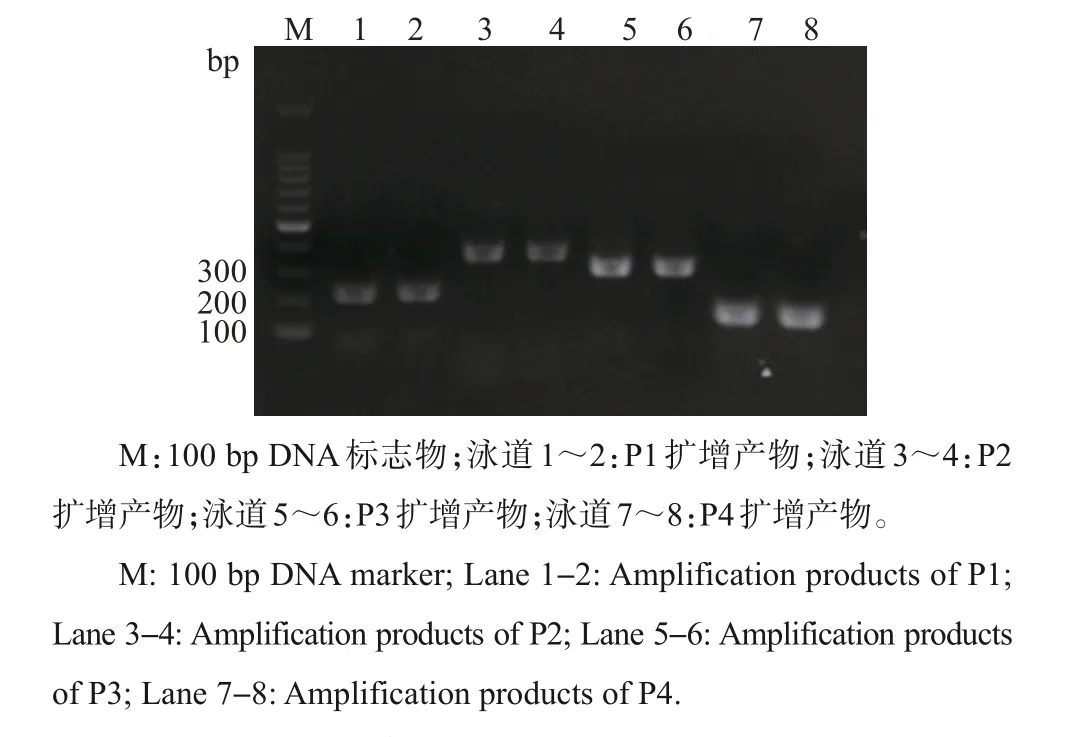
图1 牦牛DQA2基因PCR扩增结果Fig.1 Results of PCR amplification of DQA2 gene in yak
2.3 牦牛DQA2 基因mRNA 二级结构和蛋白质二级结构预测
利用RNAfold和NPS在线软件预测牦牛DQA2基因各SNP 突变前后的mRNA 二级结构和蛋白质二级结构,结果分别见图3 和表3:位点g.4374A>C、g.5527A>G、g.5576G>C和g.5606G>A的mRNA二级结构与突变前差异较大;8 个SNP 位点(g.4296A>G、g.4374A>C、g.5127C>A、g.5187C>T、g.5527A>G、g.5576G>C、g.5602C>T和g.5659C>T)的mRNA二级结构自由能有所降低,这些SNP位点均增大了牦牛DQA2基因的稳定性;而4 个SNP 位点(g.5103G>A、g.5137T>C、g.5141G>A 和g.5606G>A)的mRNA二级结构自由能有所增大,表明这4个位点均降低了牦牛DQA2基因的稳定性;仅有1 个SNP 位点(g.5666C>A)的mRNA 二级结构自由能与突变前相同,说明该位点对牦牛DQA2基因的稳定性没有影响。所有错义突变均使得DQA2蛋白质二级结构发生改变,突变前后二级结构各组分中无规则卷曲所占比例最高,其次为延伸链,β-转角所占比例最低。
3 讨论
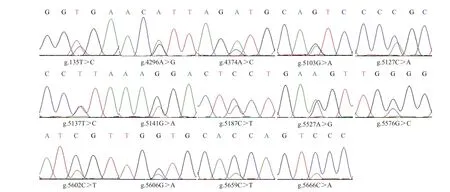
图2 牦牛DQA2基因SNP位点测序峰图Fig.2 Sequencing peak diagrams of SNP sites for DQA2 gene in yak
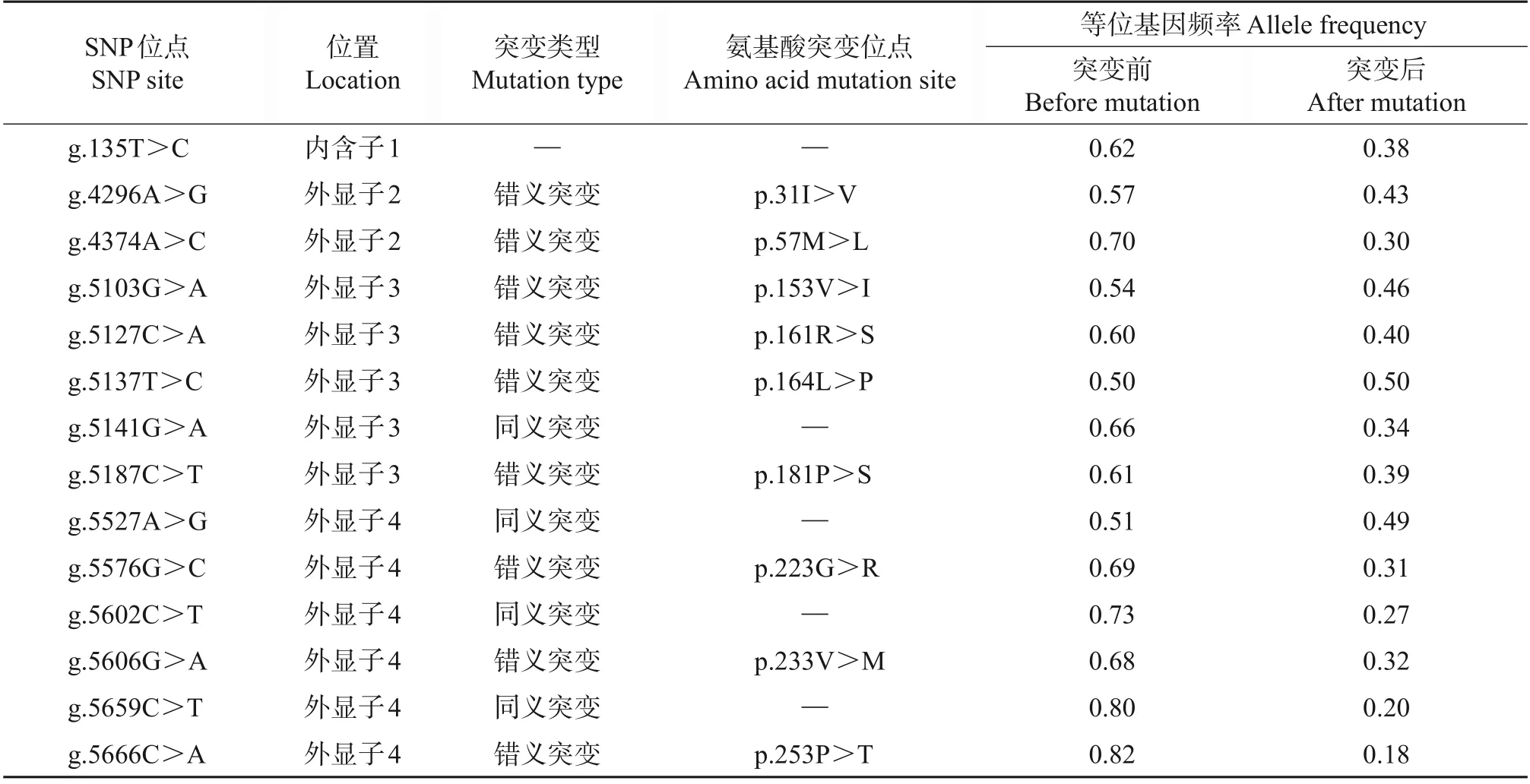
表2 牦牛DQA2基因SNP位点突变信息和等位基因频率Table 2 Mutation information and allele frequency of SNP sites for DQA2 gene in yak
MHC在哺乳动物免疫系统的发展中起着核心作用,其中位于Ⅱ类区域的DQ 分子的主要作用是引发CD4+T细胞反应[17]。BoLA单倍型具有重复的DQ基因,在病毒感染过程中,BoLA-DQ 分子呈现不同的病原体表位[18],且T细胞可以在DQ分子中识别Ag[19]。牛DQA2是BoLA的成员,是疾病的易感性和抗性遗传标记中的一个重要候选基因,研究其多态性对牛的抗病分子选育具有重要的意义。近年来,已有大量关于牛DQA2基因多态性和序列变异的研究。TRAUL 等发现野牛的3 个DQA2等位基因与普通牛序列无差异[20]。高树新在荷斯坦牛、西门塔尔牛和三河牛的DQA2基因外显子2上检测到20个多态位点[21]。NIRANJAN等发现水牛DQA2基因的α2 区域与普通牛差异较大[22]。HOU 等在奶牛DQA2基因上检测到13个新的SNP位点,其中有4个SNP导致蛋白质中氨基酸发生改变[23]。孙菲菲等在渤海黑牛DQA2基因外显子区域检测到3 个SNP 位点[24]。UGBO 等发现,牛DQA2基因上的77个氨基酸突变对其蛋白质功能有负面影响[25]。GE等发现,中甸牦牛DQA2基因的α1区域具有高度多态性[26]。XI 等研究表明,中国牦牛DQA2序列仅有α2 区域与普通牛有差异,其他区域均无差异[27]。MEMON 等克隆获得大额牛的DQA2基因序列,比对发现该基因与其他动物的DQA基因相似度较高,而与其他牛DQA的等位基因差异较大[28]。本研究在牦牛DQA2基因外显子区域共检测到13 个SNP位点,这些研究结果均表明牛DQA2基因具有较高的多态性。
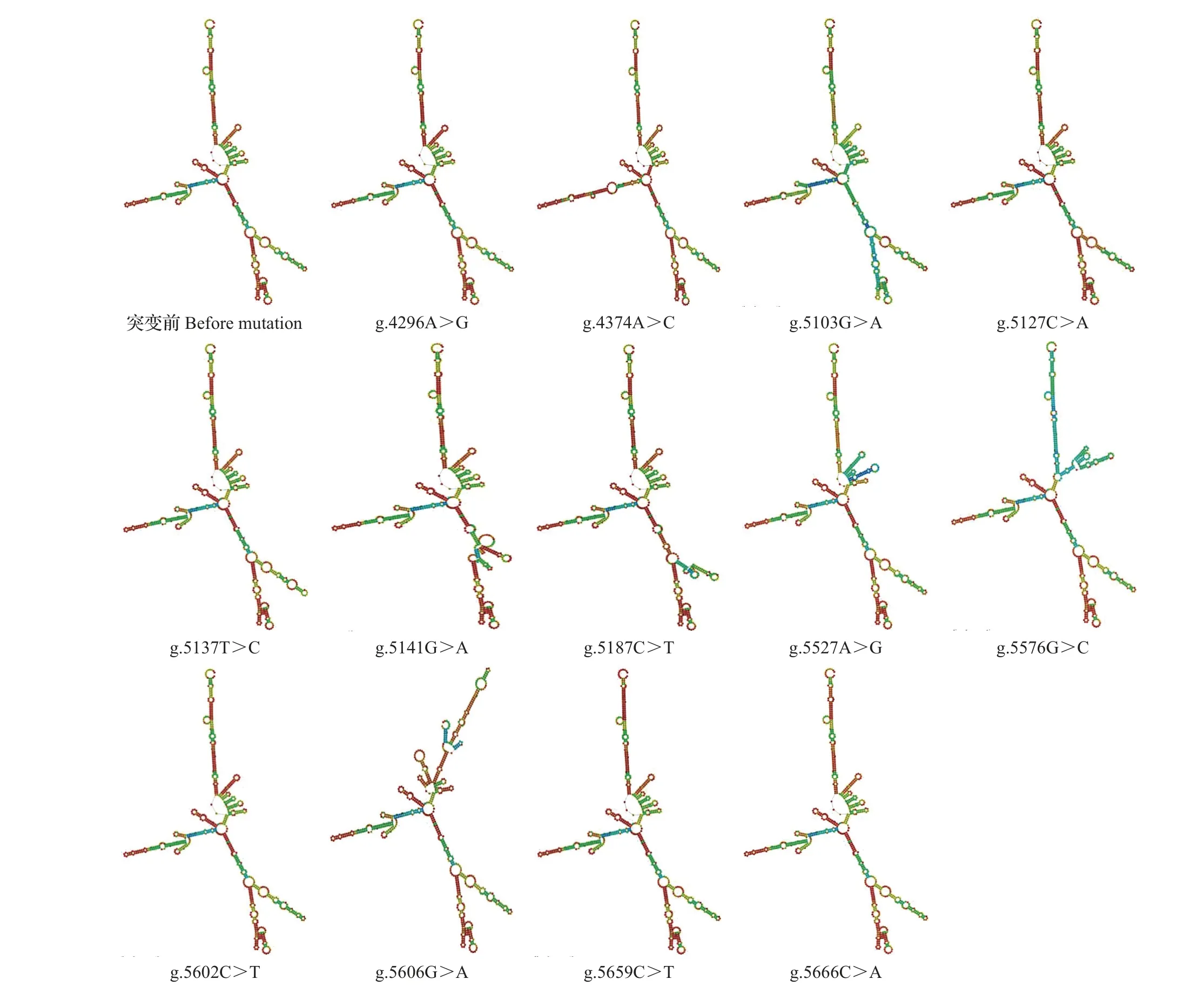
图3 牦牛DQA2基因SNP突变前后mRNA二级结构Fig.3 Secondary structure of mRNA of SNP sites before and after mutation in yak DQA2 gene
mRNA 二级结构稳定性与蛋白质表达量之间呈显著正相关,对翻译蛋白质的效率有很大影响,且对基因功能具有调控作用[29]。牦牛DQA2基因上的8个SNP位点增大了mRNA二级结构的稳定性,而4个SNP位点降低了mRNA二级结构的稳定性,这些改变可能对DQA2蛋白质的翻译和基因的功能有影响。基因外显子序列中的核苷酸错义突变能改变编码的氨基酸,从而改变蛋白质的高级结构,进一步使蛋白质的功能发生改变。牦牛DQA2上的氨基酸突变对其蛋白质二级结构造成了一定的影响,这有可能会改变该基因在牦牛免疫应答中的作用。另外,牦牛DQA2基因上的SNP位点位于具有抗原结合位点和编码α1、α2 功能区的外显子2、3 区域,以及包含跨膜区的外显子4 区域,发生在这些区域的氨基酸改变可能会对机体细胞的抗原呈递和跨膜运输产生影响,进而影响生物体对疾病的抗性。因此,对牦牛DQA2基因的SNP多态性进行研究可为牦牛疾病相关分子标记的筛选提供理论基础。
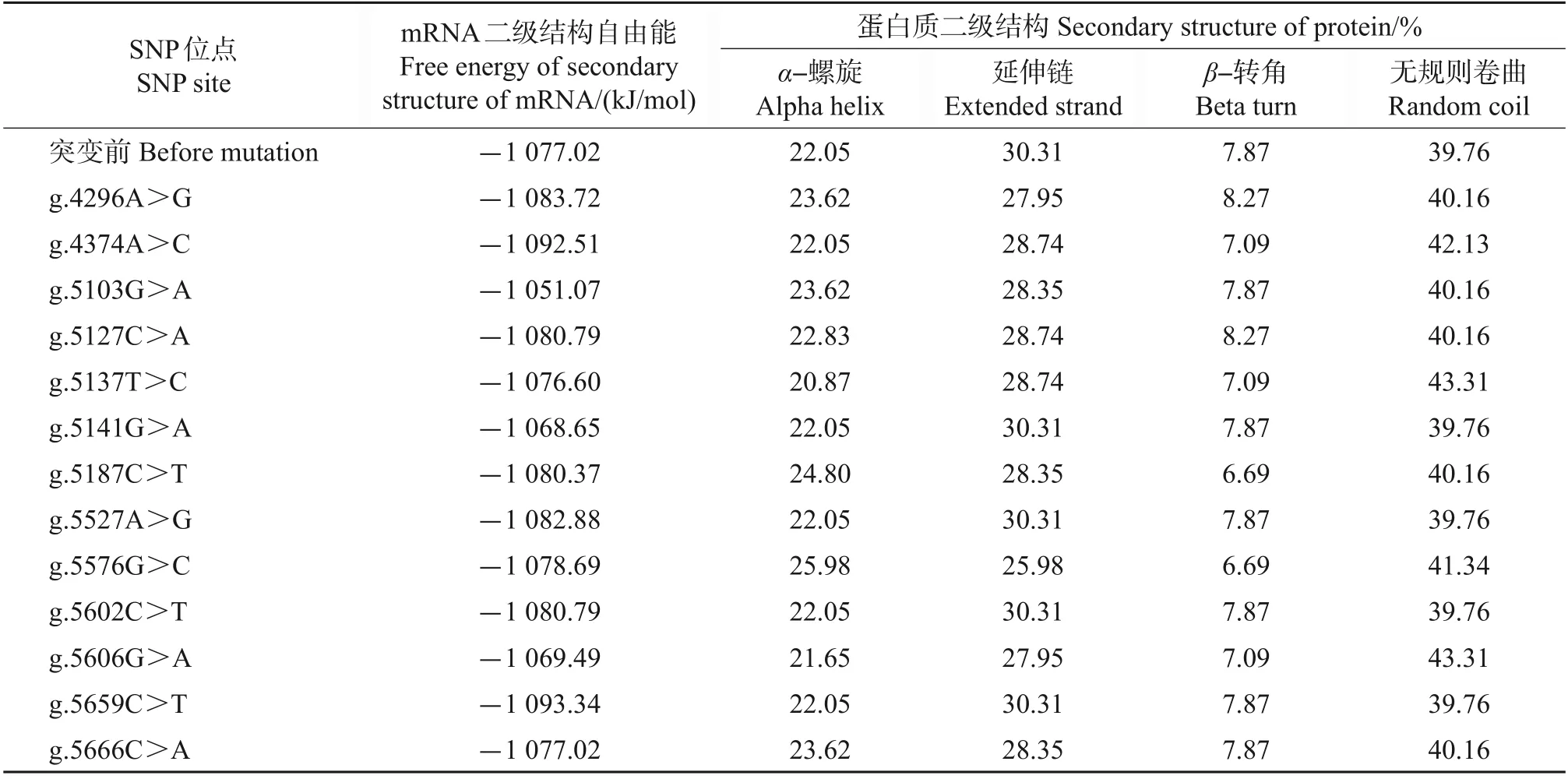
表3 牦牛DQA2基因SNP突变前后mRNA二级结构自由能和蛋白质二级结构Table 3 Free energy of secondary structures of mRNA and secondary structure of protein of SNP sites before and after mutation in yak DQA2 gene
