一种用于鉴定18种转基因大豆转化体的多靶标质粒的构建与应用
2020-07-24史宗勇陈子言祁琛王成赵梦晓李夏莹王文斌袁建琴许冬梅乔永刚刘建东张秀杰高建华
史宗勇,陈子言,祁琛,王成,赵梦晓,李夏莹,王文斌,袁建琴,许冬梅,乔永刚,刘建东,张秀杰*,高建华*
(1.山西农业大学生命科学学院,山西 晋中030801;2.农业农村部科技发展中心,北京100025)
在对转基因作物及其产品进行成分检测的过程中,必须设置相应的阳性对照用于对检测结果的判定。常用的核酸阳性对照通常有2种[1]:一种是特定的转基因作物转化体的基因组DNA(genomic DNA,gDNA)。目前,很多国家都在研发这类基因组DNA的标准物质(certified reference materials, CRMs)。其中,比较有代表性的是欧洲标准物质和测量研究所委员会(Institute for Reference Materials and Measurements European Commission,IRMM)研发的一系列的标准物质。这类阳性对照物质最具代表性,但是其制备流程烦琐,价格昂贵[2-3]。另一种是含有特定检测序列的质粒分子。质粒分子既可以包括1 种特异性检测序列,称为单靶标检测质粒(single target plasmid, STP),也可以包括多种特异性检测序列,称为多靶标检测质粒(multiple target plasmid,MTP)[3-6]。研究表明,上述质粒分子作为阳性分子时,效果与gDNA一致,可以作为理想的gDNA替代品[3,7-9]。当然,质粒分子作为阳性对照还有诸多优势,比如制备过程简单快捷,且成本低廉。尤其是MTP不仅可以同时包含一个物种的多种靶标序列,还可以包含不同物种的靶标序列,具有极大的灵活性,可以自由定制。因此,构建合理的MTP作为阳性质粒分子是目前转基因成分检测领域的重要研究内容。
大豆是重要的经济作物,也是转基因技术应用非常成熟的靶标之一。据国际农业生物技术应用机 构(International Service for the Acquisition of Agri-biotech Applications, ISAAA)统计,自1996 年以来,转基因大豆的种植面积逐年增加,2017 年的种植面积占全球转基因作物种植面积的50%,约9 490万hm2。在全球1.2亿hm2的大豆种植面积中,约77%为转基因大豆[10]。目前,我国尚未批准转基因大豆的商业化种植。但是,因加工等领域的大量需求,我国每年要进口大量的大豆种子,其进口量位居所有进口农产品首位。而大豆主要出口国,包括美国、巴西和阿根廷等的栽培大豆主要为转基因品种。因此,对这些大豆在进口过程中的检验检测和进入国内市场后的监督管理显得尤为重要和迫切。截至2019年1月8日,我国共批准了14种转基因大豆转化体(A2704-12、A5547-127、CV127、DAS-44406-6、DP305423、DP356043、FG72、GTS40-3-2、MON87701、MON87705、MON87708、MON87769、MON89788 和 SYHT0H2)和 2 种 杂 交 品 系(DP305423×GTS40-3-2 和MON87701×MON89788)的进口,用作加工原料(http://www.moa.gov.cn/)。需要特别指出的是,这些批准进口的大豆产品不允许用于种植。另外,我国在转基因大豆方面的研发也逐渐赶上了国际先进水平。比如,上海交通大学曹越平课题组自主研发的耐除草剂大豆SHZD32-1[11](选用的是杭州瑞丰生物科技有限公司研发的G10-epsps基因[12]),对除草剂草甘膦表现出良好的耐受性,具有极大的市场应用前景。
为方便对上述转基因大豆的检测和监管,需要全面准备相应的阳性物质。如果利用gDNA作为阳性物质,需要对上述十几种转化体提取基因组DNA,并分别进行标准物质的研发,工作量较大,且成本较高。如果将上述转化体的特征序列接入质粒载体,则将免去相应转基因作物的生产、gDNA的制备等烦琐过程,能够缩短生产周期并降低成本。目前,已有多种大豆转化体的多靶标质粒分子被报道,这些MTP主要分为2类。一类是针对单一转化体,但含有多个检测靶标序列的MTP 分子,该质粒包含特定转化体的多个特征序列,还有相应的大豆内标准基因等。比如,李飞武等构建了MON89788的检测质粒,其包含大豆内标准基因(大豆凝集素基因Lectin)的检测序列以及MON89788 的T-DNA插入位点两端的特征序列[13]。ZHANG 等构建了2种专用于检测GTS40-3-2的阳性质粒,并进行对比发现,对靶标序列的适当间隔有利于提高检测的可靠性和特异性[14]。许丽等也研制了GTS40-3-2的检测标准质粒[15]。目前,我国已批准并在售的转基因大豆标准质粒只有1 种——GBW10092,可用于对MON89788的检测和筛查(http://www.ncrm.org.cn)。另一类是针对多个转化体的MTP 分子。PI 等构建了一个含有多个转基因大豆转化体特征序列的阳性质粒pSOY,该质粒包含MON89788-5′、A2704-12-3′、A5547-127-3′、DP356043-5′、DP305423-3′、A2704-12-5′和A5547-127-5′等的特征序列,可用来对这几种转化体及其衍生物进行筛查[5]。
综上所述,我国已有的可用于转基因大豆转化体特异性筛查的阳性质粒分子种类不多,并且能够检测的转化体数量较少,无法满足目前转基因大豆品种推新和监测需求。因此,本文构建了一种可编辑的、涵盖18种转化体的多靶标质粒pDDID-1905。该质粒包含我国已经批准进口(食用或饲用)的14种独立转基因大豆转化体,3 种暂未批准进口但应用潜力较高的重要转化体,以及我国具有自主知识产权的重要转化体SHZD32-1的特征序列。该质粒也适用于我国批准进口的DP305423×GTS40-3-2和MON87701×MON89788 杂交品系鉴定。总之,质粒pDDID-1905 作为阳性分子覆盖度全面,具有重要的应用价值。
1 材料与方法
1.1 试验材料
试剂:Taq预混液(Ex TaqVersion 2.0)(TaKaRa公司,日本);AxyPrepTM微型质粒制备试剂盒[赛默飞世尔科技(中国)有限公司];限制性内切酶EcoRⅠ、HindⅢ、XhoⅠ[赛默飞世尔科技(中国)有限公司];标准DNA 分子1 kb plus DNA 梯形带和DL2000 DNA标志物[中科瑞泰(北京)生物科技有限公司]。DNA序列由南京金斯瑞生物科技有限公司合成。
大肠埃希菌(Escherichia coli)TOP10 菌株以及pUC18质粒,由农业农村部农作物生态环境安全监督检验测试中心(合肥)馈赠。
1.2 试验方法
1.2.1 信息收集
根据农业农村部每年发布的《农业转基因生物安全证书(进口)批准清单》统计我国已经批准进口的转基因大豆转化体(http://www.moa.gov.cn/ztzl/zjyqwgz/spxx/);根据农业农村部发布的转基因植物及其成分检测的国家标准,统计我国已经建立检测标准的转基因大豆转化体(表1)。
1.2.2 pDDID-1905 质粒的构建与鉴定
收集上述大豆转化体的特征序列。将这些转化体的特征序列以及1 个大豆的内标准基因Lectin的检测序列(用于判别被测样品是否含有大豆成分)拼接,进行人工合成后,克隆至pUC18 载体的EcoRⅠ和HindⅢ位点之间,获得pDDID-1905质粒。含有pDDID-1905质粒的大肠埃希菌TOP10菌株命名为T10pDDID-1905,用于质粒的保存或扩繁。
将T10pDDID-1905菌株在含有100 μg/L的LB(Luria-Bertani)固体培养基上划线,并于37 ℃条件下过夜培养。挑取单克隆,接入100 μg/L的LB液体培养基中,于37 ℃条件下,以250 r/min 振荡培养12 h。提取质粒,并进行限制性内切酶消化。
1.2.3 pDDID-1905 质粒的定量与稀释
利用NanoDropTM紫外分光光度计测定质粒DNA 的浓度。然后,根据pDDID-1905 质粒的分子质量(4.64×106Da),计算其拷贝数(copies)。根据式(1)的计算结果,将质粒DNA稀释为1×104copies/μL。将稀释好的质粒置于-20 ℃冰箱中保存,备用。
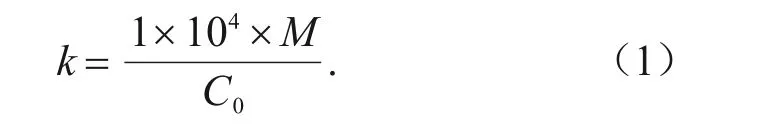
式中:k为稀释比例;M为单个质粒分子质量,ng;C0为所测质粒原液质量浓度,ng/μL;1×104为稀释后浓度,copies/μL。
1.2.4 pDDID-1905 质粒的功能验证
按照各个大豆转化体成分定性检测的国家标准,选择对应的引物进行聚合酶链式反应(polymerase chain reaction,PCR)扩增,分别检测pDDID-1905质粒所含特征序列的可用性。PCR反应体系和反应条件参照每个转化体成分定性检测国家标准(表2)。
以pDDID-1905 质粒作为阳性物质,对一个含有多种转基因成分的转基因大豆粉末样品进行检测。该样品含有转基因大豆A5547-127、CV127、DP305423、DAS-44406-6、DAS-68416-4、FG72、GTS40-3-2、MON87701、MON87705、MON87708、MON87751、MON87769、MON89788 和SHZD32-1的成分。
2 结果与分析
2.1 转基因大豆的信息收集
数据统计发现,我国目前已批准进口14种独立转化体用作加工原料,包括A2704-12、A5547-127、CV127、DAS-44406-6、DP305423、DP356043、FG72、GTS40-3-2、MON87701、MON87705、MON87708、MON87769、MON89788 和SYHT0H2 等。除此之外,还有3 种转化体DAS-68416-4、DAS-81419-2和MON87751,虽然尚未被批准进口,但是已经发布或正在研制相应的转基因植物及其成分检测的国家标准。另外,SHZD32-1 是国内自主研发且极具推广潜力的转基因大豆转化体。相应的转基因植物及其成分检测国家标准也已经发布(表1~2)。因此,本文将针对上述18 种转化体构建检测用途的阳性质粒分子。
2.2 pDDID-1905 质粒及其鉴定
将18种转基因大豆独立转化体的特征序列,以及1 个内标准基因(大豆凝集素基因Lectin)的靶标序列按顺序排列,该序列全长为4 881 bp(图1)。将该序列进行人工化学合成,然后将合成好的片段接入pUC18 载体的HindⅢ及EcoRⅠ位点之间,获得pDDID-1905 质粒(图2)。该质粒中含有一些唯一的限制性内切酶识别位点,包括HindⅢ、AgeⅠ、NcoⅠ、ApaⅠ、AflⅡ、SalⅠ、MluⅠ、XhoⅠ、KpnⅠ、PflMⅠ、SacⅠ、SwaⅠ以及EcoRⅠ等,可用于后期更新或扩展。
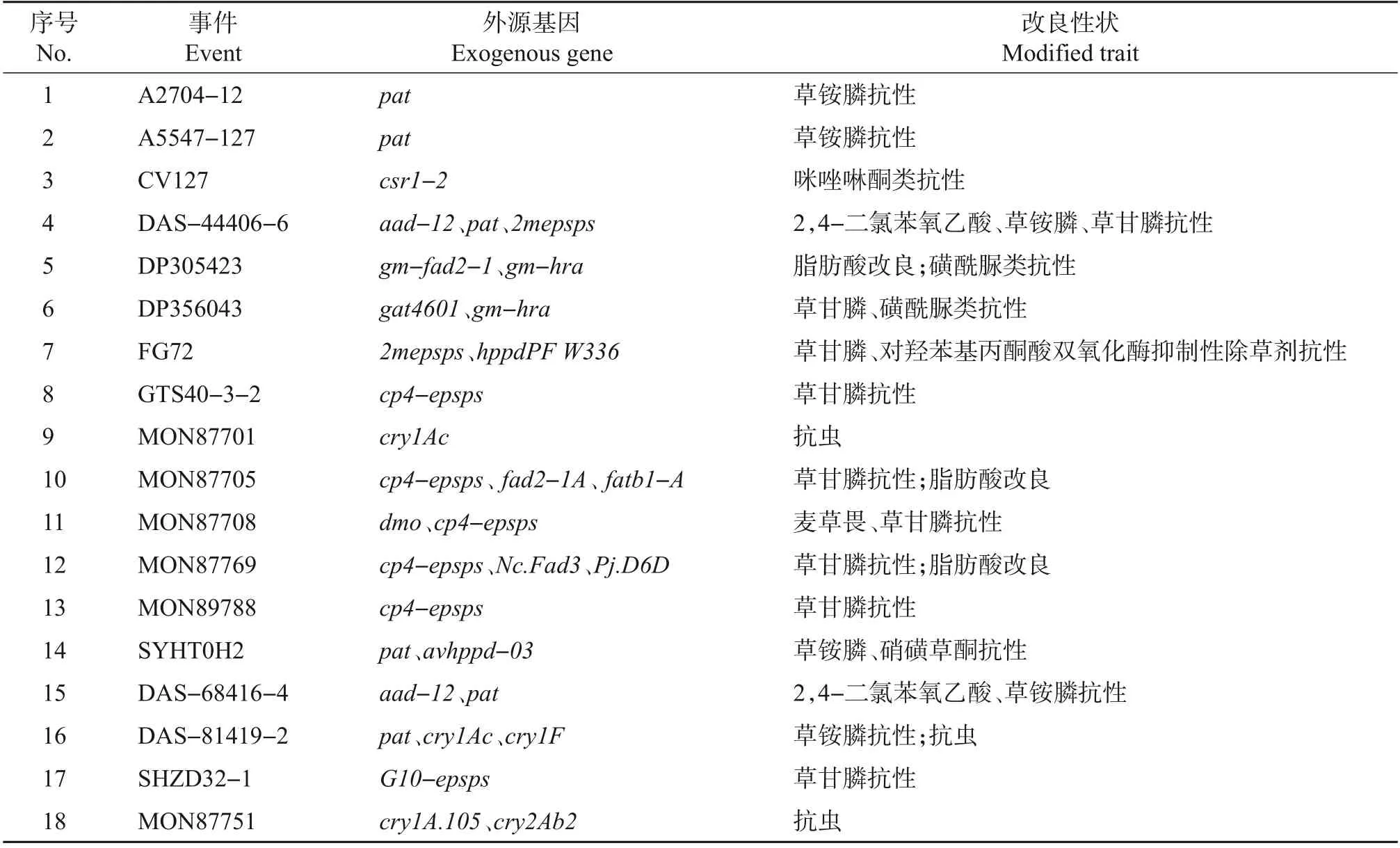
表1 18种转基因大豆转化体事件及其改良性状Table 1 Eighteen genetically modified soybean events and their modified traits
对pDDID-1905进行限制性内切酶消化。结果显示,经EcoRⅠ和HindⅢ双酶切后,获得2 条酶切产物,长度分别约4 800 和2 600 bp;再向反应液中加入XhoⅠ继续酶切,4 800 bp 的条带变成约3 500和1 300 bp的条带(图3)。该图谱与预期结果相符,说明插入片段正确。对pDDID-1905进行序列测定和拼接,进一步确定其正确性。
2.3 pDDID-1905 质粒功能验证
使用相应转化体成分检测的国家标准中的引物(表2),对pDDID-1905 质粒中包含的18 种转化体特征序列和1个内标准基因靶标序列进行PCR检测,以验证其可用性。结果显示,在含有10 000 个质粒拷贝的PCR反应体系中,目的片段均能够获得理想的扩增,且扩增片段的大小与预期一致(图4和表2)。
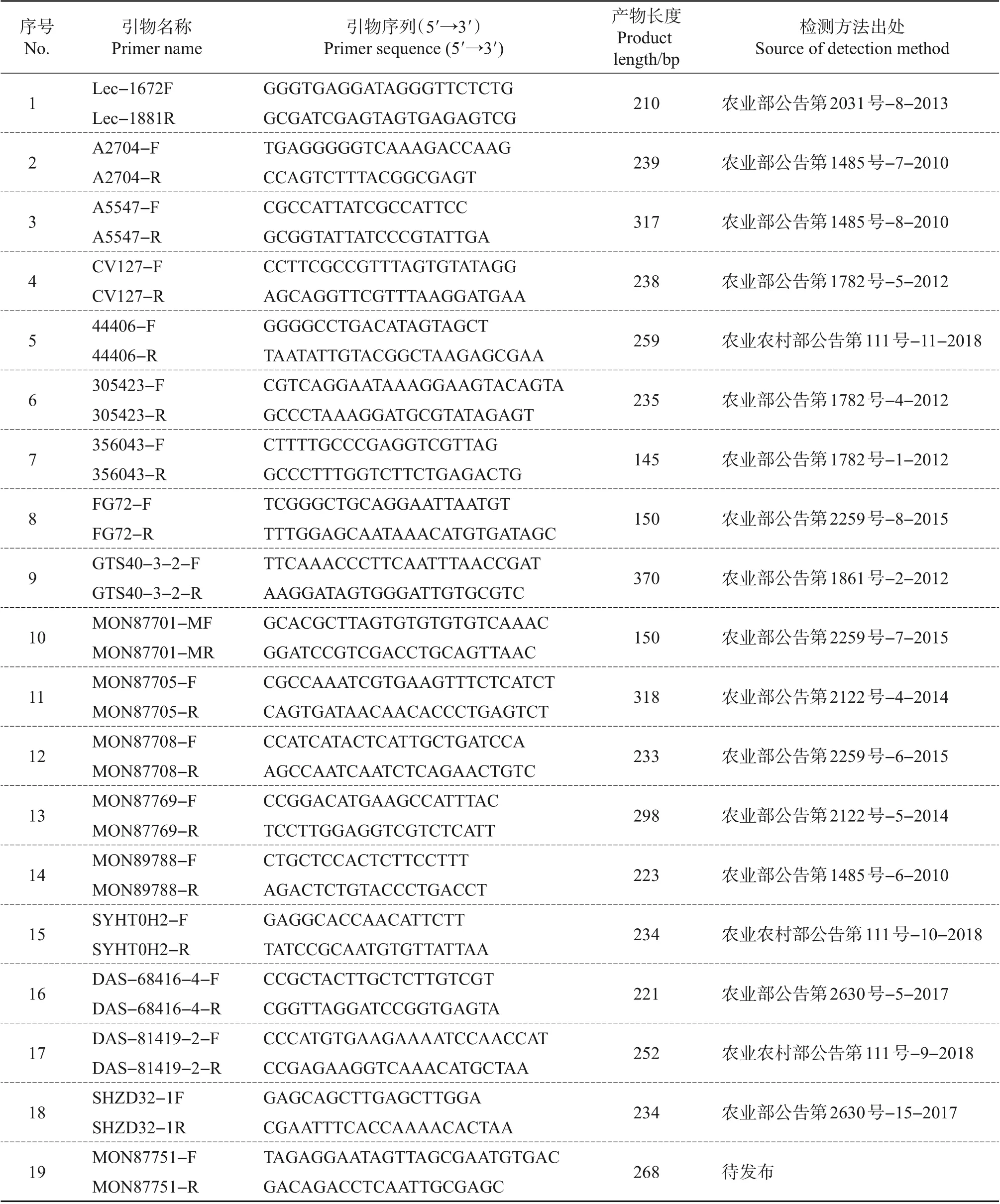
表2 19种靶标序列的PCR检测Table 2 PCR detection of 19 target sequences
以pDDID-1905 质粒作为阳性物质,对一种含有多种转基因成分的转基因大豆粉末样品进行检测。结果显示,14种转基因大豆成分,包括A5547-127、CV127、DP305423、DAS-44406-6、DAS-68416-4、FG72、 GTS40-3-2、 MON87701、 MON87705、MON87708、MON87751、MON87769、MON89788 和SHZD32-1 均被检出,而另外4 种转基因大豆成分(A2704-12、DP356043、DAS-81419-2 和SYHT0H2)未被检出(图5)。该结果符合预期,说明该质粒能够作为阳性物质,用于转基因大豆成分检测。

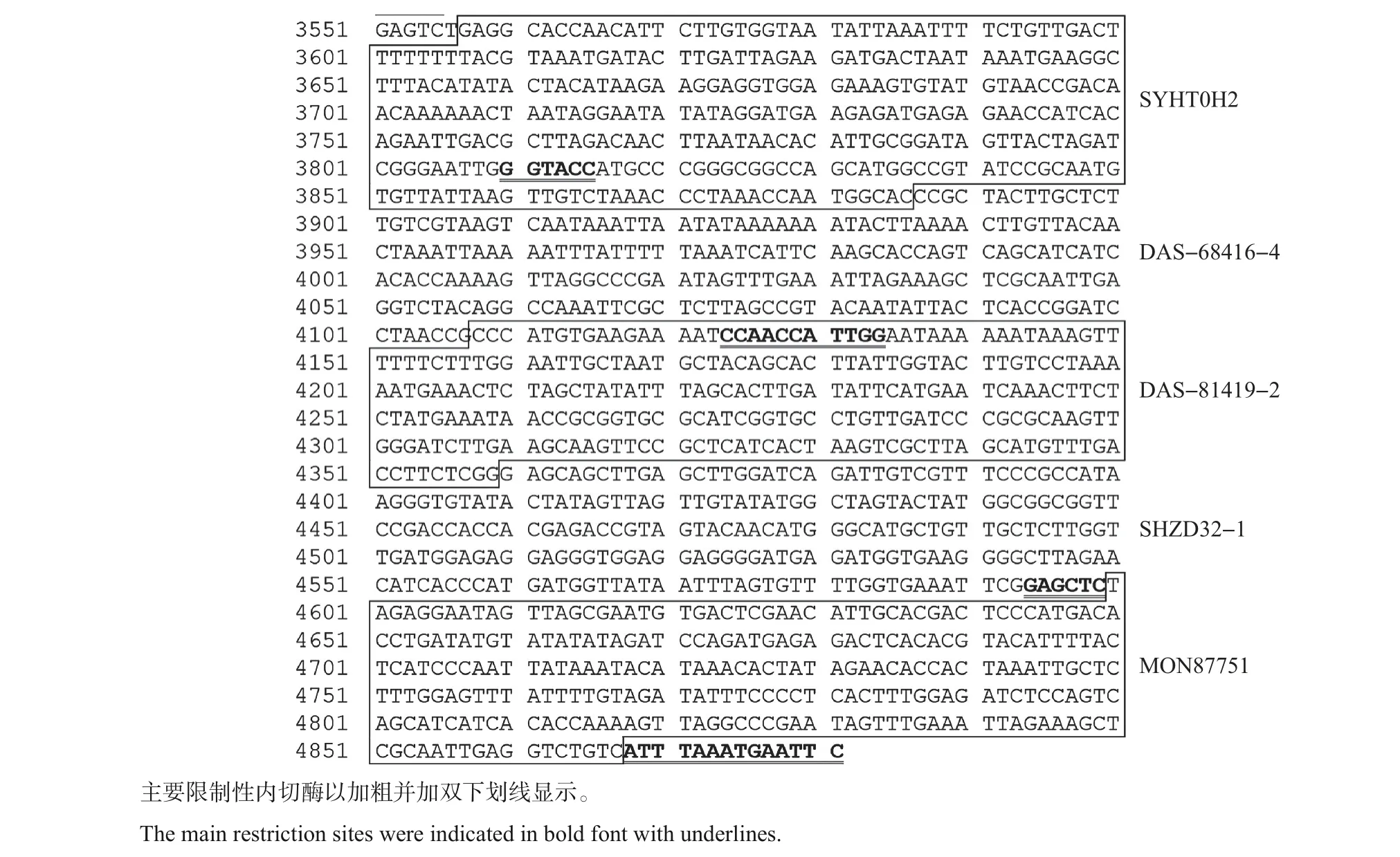
图1 pDDID-1905质粒中插入的序列Fig.1 Insertion sequence in pDDID-1905 plasmid
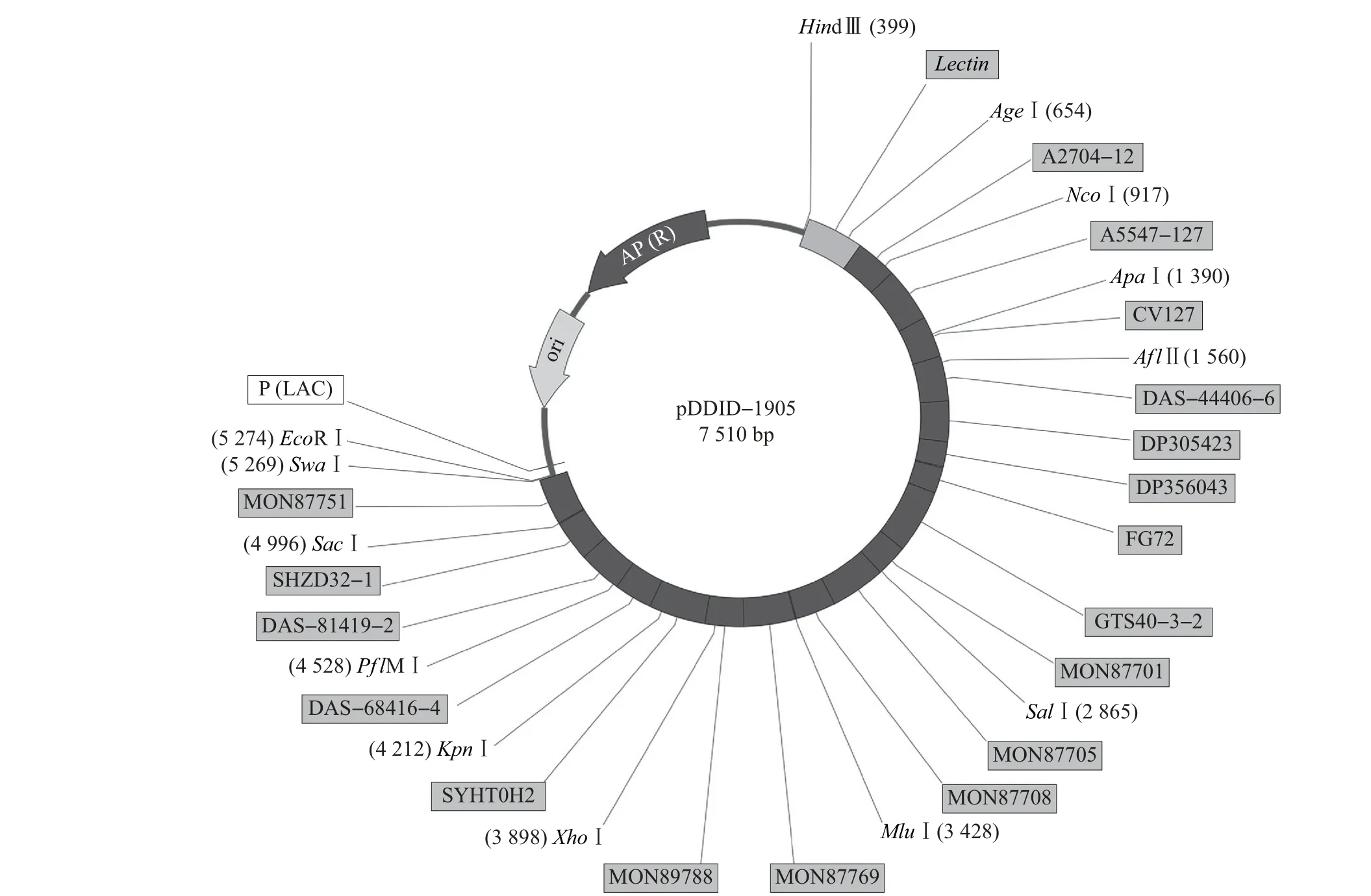
图2 pDDID-1905质粒构建示意图Fig.2 Diagram of pDDID-1905 plasmid construction

图3 pDDID-1905质粒的鉴定Fig.3 Identification of pDDID-1905 plasmid
3 讨论与结论
目前,各种转基因作物的研发正在如火如荼进行,已有转化体的推广范围和产品的进出口数量也与日俱增。因此,对转基因作物监督检测的任务量也随之增加,亟须从各个方面优化或简化检测工作流程。通常,在进行成分检测时,需要特定的阳性物质作为对照,用以对样品结果进行判别。常用阳性物质一般是相应转基因转化体的gDNA。gDNA最能反映转基因作物中遗传物质的改变,但是,其生产周期较长,流程烦琐,且一次检验工作往往需要准备多种转化体的gDNA,增加了工作量和成本。为了克服这些缺点,人们开发了含有靶标序列的质粒作为阳性物质,尤其是多靶标质粒[7-9,15]。目前,已报道了多种多靶标质粒开发成功的案例[5,13-15],但是,已有的含有转化体特征序列的多靶标质粒通常只能覆盖较少的转化体。类似PI等构建的pSOY已属于覆盖度较高的多靶标质粒,可用于对MON89788-5′、A2704-12-3′、A5547-127-3′、DP356043-5′、DP305423-3′、A2704-12-5′和A5547-127-5′等几种转化体及其衍生物进行筛查[5]。我国是转基因产品的进口大国,其中大豆产品的进口量最大;同时,大豆也是转基因技术应用最为广泛的作物之一。因此,对转基因大豆的监督检验工作显得尤为重要。结合我国国情,全面覆盖适合我国批准或研发的重要转基因大豆的多靶标质粒尚无报道。因此,本文以这些转基因大豆为靶标,构建了覆盖全面的多靶标质粒pDDID-1905。
pDDID-1905质粒包含14种已批准进口的大豆独立转化体(A2704-12、A5547-127、CV127、DAS-44406-6、DP305423、DP356043、FG72、GTS40-3-2、MON87701、MON87705、MON87708、MON87769、MON89788 和 SYHT0H2)和 2 种 杂 交 品 系(DP305423×GTS40-3-2 和MON87701×MON89788)、3种暂未批准进口但应用潜力较高的大豆独立转化体(DAS-68416-4、DAS-81419-2 和MON87751),以及1个我国自主研发的转化体SHZD32-1的特征序列。该质粒适用于对待测样品中是否存在这18种转基因大豆转化体及其衍生物的成分进行判别。该质粒自带大豆内标准基因Lectin的检测序列,可用于对待测样品中是否含有大豆成分进行判别。因此,该质粒具有较高的集成度,且其覆盖度符合我国国情,将极大地方便日常检测分析。另外,该质粒设计时不仅考虑到今后对特定转化体检测靶标序列的更新,还充分考虑了后期其他转基因大豆品种的不断研发和推广。因此,在外源插入序列中分布了多种限制性内切酶位点。该设计有利于后期对相应靶标序列的局部调整或加入新的转化体特征序列。
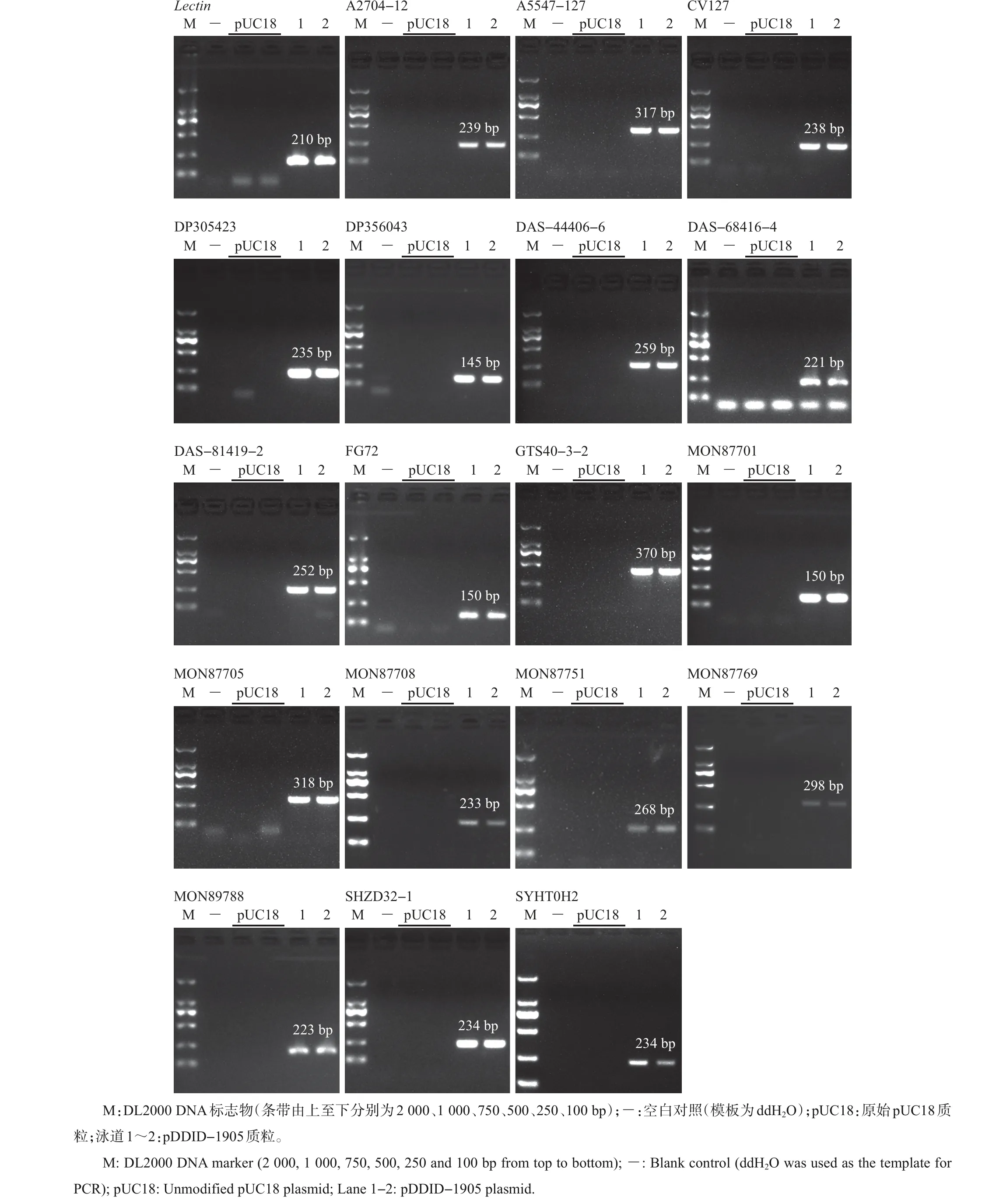
图4 pDDID-1905质粒所含特征序列的PCR扩增结果Fig.4 PCR products of specific sequences of pDDID-1905 plasmid

图5 转基因大豆混合样品的PCR扩增结果Fig.5 PCR products of the transgenic soybean mixtures
综上所述,本文根据转基因大豆研发和应用现状,结合我国国情,收集了18 种重要的转基因大豆转化体的分子特征信息,并将这些转化体的特征序列排序、拼接,构建了一种覆盖度更高且具备一定可修正性和扩展性的多靶标质粒pDDID-1905。初步验证表明,该质粒能够用作鉴定这些转化体的阳性分子,极大地便利了相关的检测和研究工作。
