厚壳贻贝中铬的形态特征及六价铬的转化规律
2020-07-24祝银朱剑李子孟王姮尤炬炬刘琴
祝银,朱剑*,李子孟,王姮,尤炬炬,刘琴
(1.浙江省海洋水产研究所,浙江 舟山316021;2.浙江省海洋渔业资源可持续利用技术研究重点实验室,浙江 舟山316021)
铬(chromium, Cr)是人体必需的微量元素,广泛分布于大气、水体和土壤中,但自然界中不存在游离态的Cr,主要以铬铁矿(FeCr2O4)的形式存在于地壳中。Cr 常见化合价为+2、+3、+6,其中,三价铬[Cr(Ⅲ)]和六价铬[Cr(Ⅵ)]最为常见[1-4]。Cr(Ⅲ)能协同胰岛素,参与生物体内糖类、脂质等的合成代谢,维持生物体内正常的葡萄糖水平,促进血红蛋白的合成,同时抑制脂肪酸和胆固醇的合成[5-9]。而Cr(Ⅵ)由于具有强氧化性和高渗透性,极易被人体吸收,经消化道、呼吸道、皮肤及黏膜侵入人体,有刺激、致癌、诱发基因突变的作用,对人体和环境有持久危害性,故有必要对生物和环境中的Cr形态进行分析,以正确评估其对人体和环境的安全风险水平。
厚壳贻贝(Mytilus coruscus)生长速度快,出肉率高,营养丰富,味道鲜美,且经济效益高,已成为浅海规模养殖的主要贝类之一[10]。由于厚壳贻贝具有吸收或经食物链传递富集重金属的特性,因此被认为是生态毒性研究的良好的无脊椎动物模型之一[11-13],但有关贻贝中Cr 形态的研究较少。鉴于厚壳贻贝庞大的市场需求和突出的富集能力,结合不同Cr 形态的生化特性,本研究以厚壳贻贝为对象,采用Cr(Ⅵ)标准物质为染毒试剂,通过监测厚壳贻贝体内Cr形态及含量变化,探究Cr(Ⅵ)在厚壳贻贝中的转化规律。
1 材料与方法
1.1 材料与试剂
实验生物:厚壳贻贝(取自浙江省舟山市普陀区东河菜场),平均壳长(9.94±0.60)cm,壳宽(4.51±0.30)cm,壳高(3.23±0.20)cm。实验前驯养2 周,挑选健康、规格一致的个体进行实验。
实验容器:选用尺寸为80 cm×50 cm×50 cm 的聚乙烯塑料桶,每次实验前将养殖桶彻底清洗干净,曝晒消毒。
养殖条件:实验用海水取自浙江省舟山市普陀区桃花岛附近海域,盐度22.5~24.0,pH 8.0~8.2,经沉淀、砂滤和充分曝气后用于实验。采用无火焰原子吸收分光光度法[14]测得养殖海水中总Cr 质量浓度为0.000 5 mg/L,采用二苯碳酰二肼分光光度法[14]测得养殖海水中Cr(Ⅵ)质量浓度小于0.004 mg/L,而采用高效液相色谱-串联电感耦合等离子体-质谱法(high performance liquid chromatographyinductively coupled plasma-mass spectrometry,HPLC-ICP-MS)[15]测得养殖海水中Cr(Ⅵ)质量浓度为0.000 4 mg/L。用以上方法测得的养殖海水中Cr 质量浓度均符合GB 3097—1997《海水水质标准》[16]中的一类标准。实验期间室温控制在20~24 ℃之间,水温控制在22.1~23.7 ℃之间,24 h 保持充气。实验中Cr(Ⅵ)质量浓度使用国家有色金属及电子材料分析测试中心生产的有效期内的标准溶液进行调节。
实验试剂:Cr、Cr(Ⅵ)、Cr(Ⅲ)单元素标准溶液质量浓度均为1 000 mg/L,购于国家有色金属及电子材料分析测试中心。硝酸(HNO3,优级纯,德国Sigma 公司);过氧化氢(H2O2,优级纯,国药集团化学试剂有限公司);氨水(NH3·H2O,优级纯,德国Sigma 公司);乙二胺四乙酸二钠盐(EDTA-2Na,分析纯,国药集团化学有限公司);C18-SPE固相萃取柱(3 mL/g,美国Waters 公司);实验用水为Milli-Q系统制备的超纯水。
1.2 仪器与设备
1260 Infinity Ⅱ高效液相色谱仪和7900电感耦合等离子体质谱仪(美国Agilent公司);微波消解仪(意大利Milestone公司);微控数显电热板及赶酸架(北京莱伯泰科仪器股份有限公司);电热恒温鼓风干燥箱(上海精宏实验设备公司)。
1.3 实验方法
1.3.1 暴露实验设计
向养殖桶内的实验海水中添加Cr(Ⅵ)标准储备液,配置成2个不同Cr(Ⅵ)质量浓度(0.05和0.50 mg/L)的海水溶液,配置时扣除海水重金属背景值。将厚壳贻贝随机分为3组,分别为空白对照组、低剂量富集组[0.05 mg/L Cr(Ⅵ)]和高剂量富集组[0.50 mg/L Cr(Ⅵ)],每组设3个平行实验,暴露持续7 d。每个养殖桶中放入30 只厚壳贻贝、20 L 天然海水。实验期间持续充氧,以保持水体中溶解氧含量充足和重金属分布均匀。为避免饵料和粪便对Cr(Ⅵ)含量的影响,实验期间不投喂。采用静态间歇换水方式,每24 h 100%更换清洁海水,并于换水前随机取样。每桶取水样50 mL和4只厚壳贻贝作为平行样,整贝匀浆,取匀浆后的样品,放入真空冷冻干燥机中干燥,磨碎后过40 目筛,冻藏于-20 ℃冰箱中,30 d内完成测定。每次换水时,重新按照设定的质量浓度系列配置实验溶液。
1.3.2 样品分析
1.3.2.1 总Cr测定
称取0.500 g(精确至0.001 g)样品,置于聚四氟乙烯消解罐中,依次加入5.0 mL 硝酸、2.0 mL 过氧化氢,加盖摇匀,放置过夜。次日,将消解罐放入微波消解外罐中,旋紧密封,然后放入微波消解仪中消解。消解结束后,关闭微波消解仪,待外罐冷却至室温时,开盖取出(将盖内侧液珠洗入消解罐中),置于赶酸架上,于180 ℃条件下加热赶酸至1.0 mL,冷却至室温后用超纯水稀释消化液,转移至50 mL 离心管中并定容至刻度,采用电感耦合等离子体-质谱法(inductively coupled plasma-mass spectrometry,ICP-MS)测定。
1.3.2.2 Cr形态测定
准确称取待测样品0.500 0 g(精确到0.000 1 g),置于50 mL 离心管中,加入40.0 mL 20 mmol/L EDTA-2Na溶液,3 000 r/min涡旋1 min;然后置于气浴恒温振荡器中,于60 ℃、180 r/min条件下振荡1 h。振荡完成后,冷却至室温,以4 ℃、7 000 r/min离心10 min;移取上清液5 mL,过已用5.0 mL 甲醇、5.0 mL超纯水活化后的C18 柱,弃去前1.0 mL 上样液,收集剩余上样液,取1.0 mL 用超纯水定容至5.0 mL,过0.22 μm滤膜后,用HPLC-ICP-MS分析。
2 结果与分析
2.1 暴露液中Cr(Ⅵ)含量变化及迁移量
暴露液在整个实验过程中均未检出Cr(Ⅲ),其Cr(Ⅵ)含量变化及迁移量如表1 所示。从中可知:低剂量组暴露液中Cr(Ⅵ)质量浓度最高为第7天时的48.57 μg/L,最低为第1 天时的34.19 μg/L;高剂量组暴露液中Cr(Ⅵ)质量浓度最高为第7 天时的488.23 μg/L,最低为第1 天时的387.28 μg/L。Cr(Ⅵ)质量浓度随暴露时间的延长而增加,但其质量浓度变化速率逐渐降低;Cr(Ⅵ)迁移量随暴露时间的延长而减小。这可能由以下2 方面的原因造成:一方面,随着取样次数的增加,厚壳贻贝数量变少,导致暴露液中Cr(Ⅵ)迁移量和Cr(Ⅵ)质量浓度变化速率降低;另一方面,随着暴露时间的延长,厚壳贻贝体内Cr(Ⅵ)富集水平逐渐趋于平衡状态,贝体蓄积能力的减弱使暴露液中Cr(Ⅵ)迁移量降低。
在暴露期间,低剂量组Cr(Ⅵ)总量约为7 000 μg,总迁移量为1 006.6 μg,迁移率为14.4%;高剂量组Cr(Ⅵ)总量约为7.0×104μg,总迁移量为6 085.0 μg,迁移率为8.7%。根据采样时间节点和贻贝剩余数量,结合暴露液中Cr(Ⅵ)迁移量,得到单个厚壳贻贝在不同时间点的Cr(Ⅵ)迁移累积量(图1)。从中可以看出:单个厚壳贻贝Cr(Ⅵ)迁移累积量呈现先快后缓的增长趋势,低剂量组从第1 天的10.027 μg,增加到第7天的47.286 μg;高剂量组从第1天的69.627 μg,增加到第7天的288.218 μg。

表1 暴露液中Cr(Ⅵ)含量变化及迁移量Table 1 Contents and migration amounts of Cr(Ⅵ) in exposure solution

图1 单个厚壳贻贝Cr(Ⅵ)迁移累积量Fig.1 Total amounts of Cr(Ⅵ)migration in single M.coruscus
2.2 厚壳贻贝Cr 含量变化
暴露期间,厚壳贻贝均正常生长,无死亡。空白对照组的厚壳贻贝总Cr 与Cr(Ⅲ)质量分数分别为(0.53±0.04)和(0.065±0.005)mg/kg。实验分析所用的数据均扣除空白对照组,其中Cr(Ⅵ)未检出。
2.2.1 厚壳贻贝总Cr 含量变化
厚壳贻贝在整个暴露实验中总Cr 含量变化如图2所示。在2种不同Cr(Ⅵ)剂量水平下,厚壳贻贝体内总Cr含量均随着积累时间的延长而不断增加。低剂量组总Cr质量分数从0.530 mg/kg上升至1.766 mg/kg,平均增速为0.176 mg/(kg·d-1);高剂量组总Cr质量分数从0.530 mg/kg上升至8.556 mg/kg,平均增速为1.146 mg/(kg·d-1)。总体来看,总Cr含量呈现阶段性变化:第1—3天为主要富集阶段,低、高剂量组在此阶段分别完成了整个暴露实验富集量的74.8%和78.6%;第4—7 天总Cr 含量变化速率已低于平均增速,且趋于平稳,说明可能将达到富集平衡状态。至富集实验结束,低剂量组总Cr含量未超过安全限量值2.0 mg/kg;高剂量组总Cr含量在第1天就超过了安全限量值,表明水体中0.5 mg/L Cr(Ⅵ)的添加量足以使厚壳贻贝受到污染而不宜食用。

图2 厚壳贻贝体内总Cr含量变化Fig.2 Change of total Cr content in M.coruscus
2.2.2 厚壳贻贝Cr(Ⅲ)含量变化
厚壳贻贝体内Cr(Ⅲ)含量随时间变化曲线见图3。Cr(Ⅲ)含量随着暴露时间的延长而增加,高、低剂量组分别从0.065 mg/kg上升至2.431 mg/kg和0.408 mg/kg,平均增速分别为0.338 mg/(kg·d-1)和0.049 mg/(kg·d-1)。低剂量组前4 d 的富集量占总富集量的74.6%,后3 d 占25.4%;高剂量组前4 d的富集量占总富集量的82.2%,后3 d 富集甚微。表明厚壳贻贝中Cr(Ⅲ)富集的主要阶段在第1—4 天。

图3 厚壳贻贝体内Cr(Ⅲ)含量变化Fig.3 Change of Cr(Ⅲ)content in M.coruscus
2.2.3 厚壳贻贝有机Cr 含量变化
在暴露实验中,暴露液中均检出Cr(Ⅵ),但Cr(Ⅲ)未检出;在厚壳贻贝中均未检出Cr(Ⅵ),而Cr(Ⅲ)和总Cr都有检出,且数值相差较大。表明暴露液中Cr(Ⅵ)转化为其他形态而存在于厚壳贻贝体内。总Cr 包括无机Cr 和有机Cr。其中,无机Cr分为Cr(Ⅱ)、Cr(Ⅲ)、Cr(Ⅳ)、Cr(Ⅴ)和Cr(Ⅵ)。而Cr(Ⅱ)是一种强还原剂,极易被氧化成Cr(Ⅲ);Cr(Ⅳ)和Cr(Ⅴ)只是Cr(Ⅲ)与Cr(Ⅵ)转化过程中的中间价态;Cr(Ⅲ)是最稳定的氧化态,也是生物体内Cr 的主要存在形态。综上可得,总Cr 为有机Cr、Cr(Ⅲ)与Cr(Ⅵ)的总和;考虑到厚壳贻贝体内未检出Cr(Ⅵ),因此,本研究测定的总Cr为有机Cr与Cr(Ⅲ)的总和。通过差减法得到本研究有机Cr的含量(图4)。可以看出:有机Cr 含量随着暴露时间的延长而增加,低剂量组前3 d 的富集量占到总富集量的80.3%;高剂量组前3 d的富集量占到总富集量的83.4%。表明厚壳贻贝中有机Cr 富集的主要阶段在第1—3天。
2.3 Cr 在厚壳贻贝中的形态特征
由暴露液和厚壳贻贝中Cr 含量的变化可知,Cr(Ⅵ)在厚壳贻贝体内完全被还原或络合,以Cr(Ⅲ)和有机Cr 的形态存在。厚壳贻贝在整个实验过程中Cr 形态变化及转化率见表2。暴露液中Cr(Ⅵ)迁移途径包括环境吸附(养殖箱、厚壳贻贝的表壳)和厚壳贻贝体内蓄积。因此,暴露液中Cr(Ⅵ)迁移量大于厚壳贻贝体内Cr(Ⅵ)迁移累积量,导致计算得到的转化率均在70%以下。
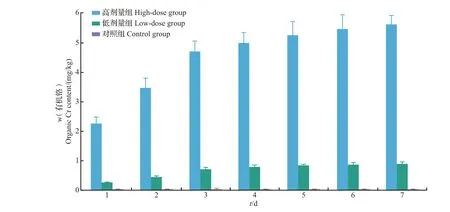
图4 厚壳贻贝体内有机Cr含量变化Fig.4 Change of organic Cr content in M.coruscus
由表2可知,随着暴露量的增加,Cr转化率都得到了提升,总Cr提升了2.6%~9.2%,Cr(Ⅲ)提升了0.9%~3.3%,有机Cr 提升了0.9%~8.3%。整体来看,Cr 形态转化率随时间的延长而降低:低剂量组总Cr 从开始的52.6%降到39.2%,降幅13.4%;高剂量组总Cr 从61.8%降到41.8%,降幅20.0%;低剂量组Cr(Ⅲ)从12.1%降到10.4%,降幅1.7%;高剂量组Cr(Ⅲ)从14.2%降到12.5%,降幅1.7%;低剂量组有机Cr 从开始的40.5%降到28.4%,降幅12.1%;高剂量组有机Cr 从48.8%降到29.3%,降幅19.5%。总之,总Cr转化率降低较快,而Cr(Ⅲ)较慢,随着时间的推移,Cr(Ⅲ)占总Cr的比例越来越高(图5),有机Cr比例逐渐降低。上述结果表明,除暴露液迁移的Cr(Ⅵ)还原成Cr(Ⅲ)外,厚壳贻贝体内部分有机Cr也能转化为Cr(Ⅲ)。
综上得到:Cr(Ⅵ)无法稳定存在于厚壳贻贝体内;Cr 在厚壳贻贝体内主要以Cr(Ⅲ)和有机Cr 形态存在,其中Cr(Ⅲ)占21.0%~29.9%,有机Cr 占70.1%~79.0%;随着时间的推移,部分有机Cr 转化为Cr(Ⅲ),且Cr(Ⅲ)比例不断升高。
2.4 Cr(Ⅵ)在厚壳贻贝中的转化规律
相关学者研究发现:Cr(Ⅵ)进入厚壳贻贝体内,易被金属硫蛋白的巯基基团螯合,导致Cr(Ⅵ)含量降低[7,17];另外,Cr(Ⅵ)可通过非特异性离子通道进入细胞内部,与细胞中的蛋白质和核酸发生反应,被还原成Cr(Ⅲ);而Cr(Ⅲ)能形成多齿配位化合物,不易穿过细胞膜,且反应活性很低,是Cr在生物体内的主要存在形式[18-19]。JOBBY 等[7]提出,在高等植物、藻类等生物体中存在的特定分子如金属硫蛋白、植物螯合素、羟基和硫酸根等作为官能团与Cr(Ⅵ)形成化学键,使得Cr(Ⅵ)被螯合或被还原成Cr(Ⅲ);REVATHI 等[20]利用高粱研究Cr 在其中的转化,与JOBBY 等[7]的研究结果类似。SEMENIUK等[21]利用放射性同位素51Cr研究了浮游植物中短期Cr(Ⅲ)与Cr(Ⅵ)的积累,结果表明,Cr(Ⅲ)是浮游植物细胞内最主要的存在形态。以上学者的相关结论均证明Cr(Ⅵ)不能稳定存在于生物体内,而是通常被还原成Cr(Ⅲ)或以有机络合物的形式存在生物体内,本研究结果与其一致。

表2 厚壳贻贝的Cr形态变化及转化率Table 2 Morphological change and conversion rate of Cr in M.coruscus %

图5 厚壳贻贝中Cr(Ⅲ)在总Cr中的占比Fig.5 Ratio of Cr(Ⅲ)to total Cr in M.coruscus
根据上述结果,结合Cr 形态特征和转化率,可得到Cr(Ⅵ)在厚壳贻贝体内的转化规律:实验初期,暴露液中Cr(Ⅵ)迁移量大,厚壳贻贝富集转化能力强,其体内Cr(Ⅵ)蓄积量迅速增加,但都被还原成Cr(Ⅲ)和有机Cr,使得厚壳贻贝体内的总Cr、Cr(Ⅲ)和有机Cr 含量均显著提升,其中有机Cr 为主要存在形态,约占总Cr 的77%。实验中期,随着厚壳贻贝铬Cr含量的增加及其富集能力的减弱,总Cr、Cr(Ⅲ)和有机Cr 的转化率逐渐降低,其含量增速也逐渐放缓。实验末期,厚壳贻贝趋于富集平衡状态,导致其Cr(Ⅵ)蓄积量降低,Cr 含量增长接近停滞,总Cr、Cr(Ⅲ)和有机Cr的转化率大幅下降,且有机Cr 部分转化为Cr(Ⅲ),使Cr(Ⅲ)占比提升至29.9%。
3 结论
本研究以厚壳贻贝为研究对象,采用Cr(Ⅵ)标准物质为染毒试剂,通过比较同一形态Cr的含量变化,监测不同时间节点Cr的形态变化,确认了Cr在厚壳贻贝中的形态特征,并探讨了Cr(Ⅵ)在厚壳贻贝中的转化规律。结果发现:Cr在厚壳贻贝体内主要以Cr(Ⅲ)和有机Cr 形态存在,其中Cr(Ⅲ)占21.0%~29.9%,有机Cr 占70.1%~79.0%;随着时间的推移,有机Cr部分转化为Cr(Ⅲ),使Cr(Ⅲ)比例不断升高;Cr(Ⅵ)无法稳定存在于厚壳贻贝体内。
