EVI1基因对胃癌细胞生长及侵袭的机制研究
2020-07-24柳子川
柳子川
(广州医科大附属肿瘤医院肿瘤内二科 广东 广州 510095)
胃癌是常见的消化道恶性肿瘤之一。胃癌的发病隐匿,初始临床症状不显著。很多患者确诊的时候已经是疾病的中、晚期,失去了治疗的最佳机会。因此,发掘可能导致胃癌发生及进展的分子标记物具有重要的意义。
胃癌的发病原因比较多,比如有饮食习惯,环境因素,幽门螺杆菌感染及癌基因的异常激活等因素。其中,癌基因的异常激活是导致胃癌发生及进展一个很重要的原因。这些癌基因的异常激活通常可以导致胃粘膜上皮细胞发生变异,出现异常的增殖,进而出现癌变[1]。检测异常表达的癌基因可以较早期检测出胃癌的病变,对胃癌的防治具有重要的临床意义。
1.材料及实验方法
1.1 实验材料
PRMI-1640培养基,胎牛血清,0.25%胰酶消化液购买自hyclone公司。MTT(3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐),溴酚蓝,多聚甲醛购买自sigma公司。Lipofectamine® RNAiMAX购自invitrogen公司。小分子干扰RNA片段购自广州锐博公司。transwell小室购自corning公司。EVI1,cyclind1,MMP9和GAPDH内参一抗购自santa cruz公司。鼠抗人二抗购自中杉金桥公司。超敏ECL化学发光试剂盒购自碧云天公司。
1.2 细胞培养
胃癌细胞SGC-7901培养在含10%胎牛血清的PRMI-1640培养基之中。细胞在含5% CO2,37℃的细胞培养箱中培养。
1.3 细胞转染
将4×105个处于对数生长期的SGC-7901细胞均匀铺在6孔板中。24小时细胞贴壁后,将Lipofectamine® RNAiMAX和小分子干扰RNA均匀混合,在室温下面放置20分钟。之后将上述混合物加入6孔板中转染SGC-7901细胞。EVI1干扰RNA转染的细胞称为si- EVI1,和阴性对照转染的细胞称为si-ctrl。
1.4 MTT(3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐)实验
将细胞铺于96孔板,每个孔细胞密度为6×103/孔,分别于第1d、2d、3d、4d、5d和6d不同时间点,每个孔中加入20 μl初始浓度为5mg/ml的MTT溶液。之后在正常细胞培养环境中再孵育4个小时,弃掉培养液以及MTT。每个孔加入150μl 二甲基亚砜(DMSO)终止反应。细胞活力的测定:采用酶标仪在490nm 处读取每孔的吸光度值,最后制作细胞增殖曲线。
1.5 平板克隆实验
将细胞铺于6孔板中,每4天换培养液1次。共培养2周之后,弃掉培养液。然后使用PBS冲洗干净细胞,使用4%多聚甲醛固定细胞,苏木素染色,显微镜下观察细胞形成集落的大小。
1.6 细胞周期实验
选取处于对数生长期的细胞,用预冷的PBS洗涤细胞。然后把细胞用PBS 溶液重悬,加入70%乙醇溶 液在4℃固定过夜。用PI对细胞进行染色,然后使用流式细胞仪对细胞周期进行分析。
1.7 RT-PCR实验
使用Trizol提取细胞或者组织中的RNA,然后使用HiScript Ⅱ Q-RT SuperMix试剂盒对RNA进行逆转录。
1.8.Transwell实验
把细胞使用无血清培养基悬浮,铺于transwell小室里面。将transwell小室放在12孔板上方,12孔板里面添加含10%胎牛血清的培养基作为诱导剂。36个小时之后,取出transwell小室,将未迁徙的细胞用棉签搽掉。使用4%多聚甲醛固定细胞,苏木素染色。显微镜下面观察细胞数目。
2.结果
2.1 EVI1影响胃癌细胞的生长能力
我们首先使用小分子干扰RNA(si-RNA)敲除胃癌细胞SGC-7901中EVI1基因的表达(图1A)。我们把细胞分为对照组(si-ctrl)和实验组(si-EVI1)。MTT实验发现:与对照组相比,实验组细胞生长的速度明显减慢(图1B)。平板克隆实验发现:实验组的细胞形成克隆的能力较对照组显著减弱(图1C)。我们检测了细胞周期的变化情况。流式细胞仪发现:敲除EVI1基因之后,可以使细胞周期阻滞在G1期(图1D)。使用western blot检测调控细胞周期的因子,发现敲除EVI1基因之后,cyclinD1和E2F1表达水平下降(图1E)。
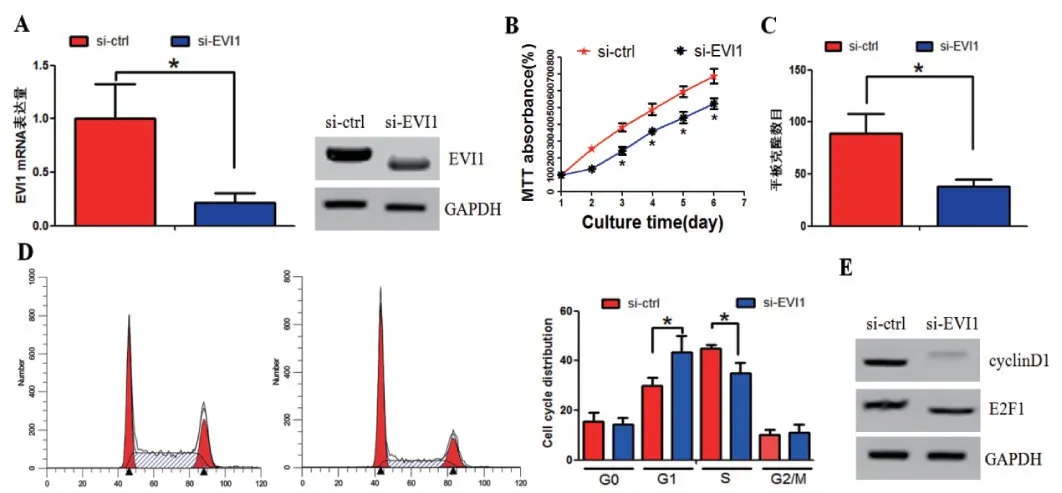
图1 (A)左图:RT-PCR验证实验组、对照组EVI1的分别表达量,右图:western blot验证实验组、对照组EVI1的分别表达量。(B)MTT实验检测实验组、对照组细胞生长速率。(C)平板克隆实验检测实验组、对照组细胞形成克隆的能力。(D)流式细胞仪检测实验组、对照组细胞周期分别的差异。(E)western blot验证实验组、对照组cyclinD1和E2F1的分别表达量。
2.2 EVI1可促进胃癌细胞的侵袭能力
研究EVI1基因对胃癌细胞侵袭能力的影响。进行transwell实验,验证细胞的侵袭能力。结果发现:与对照组相比,实验组细胞侵袭能力下降(图2A)。检测影响胃癌细胞侵袭的金属基质蛋白酶(matrix metalloproteinases,MMPs)的表达。结果发现:敲除EVI1基因之后,MMP3和MMP9表达水平下降(图2B)。
2.3 EVI1可激活胃癌细胞中PI3K/AKT信号通路
探索EVI1基因对胃癌细胞影响的可能机制。由于PI3K/AKT信号通路可以促进胃癌细胞的增殖及侵袭能力,研究EVI1是否可以通过激活PI3K/AKT信号通路,从而发挥相关生物学作用。
我们使用western blot实验,检测PI3K/AKT信号通路相关蛋白质在实验组和对照组之间的表达差异。结果发现:和对照组相比,实验组细胞中磷酸化PI3K及磷酸化AKT表达水平都下调(图2C)。这结果提示:EVI1可能激活PI3K/AKT信号通路。
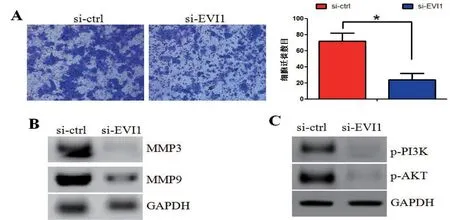
图2 (A)transwell实验验证实验组、对照组细胞迁徙数目。(B)western blot验证实验组、对照组MMP3和MMP9的分别表达量。(C)western blot验证实验组、对照组磷酸化PI3K(p-PI3K)及磷酸化AKT(p-AKT)的分别表达量。
2.4 EVI1在胃癌组织中表达上升
最后,探讨EVI1蛋白在肿瘤组织,尤其胃癌组织中的表达情况。使用TCGA(The Cancer Genome Atlas)在线分析数据库(http://tumorsurvival.org/)来分析EVI1蛋白在肿瘤组织中的表达情况。发现:EVI1蛋白在一系列肿瘤组织中表达都上升,尤其是在胃癌组织中(图3)。
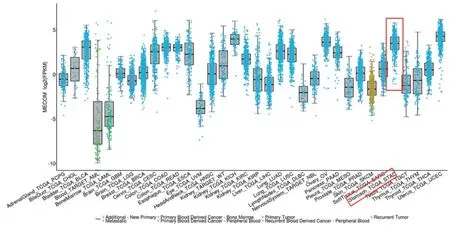
图3 TCGA数据库中EVI1蛋白在一系列恶性肿瘤中的表达水平(红色圈部分代表胃癌组织)。
3.讨论
胃癌是一种高度恶性的消化道肿瘤,患者具有生存时间较短,容易复发及远处转移的特点。同时,胃癌发病隐匿性较高,很多患者确诊的时候已经是疾病的晚期状态[2]。因此,阐明胃癌发病的分子机制,寻找新的可以预测胃癌发病的相关分子,并开发新的治疗靶点,在临床治疗中具有重要的意义。
研究拟探讨EVI1基因在胃癌中的作用及具体的分子机制。EVI1是一个重要的癌基因,在包括急性白血病,卵巢癌,结肠癌,肺癌,鼻咽癌等多种恶性肿瘤中高度表达[3]。EVI1高度表达的肿瘤患者其预后不良,这类患者其无疾病生存时间及总生存时间通常短于低表达的患者[4]。这提示EVI1有可能作为恶性肿瘤一个预后监测的指标,并有可能作为一个新的治疗靶点。EVI1的生物学作用在胃癌中的研究相对比较少,本研究拟初步探讨其在胃癌细胞中的功能。
在既往的研究当中,发现EVI1可通过多种途径促进肿瘤的发生以及进展。例如在乳腺癌当中,EVI1可以促进细胞的增殖,调控细胞周期,从而导致细胞的生长[5]。在卵巢癌细胞中,EVI1可以促进细胞的侵袭,从而导致了肿瘤的远处转移。EVI1还可以赋予肿瘤细胞对凋亡的抵抗,从而促进了肿瘤细胞的生长,以及对化疗的抵抗[6]。在白血病细胞当中,EVI1还可以直接结合在其下游基因的启动子水平,发挥广泛的基因调控作用,从而促进白血病的发生进展[7]。EVI1还可以和microRNA(miRNA)相互结合,从而间接调控miRNA下游的靶基因,发挥一系列广泛的生物学功能[8]。从这些研究结果,可以看出EVI1是具有很广泛的调控肿瘤的作用。
在我们的研究当中,首先在胃癌细胞中敲除EVI1的表达,然后开始研究相关的生物学功能。MTT和平板克隆结果提示,在敲除EVI1之后,胃癌细胞的生长能力下降。肿瘤细胞的生长受到多个因子及因素的调控。还进一步发现,EVI1可以促进肿瘤细胞由G1期进入S期。对调控细胞周期的相关蛋白进行验证后,我们还发现EVI1可以上调cyclinD1和E2F1的表达。这结果和之前的研究结果相一致[9,10]。还用transwell实验验证EVI1对胃癌细胞的影响。结果发现:敲除EVI1之后,胃癌细胞侵袭的能力下降。金属基质蛋白酶过度表达可以促进肿瘤细胞的侵袭以及远处转移,包括胃癌细胞[11]。结果发现EVI1可以上调胃癌细胞金属基质蛋白酶中的MMP-3和MMP-9表达水平。这提示EVI1有可能是通过调控金属基质蛋白酶,从而促进胃癌细胞的侵袭能力。综上所述,这些研究结果进一步证明了EVI1对肿瘤细胞生长和侵袭能力的影响。
最后,我们还探讨了EVI1可能促进胃癌细胞生长及侵袭的分子机制。在之前的研究当中,发现EVI1可以直接抑制PTEN,从而激活PI3K/AKT信号通路[12]。EVI1还可以激活ERK/mTor通路,从而促进肿瘤细胞的侵袭及化疗抵抗[13]。PI3K/AKT信号通路通常在肿瘤细胞中是异常激活的。在胃癌细胞中,PI3K/AKT信号通路可以促进细胞的增殖以及侵袭[14]。我们探讨了EVI1对PI3K/AKT信号通路活性的影响。我们发现:敲除EVI1之后,PI3K/AKT信号通路活性下降。由此可见,EVI1是通过PI3K/AKT信号通路促进了胃癌细胞的增殖及侵袭能力。
综上所述,EVI1可以促进胃癌细胞的生长、侵袭能力。其中的机制可能是EVI1激活了PI3K/AKT信号通路。EVI1可做为胃癌治疗的一个新靶点。
