金银花多糖的指纹图谱及体外抗病毒活性研究
2020-07-23丁洁闫光玲杨培张永清刘玉红
丁洁 闫光玲 杨培 张永清 刘玉红

中图分类号 R284.2 文献标志码 A 文章编号 1001-0408(2020)09-1061-07
DOI 10.6039/j.issn.1001-0408.2020.09.08
摘 要 目的:建立金銀花多糖的指纹图谱,并考察其对呼吸道合胞病毒(RSV)的体外抑制作用。方法:通过水提、二次醇沉制备金银花多糖;所得多糖经三氟乙酸水解和盐酸羟胺、吡啶等衍生化后,采用气相色谱法(GC)建立指纹图谱。色谱柱为HP-5毛细管色谱柱,检测器为火焰离子化检测器,进样口温度为250 ℃,检测器温度为300 ℃,程序升温,载气为氮气(流速50 mL/min),分流进样(分流比60 ∶ 1),进样量为2.0 μL。以鼠李糖为参照,绘制12批金银花药材样品(S1~S12)的GC指纹图谱,采用《中药色谱指纹图谱相似度评价系统(2012版)》进行相似度评价并确定共有峰;采用SPSS 21.0软件进行聚类分析和主成分分析。以利巴韦林为阳性对照,以半数有效浓度(EC50)、治疗指数(TI)为指标,采用MTT法考察金银花多糖对RSV的体外抑制作用。结果:12批金银花药材样品的GC指纹图谱有12个共有峰,相似度≥0.994;共指认鼠李糖、阿拉伯糖、岩藻糖、甘露糖、葡萄糖、半乳糖、肌醇六乙酸酯等7个共有峰。12批药材样品共聚为两类,即S1、S7、S10、S11聚为一类,其余聚为一类;主成分分析中,3个主成分的特征值均大于1(分别为5.659、2.745、1.724),其累积贡献率为84.400%。样品综合得分以S12最高,S5次之,S11最低。金银花(S12)总多糖、80%醇沉多糖、50%醇沉多糖、20%醇沉多糖的EC50值分别为0.76、0.61、1.03、3.04 g/L,TI值分别为15.36、18.51、11.69、4.22;其中,80%醇沉多糖的EC50值最低,TI值与阳性对照(20.08)接近。结论:所建指纹图谱可为金银花药材的质量评价提供参考。金银花多糖对RSV具有一定的体外抑制活性,且以80%醇沉多糖活性最强。
关键词 金银花多糖;指纹图谱;气相色谱;主成分分析;抗病毒活性
Study on Fingerprint and in vitro Antiviral Activity of Lonicera japonica Polysaccharide
DING Jie1,YAN Guangling1,YANG Pei1,ZHANG Yongqing1,2,LIU Yuhong1,2(1. School of Pharmacy, Shandong University of Traditional Chinese Medicine, Jinan 250355, China; 2. Fine Breeding Engineering Center of Chinese Medicinal Materials of Shandong Province, Jinan 250355, China)
ABSTRACT OBJECTIVE: To establish the fingerprint of Lonicera japonica polysaccharide, and to investigate in vitro inhibitory effect of it on respiratory syndrome virus (RSV). METHODS: Polysaccharide from L. japonica was prepared by water extraction and twice alcohol precipitation method. After hydrolysis with trifluoroacetic acid, derivatization with hydroxylamine hydrochloride and pyridine, the fingerprint was established by GC method. The determination was performed on HP-5 capillary column, and the detector was flame ionization detector; the temperature of the sample inlet was 250 ℃; the temperature of the detector was 300 ℃ (programmed temperature); the carrier gas was nitrogen (flow rate of 50 mL/min); split sampling was adopted (split ratio of 60 ∶ 1); the sample size was 2.0 μL. Using rhamnose as reference substance, GC fingerprint of 12 batches of L. japonica (S1-S12) was drawn, and the similarity evaluation was performed with Similarity Evaluation System of TCM Fingerprint (2012 edition). Cluster analysis and principal component analysis were conducted by using SPSS 21.0 software. Using ribavirin as positive control, half effective concentration (EC50) and treatment index (TI) as indexes, MTT assay was used to investigate in vitro inhibitory effect of L. japonica polysaccharide on RSV. RESULTS: There were 12 common peaks in GC fingerprint of 12 batches of L. japonica. The similarity was greater than or equal to 0.994. Seven common peaks were identified, such as rhamnose, arabinose, fucose, mannose, glucose, galactose, inositol hexaacetate. According to the cluster analysis, 12 batches of samples could be divided into two categories, i.e. S1, S7, S10 and S11 clustered into one category, and others clustered into one category. In principal component analysis, the eigen values of 3 principal components were all greater than 1 (5.659, 2.745, 1.724 respectively), and their cumulative contribution rate was 84.400%. The comprehensive score of S12 was the highest, the second was S5, and the lowest was S11. EC50 of total polysaccharide, 80% alcohol precipitated polysaccharide, 50% alcohol precipitated polysaccharide and 20% alcohol precipitated polysaccharide of L. japonica (No. S12) were 0.76, 0.61, 1.03, 3.04 g/L, respectively; TI were 15.36, 18.51, 11.69, 4.22, respectively. EC50 of 80% ethanol alcohol precipitated polysaccharide was the lowest, and its TI was close to that of positive control (20.08). CONCLUSIONS: Established fingerprint provides reference for the quality evaluation of L. japonica. L. japonica polysaccharide has a certain inhibitory activity on RSV in vitro, and the 80% alcohol precipitated polysaccharide has the strongest activity.
KEYWORDS Lonicera japonica polysaccharide; Fingerprint; Gas chromatography; Principal component analysis; Antivirus activity
金銀花为忍冬科植物忍冬(Lonicera japonica Thunb.)的干燥花蕾或带初开的花,始载于《名医别录》,为上品,临床上广泛用于治疗多种上呼吸道病毒感染,疗效显著[1-3]。金银花多糖是该药材发挥降血糖、降血脂、调节免疫、抗肿瘤、抗病毒等功效的重要活性成分之一[4-7]。然而,现有金银花的质量评价主要集中在绿原酸、木犀草苷等小分子成分的含量控制上[1,8],而对于多糖等重要有效成分的含量却未作规定,使得金银花药材的质量标准不够完善。指纹图谱是目前应用广泛的质量评价方法之一,具有整体性、特征性、关联性等特点,适用于中药复杂体系的质量研究[9]。笔者通过检索文献发现,虽已有金银花指纹图谱的相关研究报道,但仍以小分子成分作为指标,缺乏以金银花多糖等大分子有效成分为指标的指纹图谱研究。为此,本研究采用气相色谱法(GC)建立金银花多糖指纹图谱,并进行聚类分析和主成分分析,旨在为金银花药材的质量控制提供依据。此外,本课题组前期研究发现,金银花多糖具有抗H1N1流感病毒的作用,主要机制包括调节免疫、促进免疫以及抑制炎症反应等[7]。基于此,本研究初步考察了金银花多糖对呼吸道合胞病毒(RSV)的体外抑制活性,旨在为金银花临床药效物质基础的进一步阐释提供参考。
1 材料
1.1 仪器
6980型GC仪(美国Agilent公司);Model 680型酶标仪(美国Bio-Rad公司);3111型CO2细胞培养箱(美国Thermo Fisher Scientific公司);BT25S型十万分之一电子天平(德国Sartorius公司);5427R型高速低温离心机(德国Eppendorf公司);YRE-201D型旋转蒸发仪(巩义市予华仪器责任有限公司)。
1.2 药材与试剂
金银花药材购自于山东省漱玉平民大药房、同仁堂等药房,经山东中医药大学药学院李佳教授鉴定为真品。样品信息见表1。
鼠李糖对照品(批号:C10110722,纯度:≥99%)、阿拉伯糖对照品(批号:C10127747,纯度:≥99%)、岩藻糖对照品(批号:C10111725,纯度:≥99%)、甘露糖对照品(批号:C10122746,纯度:≥99%)、葡萄糖对照品(批号:C10110127,纯度:≥99%)、半乳糖对照品(批号:C10126514,纯度:≥99%)均购自上海麦克林生化科技公司;肌醇六乙酸酯对照品(单糖组成检测用内标,本实验室自制[10],纯度:>97%);利巴韦林原料药(大连美仑生物技术有限公司,批号:J1202A,纯度:>99%);RPMI 1640细胞培养基、胰酶(美国Gibco公司,批号分别为1662222、25300055);胎牛血清(美国Hyclone公司,批号:nxa0544);MTT试剂(美国Ameresco公司,批号:1046935);其余试剂均为分析纯,水为蒸馏水。
1.3 病毒
RSV标准病毒株由山东省立医院提供。
1.4 细胞
非洲绿猴肾细胞Vero由山东省医学科学院基础医学研究所提供。
2 方法与结果
2.1 金银花多糖样品制备
称取金银花药材50.0 g,加入15倍量(mL/g,下同)水,在85 ℃下回流提取2 h,重复2次。合并提取液,浓缩至一定体积,以3 500 r/min离心6 min,取上清液,加4倍量无水乙醇,静置过夜;收集沉淀,加适量水复溶,再用4倍量无水乙醇重复醇沉1次,收集沉淀。将上述沉淀于60 ℃真空干燥,即得金银花多糖样品(每100 g药材得金银花多糖样品5 g)。
2.2 溶液的制备
2.2.1 多糖完全酸水解样品 精密称取按“2.1”项下方法制备的S1~S12金银花多糖样品各10.00 mg,置于具塞试管中,加2 mol/L三氟乙酸溶液6 mL,加塞封口,于110 ℃水解5 h后,于60 ℃下减压浓缩至干;残渣加少量甲醇复溶,蒸干,重复5次操作,即得金银花多糖完全酸水解样品,备用。
2.2.2 多糖衍生化样品溶液 将“2.2.1”项下多糖完全酸水解样品真空干燥12 h后,加盐酸羟胺10 mg、吡啶0.6 mL、肌醇六乙酸酯1 mg,于90 ℃搅拌反应30 min;冷却,加醋酸酐1.6 mL,于90 ℃继续反应30 min。反应液经0.45 μm微孔滤膜滤过后,用氯仿定容至5 mL,即得金银花多糖衍生化样品溶液,备用。
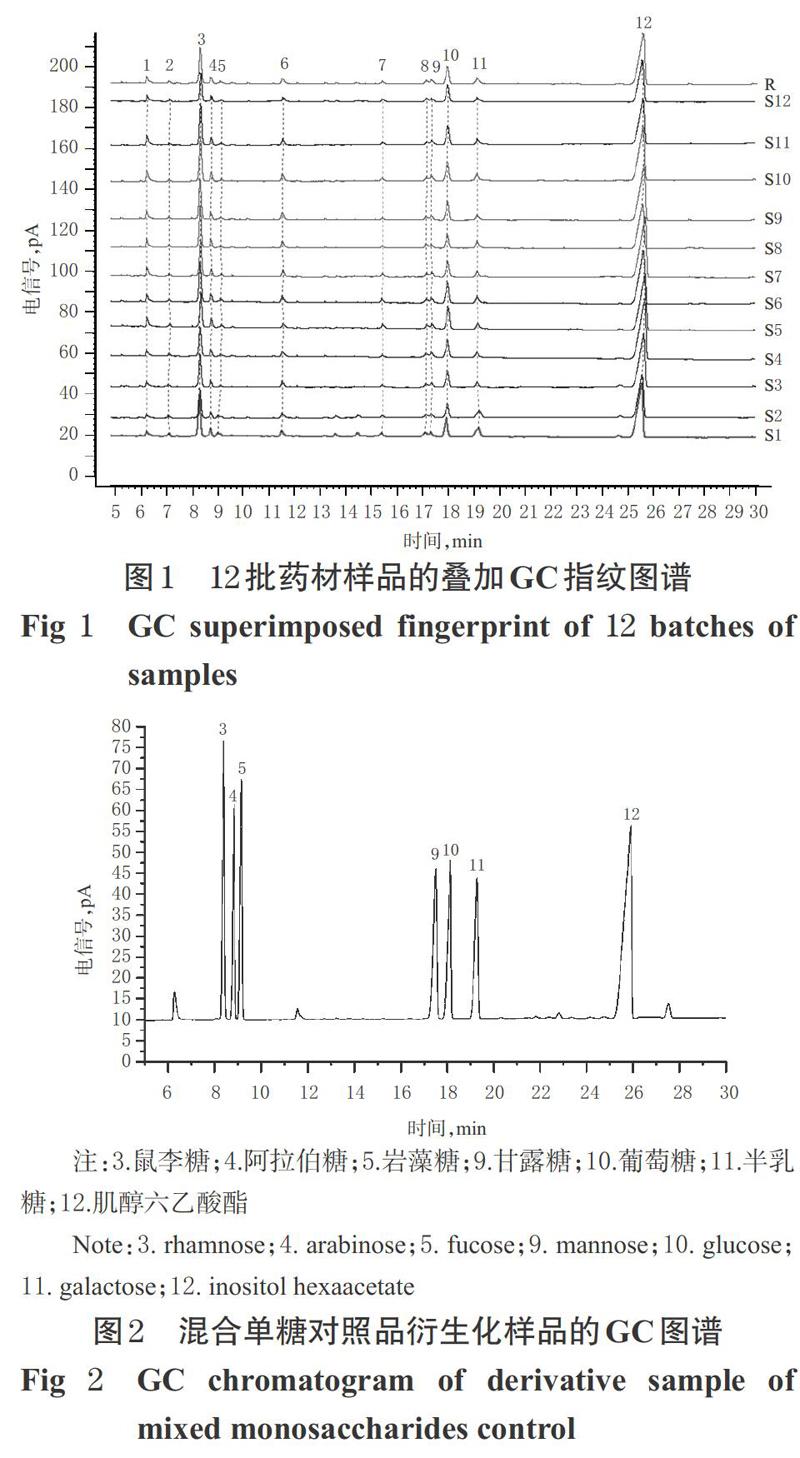
2.2.3 混合单糖对照品衍生化样品溶液 精密称取葡萄糖、阿拉伯糖、半乳糖、甘露糖、鼠李糖、岩藻糖对照品各5 mg,混合,加盐酸羟胺30 mg、吡啶1.8 mL、肌醇六乙酸酯4 mg,于90 ℃搅拌反应30 min;冷却,加醋酸酐4.8 mL,于90 ℃继续反应30 min。反应液经0.45 μm微孔滤膜滤过后,用氯仿定容至5 mL,即得各单糖质量浓度均为1 mg/mL的混合单糖对照品衍生化样品溶液,备用。
2.3 色谱条件
色谱柱:HP-5毛细管色谱柱(3 m×320 μm,0.25 μm);检测器:火焰离子化检测器(FID);进样口温度:250 ℃;检测器温度:300 ℃;升温程序:初始温度165 ℃,保持3 min,以1 ℃/min速度升温至185 ℃,保持3 min,最后以2 ℃/min速度升温至210 ℃,保持3 min;载气:氮气;氮气流速:50 mL/min;氢气流速:30 mL/min;空气流速:50 mL/min;进样量:2.0 μL;进样方式:分流进样;分流比:60 ∶ 1。
2.4 方法学考察
2.4.1 精密度试验 取“2.2.2”项下金银花多糖衍生化样品溶液(编号:S1),按“2.3”项下色谱条件连续进样6次,记录色谱图。以鼠李糖(3号峰)为参照,计算各共有峰的相对保留时间和相对峰面积。结果,12个共有峰相对保留时间的RSD均小于1%(n=6),相对峰面积的RSD均小于2%(n=6),表明本方法精密度良好。
2.4.2 重复性试验 取“2.1”项下金银花多糖样品(编号:S1)共6份,按“2.2.1”“2.2.2”项下方法制备多糖衍生化样品溶液,再按“2.3”项下色谱条件进样测定,记录色谱图。以鼠李糖(3号峰)为参照,计算各共有峰的相对保留时间和相对峰面积。结果,12个共有峰相对保留时间的RSD均小于3%(n=6),相对峰面积的RSD均小于4%(n=6),表明本方法重复性良好。
2.4.3 稳定性试验 取“2.2.2”项下金银花多糖衍生化样品溶液(编号:S1),分别于室温放置0、2、4、6、8、12、24 h时按“2.3”项下色谱条件进样测定,记录色谱图。以鼠李糖(3号峰)为参照,计算各共有峰的相对保留时间和相对峰面积。结果显示,12个共有峰相对保留时间的RSD均小于2%(n=7),相对峰面积的RSD均小于3%(n=7),表明上述样品在室温放置24 h内稳定性良好。
2.5 指纹图谱的建立及相似度分析
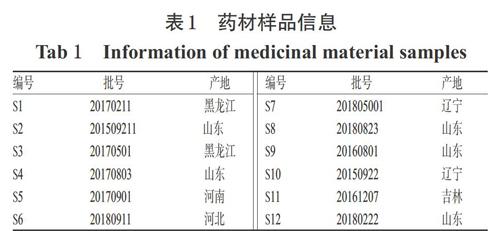
取12批金银花药材,按“2.1”“2.2.1”“2.2.2”项下方法制备多糖及其衍生化样品溶液,再按“2.3”项下色谱条件进样测定,记录色谱图。将各样品的GC图谱导入《中药色谱指纹图谱相似度评价系统(2012版)》中,设置S1样品的GC图谱为参照图谱,时间窗宽度为0.1 s,采用中位数法生成对照图谱(R),进行全峰匹配,建立指纹图谱(见图1)。结果,共得到12个共有峰(色谱峰从左到右依次编号为1~12号)。将GC指纹图谱与混合单糖对照品衍生化样品的GC图谱(见图2)进行比对,根据保留时间共指认出了7个色谱峰,其中3号峰为鼠李糖,4号峰为阿拉伯糖,5号峰为岩藻糖,9号峰为甘露糖,10号峰为葡萄糖,11号峰为半乳糖,12号峰为肌醇六乙酸酯。因3号峰峰面积较大且分离度良好,故将该峰作为参照。
借助《中药色谱指纹图谱相似度评价系统(2012版)》对12批药材的相似度进行分析。结果,12批药材的相似度≥0.994,詳见表2。
2.6 聚类分析
将12批药材共有峰的峰面积作为变量,利用SPSS 21.0软件进行聚类分析。本研究采用系统聚类法,将样品之间的距离定义为欧氏距离,并将类与类之间的距离作为最短距离,进行聚类分析并得到树状关系图,详见图3。由图3可知,当欧式距离为10~25时,样品可以分为两大类,即S1、S7、S10、S11聚为一类,其余聚为一类;在其余批次这类中,又可以分为两类,其中S3、S6聚为一类,S2、S4、S5、S8、S9、S12聚为一类。
2.7 主成分分析和因子分析
将12个批药材共有峰的峰面积作为变量,利用SPSS 21.0软件进行主成分分析和因子分析。采用降维理论[11],通过高度概括相关指标来达到浓缩数据的目的。以主成分分析得到的相关矩阵的特征值和方差贡献率为基础,进行因子分析[11];根据主成分个数确定原则,保留特征值≥1的主成分或累积贡献率≥80%的主成分[12-13]。金银花药材的主成分分析结果见表3,碎石图见图4。由表3可见,共有3个成分的特征值大于1,分别为5.659、2.745、1.724;且这3个成分的累积贡献率为84.400%,超过80%。由图4可见,4号成分为转折处的特征根编号,故4号成分前面的因子即为要提取的数目,即应提取前3个主成分为宜。
主成分数目确定后,利用因子载荷矩阵表计算综合得分,且综合得分越高,表明样品的综合评价结果越好、品质越高[11,14]。12批药材样品的主成分得分、综合得分及排名见表4。由表4可见,S12药材的品质最好,S5次之,S11最末。基于此,本课题组选取S12药材样品进行后续的体外抗病毒研究。
2.8 金银花多糖的体外抗RSV研究
2.8.1 多糖样品处理 取“2.7”项下综合得分最高的金银花药材(编号:S12),按“2.1”项下方法制备金银花多糖样品,即为总多糖。取上述总多糖用水溶解后,加0.25倍量无水乙醇进行20%醇沉,静置过夜,收集沉淀;继续于上清液中加入0.6倍量无水乙醇进行50%醇沉,静置过夜,收集沉淀;继续于上清液中加入1.5倍量无水乙醇进行80%醇沉,静置过夜,收集沉淀。将总多糖和上述沉淀分别于60 ℃真空干燥,得总多糖样品和20%醇沉多糖样品、50%醇沉多糖样品、80%醇沉多糖样品(根据多糖醇沉性质,当乙醇浓度低时,所得醇沉样品中的多糖分子量大;醇沉浓度参考相关文献[10,15]设置)。
2.8.2 RSV扩增 取RSV,加入至长成单层的Vero细胞中,确保病毒量占完全培养基(即含2%胎牛血清的RPMI 1640培养基,下同)的10%,于37 ℃、5%CO2培养箱中培养(培养条件下同)。待细胞生长至90%时收集,参考相关文献方法[16]将细胞反复冻融(-80~37 ℃)3次,以1 000 r/min离心10 min,取上清液,置于-80 ℃冰箱中冻存,备用。
2.8.3 病毒毒力测定 取Vero细胞适量,经胰酶消化后,按1×104个/孔接种至96孔板中,培养24 h至细胞长成单层,弃去培养基。用完全培养基将“2.8.2”项下上清液(即RSV)进行10倍递次稀释,按每孔100 μL将各稀释度的病毒液接种至细胞中,即为病变组;同时设置细胞对照组(含完全培养基100 ?L但不含病毒)。每组设置4个复孔。细胞培养24 h后,每孔加MTT试剂20 μL,继续培养4 h,弃去上清液;加入二甲基亚砜100 μL,同时设置空白组(仅含二甲基亚砜100 μL),使用酶标仪于492 nm波长处测定各孔光密度(OD)值,并计算细胞存活率(公式①);根据Reed-Muench法(公式②③)[17]计算病毒半数感染浓度(TCID50),以确定后续研究的病毒液浓度。
细胞存活率(%)=(病变组平均OD值-空白组平均OD值)/(细胞对照组平均OD值-空白组平均OD值)×100%…①
TCID50=Antilg[高于50%细胞病变效应(CPE)百分率病毒稀释度+比距]…②
比距(%)=(高于50%存活率-50%)/(高于50%存活率-低于50%存活率)×100%…③
结果,RSV的TCID50值为10-2.13,故选取RSV的100倍TCID50值作为病毒液浓度。
2.8.4 多糖样品细胞毒性测定 取Vero细胞适量,经胰酶消化后,按1×104个/孔接种于96孔板中,培养过夜。依据前期预试验结果,将总多糖、80%醇沉多糖、50%醇沉多糖、20%醇沉多糖分别用RPMI 1640培养基从80 g/L起以2倍比连续稀释共10个梯度后,按每孔100 ?L分别转移至细胞中;同时设细胞对照组(含完全培养基100 ?L)和利巴韦林阳性对照组(用完全培养基稀释的利巴韦林药液100 ?L;依据前期预试验结果,从250 ?g/mL起以2倍比连续稀释共10个梯度)。每组设4个复孔。细胞培养24 h后,按“2.8.3”项下MTT法使用酶标仪于492 nm波长处测定各孔OD值,按公式①计算细胞存活率,并根据Reed-Muench法(公式④)[18]计算药物对细胞的半数中毒浓度(TC50),结果见表5。由表5可见,4种多糖样品的TC50值分别为11.67、11.29、12.04、12.83 g/L,因此确定多糖的最大无毒浓度为20 g/L[19]。
TC50=[Antilg(高于50%CPE百分率加药组稀释度+比距)×C…④
式中,C为第1孔药物的终质量浓度,即最高剂量。
2.8.5 体外抗病毒测定 取Vero细胞适量,经胰酶消化后,按1×104个/孔接种于96孔板中,培养24 h至细胞长成单层后,弃去培养基。用RPMI 1640培养基将多糖样品从最大无毒浓度起依次以2倍比稀释,制得20、10、5、2.5、1.25、0.63、0.31、0.16、0.08、0.04 g/L含药培养基,依次吸取50 μL至96孔板中,各加病毒液50 μL;同时设细胞对照组(含完全培养基100 ?L)、模型组(含病毒液100 ?L)和利巴韦林组(含利巴韦林的完全培养基100 ?L;根据“2.8.4”项下结果,从60 ?g/mL起以2倍比连续稀释共10个梯度)。每组设4个复孔。细胞培养至模型组病变至90%(根据细胞形态判断)时,按“2.8.3”项下MTT法使用酶標仪于492 nm波长处检测各孔OD值,按公式①计算细胞存活率,并根据Reed-Muench法(公式⑤⑥)[18]计算药物的半数有效浓度(EC50)及治疗指数(TI),结果见表6。
EC50=[Antilg(高于50%CPE百分率药物稀释度-比距)×C…⑤
TI=[TC50
EC50] …⑥
OD值在一定范围内与活细胞数量成正比,由MTT法测得细胞组OD值为0.740 5,RSV感染的模型组OD值为0.172 1,表明在RSV干预下,细胞的存活率有所降低,模型复制成功[20]。由表6可见,金银花总多糖、80%醇沉多糖、50%醇沉多糖、20%醇沉多糖的TI值分别为15.36、18.51、11.69、4.22。一般认为当TI>4时,即为有效[21]。因此,上述4种金银花多糖对RSV均具有一定的体外抑制活性,其中80%醇沉多糖活性最强,且TI值(18.51)与阳性对照(20.08)接近;总多糖活性次之。
3 讨论
中药指纹图谱是目前能够被国内外学者普遍接受的一种中药质量评价方法,其可直接将疗效相关的有效成分作为考察指标,突出中药成分的完整面貌,可满足中医药传统理论整体性研究的需要。基于此,本研究通过GC法建立金银花多糖指纹图谱,对不同产地的12批金银花药材进行质量对比分析,旨在为金银花药材的质量控制提供参考。
当样品制备方法不同时,其所获得的色谱指纹图谱差异很大,分析结果也完全不同[22]。因此,在指纹图谱分析中,必须重视样品的制备方法。在前期研究中,笔者对提取方法(传统热水提取法、超声辅助热水提取法)、醇沉次数(一次醇沉、二次醇沉)等因素进行了考察。在综合考虑GC色谱峰峰形、对称性及分离度等因素的影响后,发现两种提取方法所得的色谱峰峰形相似,但采用传统热水提取法时,所得色谱峰尖锐、对称,多糖得率高;与一次醇沉相比,二次醇沉后所得多糖的分离效果较好。因此,最终确定采用传统热水提取法并进行二次醇沉制备多糖。
由方法学考察结果可以看出,本研究所建立的金银花多糖指纹图谱分析方法准确、可靠。共指认7个共有峰,且各批金银花药材多糖样品的相似度≥0.994,表明市售药材样品化学成分相对稳定,药材成分具有较好的一致性。
聚类分析可在事物分类面貌尚不明确的情况下讨论事物的分类情况,是“无师可寻”的统计分类方法[23]。聚类分析结果显示,主产于东北地区的药材(S1、S7、S10、S11)聚为一类,主产于山东、河南两地的药材(S2、S4、S5、S8、S9、S12)聚为一类。主成分和因子分析结果显示,主产于山东的S12品质最好,主产于河南的S5品质次之,主产于吉林的S11最末,提示由于气候环境的不同,不同产地的金银花药材在质量上存在差异。
金银花是临床上治疗呼吸道感染的要药[24]。研究表明,RSV是引起呼吸道病毒感染的主要病原之一,但由于缺乏疫苗且化学药致不良反应较多,RSV所致感染的临床治疗方案一直存有争议[25-26]。利巴韦林作为广谱抗病毒药物,抗病毒活性强,但毒性较大,易造成可逆性溶血性贫血,故其临床应用受限[27]。因此,开发金银花等抗RSV中药具有一定的价值。本研究从多糖最大无毒浓度开始连续2倍比稀释,以排除药物本身的毒性作用,且安全范围相对较宽,符合临床用药标准[28];所选用的TI值可反映药物对病毒的抑制作用,当TI>4时,即可认为药物有效,且该值越大则表明药物对病毒的抑制作用越强[21,29]。本研究结果显示,不同多糖样品抑制RSV的TI值均大于4,可认为其均具有体外抗病毒的作用,且活性由高到低依次为80%醇沉多糖、总多糖、50%醇沉多糖、20%醇沉多糖。分析其原因,笔者认为可能与醇沉效果有关:80%醇沉多糖的糖含量相对较高;而当乙醇浓度较低时,所得醇沉样品中的多糖分子量大,且在醇沉过程中,大分子蛋白等杂质也会随之析出,从而影响多糖的抗病毒效果[10,15]。此外,本研究结果表明,金银花80%醇沉多糖的TI值和利巴韦林相近,且EC50值在各种多糖成分中最低,提示80%醇沉多糖可能为金银花抗病毒的活性部位。
综上所述,本研究所建立的指纹图谱可为金银花药材的质量评价提供参考,并发现金银花多糖具有一定的体外抗RSV活性。本研究为金银花抗病毒活性评价奠定了基础,同时也为中药抗RSV提供了新的研究方向。但由于中药化学成分复杂,有部分色谱峰未被指认,故笔者下一步将确定其他未知共有峰所代表的化合物,并深入挖掘金银花多糖抗病毒的作用机制。
参考文献
[ 1 ] 国家药典委员会.中华人民共和国药典:一部[S]. 2015年版.北京:中国医药科技出版社,2015:221.
[ 2 ] 于洋,宋卫霞,郭庆兰,等.金银花水提取物的化学成分研究[J].中国中药杂志,2015,40(17):3496-3504.
[ 3 ] 朱小峰,朱晓娣,王金梅.封丘产金银花不同提取物的体外抗氧化、抗凝血及α-葡萄糖苷酶抑制活性研究[J].中国药房,2016,27(34):4804-4806.
[ 4 ] WANG D,ZHAO X,LIU Y. Hypoglycemic and hypolipidemic effects of a polysaccharide from flower buds of Lonicera japonica in streptozotocin-induced diabetic rats[J]. Int J Biol Macromol,2017. DOI:10.1016/j.ijbiomac.2017.
04.056.
[ 5 ] 毛淑敏,許家珍,焦方文,等.金银花多糖对免疫低下小鼠免疫功能的影响[J].辽宁中医药大学学报,2016,18(2):18-20.
[ 6 ] 刘玉国,刘玉红,蒋海强.金银花多糖对小鼠S180肉瘤的抑制作用与机制研究[J].肿瘤学杂志,2012,18(8):584-587.
[ 7 ] 贾伟,毛淑敏,张盼盼,等.金银花多糖体内抗病毒作用研究[J].辽宁中医药大学学报,2018,20(6):25-27.
[ 8 ] 甄亚钦,冯玉,田伟,等.忍冬不同部位UPLC指纹图谱及化学模式识别研究[J].中草药,2019,50(18):4449-4454.
[ 9 ] 汪海斌,石岩,李芳,等.中药黄芪指纹图谱的研究进展[J].中国药房,2017,28(33):4749-4752.
[10] 闫光玲,张锋,金娟,等.金银花多糖分子量及单糖组成研究[J].中国中医药信息杂志,2019,26(2):97-101.
[11] 王悦云,王雪飞,刘娇,等.不同产地巫山淫羊藿指纹图谱的主成分、因子和聚类分析[J].中国实验方剂学杂志,2019,25(7):165-172.
[12] 林楠.不同产地枸杞品质对比研究及优良株系的筛选[D].兰州:甘肃农业大学,2013.
[13] 邵明灿,胡花丽,王毓宁,等.基于主成分分析法分析一氧化氮对绿芦笋贮藏品质的影响[J].食品科学,2012,33(20):318-322.
[14] 荆文光,张权,邓哲,等.指纹图谱、多成分定量与化学计量学相结合的厚朴药材质量评价[J].中国中药杂志,2019,44(5):975-982.
[15] 蔡锦源,朱炽雄,孙松,等.香菇多糖的微波预处理-超声波提取工艺及其抗氧化活性研究[J].河南工业大学学报(自然科学版),2016,37(4):84-90.
[16] 马倩.植物性多酚多糖体外抗病毒作用的初步研究[D].兰州:甘肃农业大学,2018.
[17] 王剑,侯林,陈亚乔,等.金银花多糖的提取纯化及抗病毒活性研究[J].中国医院药学杂志,2018,38(8):810-812.
[18] 刘相文,侯林,崔清华,等.金樱子多糖的提取优化及其体外抗病毒活性研究[J].中药材,2017,40(7):1679-1682.
[19] 杜海霞,万海同,何昱,等.银花平感颗粒的体外抗甲型H1N1流感病毒作用[J].中医杂志,2017,58(23):2039- 2044.
[20] 武虹波,赵丕文,孙丽萍,等.四物合剂干预顺铂作用卵巢颗粒细胞E2分泌水平的实验研究[J].环球中医药,2017,10(4):447-451.
[21] 岳路路.中药海藻提取物的抗病毒活性研究[D].济南:山东中医药大学,2017.
[22] CHEN L,LIU J,WANG Q,et al. Fingerprint comparison between gegen qinlian preparations of three different pharmaceutical forms including decoction,dispensing granule and pill[J]. Chromatographia,2009,69(1):123-127.
[23] 朱迪,谭丹,谢玉敏,等.不同产地天麻药材薄层色谱指纹图谱分析[J].中国实验方剂学杂志,2015,21(5):75-78.
[24] 何显忠,兰荣德.金银花的药理作用与临床应用[J].时珍国医国药,2004,15(12):865-867.
[25] 杜海涛,孙铁锋,王平,等.清热药抗呼吸道合胞病毒的研究进展[J].中成药,2019,41(10):2435-2441.
[26] GLICK AF,KJELLEREN S,HOFSTETTER AM,et al. RSV hospitalizations in comparison with regional RSV activity and inpatient palivizumab administration:2010- 2013[J]. Hospital Pediatrics,2017,7(5):271-278.
[27] 王剑,侯林,陈亚乔,等.黄芩提取物体外抗病毒药效学研究[J].中成药,2017,39(9):1924-1927.
[28] 吴璇,于莉,胡涛,等.蒲地蓝消炎口服液对呼吸道合胞病毒和腺病毒的体外抗病毒作用[J].实用医学杂志,2015,31(11):1838-1840.
[29] 魏晓露.广藿香油抗病毒的物质基础研究[D].成都:成都中医药大学,2013.
(收稿日期:2019-09-07 修回日期:2020-02-20)
(编辑:张元媛)
