miR-587调节TLR4表达对人主动脉内皮细胞生长的影响
2020-07-23李致池张月兰
李致池, 张月兰
中国医科大学附属第一医院心内科(辽宁沈阳 110001)
动脉粥样硬化的特征是内皮功能障碍、脂质积聚、巨噬细胞和淋巴细胞浸润、血管平滑肌细胞增殖、结缔组织增生和各种大小动脉中动脉粥样硬化斑块的形成。导致动脉壁增厚和弹性丧失,是冠状动脉疾病、缺血性卒中、颈动脉狭窄、肾动脉阻塞、视网膜动脉阻塞、外周动脉疾病等多种严重动脉闭塞性疾病的主要原因[1-2]。迄今为止,动脉粥样硬化的确切潜在致病机制尚未完全阐明。然而,有充足的证据支持各种信号通路的异常表达在动脉粥样硬化发病机制中起着核心作用[3]。类Toll受体(Toll like receptors, TLR)与其相应配体的结合导致衔接蛋白的募集、下游信号转导途径的激活、细胞因子和趋化因子的上调,最终导致免疫反应的发展。先前的研究表明,与TLR信号通路密切相关的炎症标志物,如C反应蛋白、肿瘤坏死因子-α、细胞间黏附分子-1和白细胞介素-6,在动脉粥样硬化患者中显著升高[4]。此外,研究指出激活TLR信号通路可促进动物模型的动脉粥样硬化[5]。近年来,越来越多的研究关注微小RNA(microRNA, miRNA)在血管疾病中的作用。miRNA是一组进化上保守的、内源性的、非编码的、长度为18~22个核苷酸的RNA。通过在转录后水平与靶mRNA的3′非翻译区(3′untranslated region, 3′UTR)配对,负性调节基因表达,通过mRNA降解或翻译抑制导致蛋白表达降低。miRNA参与多种病理生理过程,包括分化、生长、增殖和凋亡[6]。此外,研究发现异常表达的miRNA可以通过多种靶向因子或关键信号通路调节动脉粥样硬化的发生、发展[7]。研究指出,miR-590可以通过调节TLR4/NF-κB通路,抑制内皮细胞凋亡进而影响动脉粥样硬化进程[8];miR-15能够通过mTOR信号通路介导内皮祖细胞自噬并影响冠状动脉粥样硬化性心脏病[9]。miR-587目前被认为与结肠癌的耐药相关,具有促进细胞增殖抑制细胞凋亡的作用[10],报道指出,血清miR-587水平与空腹血糖呈负相关,与总胆固醇呈负相关[11],但是miR-587在动脉粥样硬化中的作用机制目前尚无研究。本课题组的前期研究指出,miR-587在ox-LDL处理的人主动脉内皮细胞(human aortic endothelial cells, HAECs)中表达较低,并且通过生物学软件预测得知miR-587能够靶向结合TLR4,由此推断miR-587可能在动脉粥样硬化中发挥重要作用。2019年3—9月,本研究通过体外实验证实了miR-587可以通过调节TLR4通路影响人主动脉内皮细胞的生长能力。
1 材料与方法
1.1 主要试剂 HAECs实验室冻存,DMEM (Dulbecco′s Modified Eagle Media)培养基(Gibco,美国),胎牛血清(天津灏洋,天津)培养。TLR4 和GAPDH抗体及相关二抗购自美国Santa Cruz。TLR4 WT, TLR4 MUT(突变与miR-587结合位点的序列)引物均合成于上海生工。荧光素酶报告基因试剂盒,SBYR试剂盒购自上海碧云天生物有限公司。miR-587 mimic(拟似物), miR-587 inhibitor(抑制物)及NC control(对照)购自于广州锐博生物公司。
1.2 方法
1.2.1 细胞培养 HAECs使用含10%胎牛血清的DMEM,置于含5%CO2的37℃培养箱中恒温培养。
1.2.2 ox-LDL处理HAECs 细胞生长约70%~80%密度,添加100 μg/mL的ox-LDL(Unionbiol,中国北京)孵育24 h。
1.2.3 细胞活力测定 分别将miR-587 mimic/inhibitor和control转染到HAECs后,得到miR-587过表达/低表达的细胞系。我们利用MTT的方法,于0、12、24、36和48 h这几个时间点分别检测细胞增殖情况,采用3-(4,5-二甲基噻唑-2-基)-2,5-二苯基四唑溴化铵(3-(4, 5-dimethylthiazol-2-yl)-2, 5-diphenyltetrazolium bromid, MTT)测定细胞活力。将细胞以每孔2×104的密度接种到96孔板中,培养基为200 μL,并用NC-control、miR-587 mimic或miR-587 inhibitor分别进行转染。然后,在不同时间点将20 μL MTT溶液(5 mg/mL;sigma)添加到每个孔中,并在37℃下再培养4 h。随后,丢弃上清液并添加150 μL二甲基亚砜以溶解甲赞晶体。用酶标仪(Molecular Devices, Sunnyvale, 美国)测量490 nm处的光密度。
1.2.4 流式细胞仪分析 在HAECs细胞中过表达了或沉默表达miR-587,采用JC-1细胞凋亡检测试剂盒(BD Biosciences,美国)对不同处理因素作用后细胞的凋亡进行评估。用PBS洗涤2次细胞,消化,然后在200 μL结合缓冲液中将2×105细胞/mL的密度重新悬浮。然后,在黑暗中用5 μL的JC-1对细胞进行15 min染色。最后,用流式细胞仪检测细胞凋亡率。
1.2.5 Real-time PCR 分别检测ox-LDL处理的HAECs以及正常的HAECs中miR-587和TLR4的表达情况,用TRIzol(invitrogen,上海碧云天生物有限公司)从细胞中提取总RNA。为了测定miR-587和TLR4的含量,使用Taqman反转录试剂盒(Bio-Rad Laboratories, 上海碧云天生物有限公司)将总RNA反转录成cDNA。在CFX96TM实时PCR检测系统(Bio-Rad Laboratories,Hercules,美国)上进行real-time PCR实验。
U6和GAPDH被作为内参。引物如下:(1)miR-587: 5′-CCAGGCAAGAGAGAGUUGCUG-3′(正向),5′-AGUCACAGGUGCAGACACAUU-3′(反向);(2)U6:5′-GCUUCGGCAGCACAUAUACUAAAAU-3′(正向),5′-CGCUUCACGAAUUUGCGUGUCAU-3′(反向);(3)TLR4:5′-TGATGTCTGCCTCGCGCCTG-3′(正向),5′-TAGGAACCACCTCCACGCAGGG-3′(反向);(4)GAPDH:5′-CAAGGTCATCCATGACAACTTTG-3′(正向),5′-GTCCACCACCCTGTTGCTGTAG-3′(反向)。
1.2.6 Western blot 为了检测miR-587与TLR4之间相互作用关系,分别行Western blot实验检测转染miR-587后TLR4受体及细胞凋亡相关蛋白Caspase 8的表达及再次转染TLR4后是否可以抵消miR-587对HAECs的促进增值及抑制凋亡作用,使用含有蛋白酶抑制剂(sigma)的RIPA溶解缓冲液(invitrogen,上海碧云天生物有限公司),从处理过的细胞中提取蛋白。等量的蛋白质进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳,并转移到聚偏氟乙烯膜(MiLople,Bead For,美国)。在含有0.05%吐温-20的TBS中用5%脱脂奶粉乳封闭2 h后,将膜与一抗(TLR4和GAPDH)在4℃孵育过夜,然后在室温下与辣根过氧化物酶结合二抗(Santa Cruz Biotechnology,Santa Cruz,CA,美国)孵育1 h。ECL试剂盒(GE Healthcare,Solingen,德国)进行发光。
1.2.7 结合位点验证 为验证miR-587与TLR4可以特异性结合通过生物学软件MicroRNA Database预测寻找miR-587与TLR4可能的结合位点。
1.2.8 荧光素酶报告分析 合成了含有miR-587假定结合位点的TLR4的3′UTR序列,并将其插入PMIR报告荧光素酶报告质粒(Promega,Madison,WI,美国)中,得到TLR4 WT(上海生工生物有限公司),TLR4 MUT(在miR-587结合位点具有突变序列)。将细胞接种到具有200μL培养基的96孔板中,并分别转染50 nmol/L miR-587或对照。转染后48 h收集细胞,用双荧光素酶报告分析系统检测相对荧光素酶活性。
1.3 统计学方法 使用SPSS 11.0统计软件,实验分3次进行,所有结果显示为3个独立实验的“平均值±标准差”,并进行方差分析或学生t检验的单向分析。以P<0.05为差异有统计学意义。
2 结果
2.1 miR-587和TLR4在ox-LDL处理的HAECs中的表达情况 ox-LDL处理后能够上调细胞中的TLR4表达并且下调miR-587的表达,见图1。
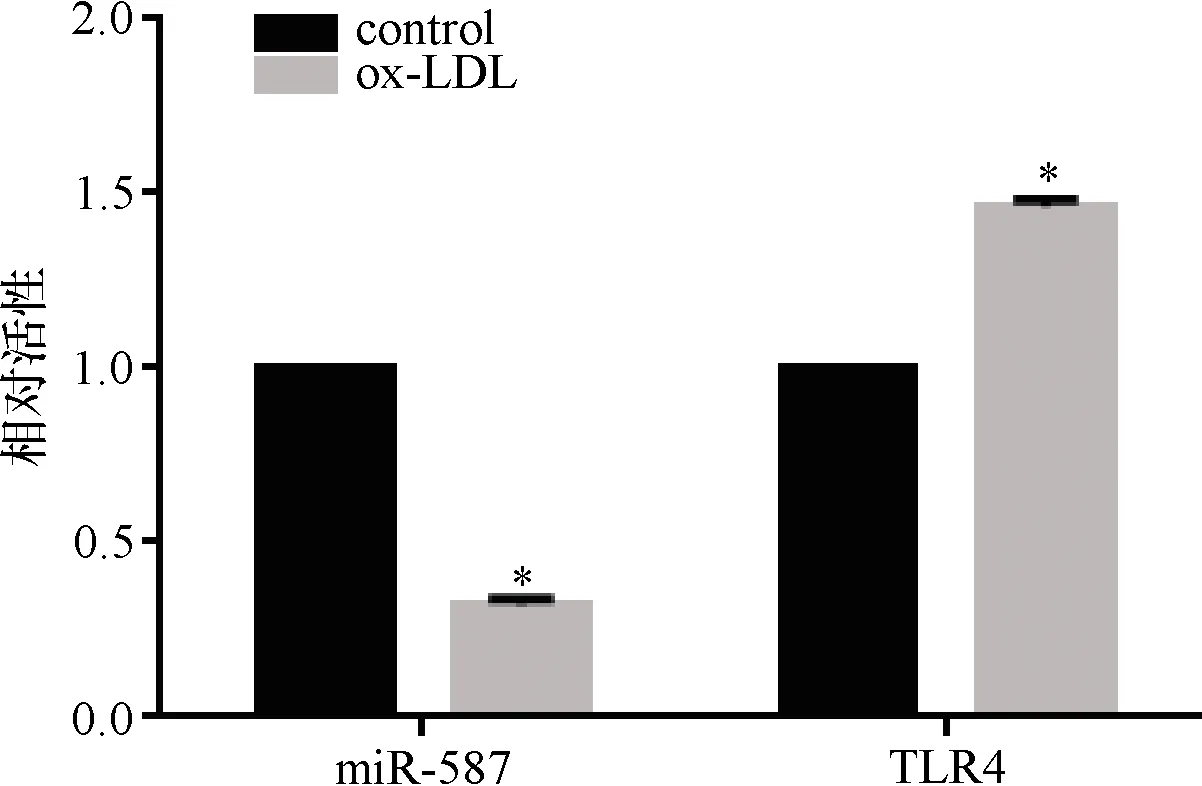
注:*与control比较 P<0.05
2.2 miR-587对人主动脉内皮细胞生长的调节作用 miR-587对细胞的增殖具有显著的促进作用(P<0.05),miR-587抑制剂能够明显抑制细胞增殖(P<0.05), 其中miR-587作用细胞24 h时对于细胞增殖的促进率为(36.77±6.00)%,miR-587抑制剂作用细胞24 h时对细胞增殖的抑制率为(38.01±5.62)%,见表1。研究者在HAECs细胞中过表达了或沉默表达miR-587,并且通过JC-1染色检测细胞的凋亡情况,结果发现miR-587能够抑制细胞的凋亡,结果见图2。
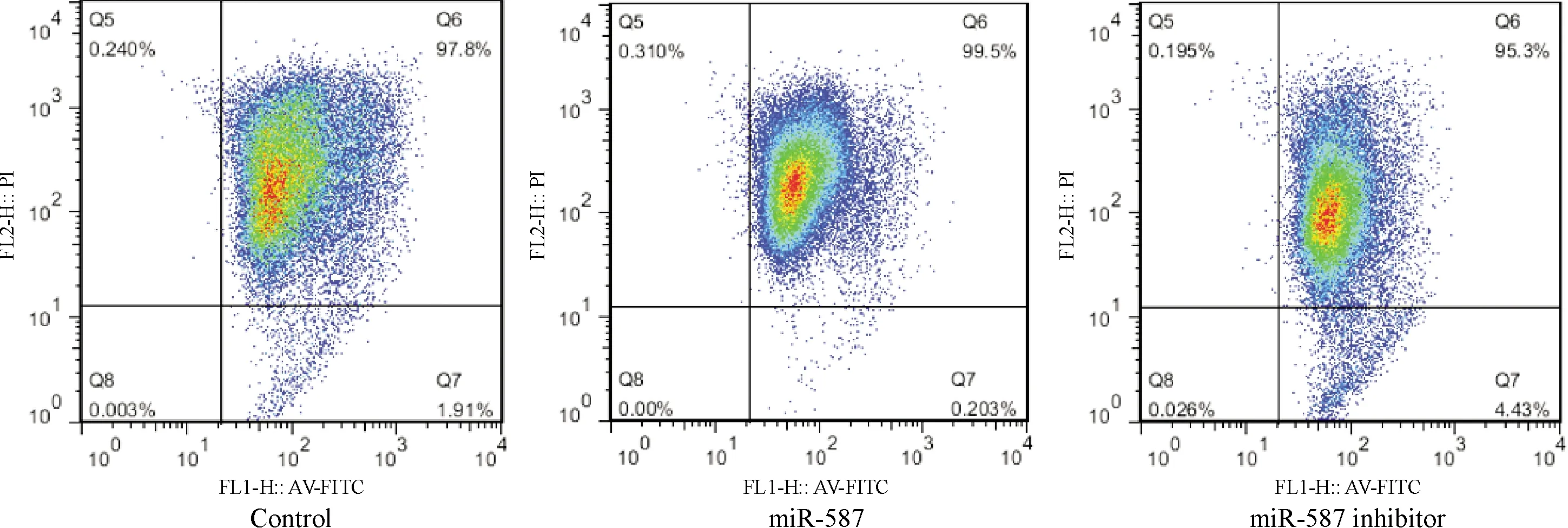
图2 miR-587对细胞凋亡能力的影响
表1 不同处理因素对细胞增殖情况的影响
2.3 miR-587对TLR4的调节作用 miR-587与TLR4的3′UTR区域具有结合位点,见图3。
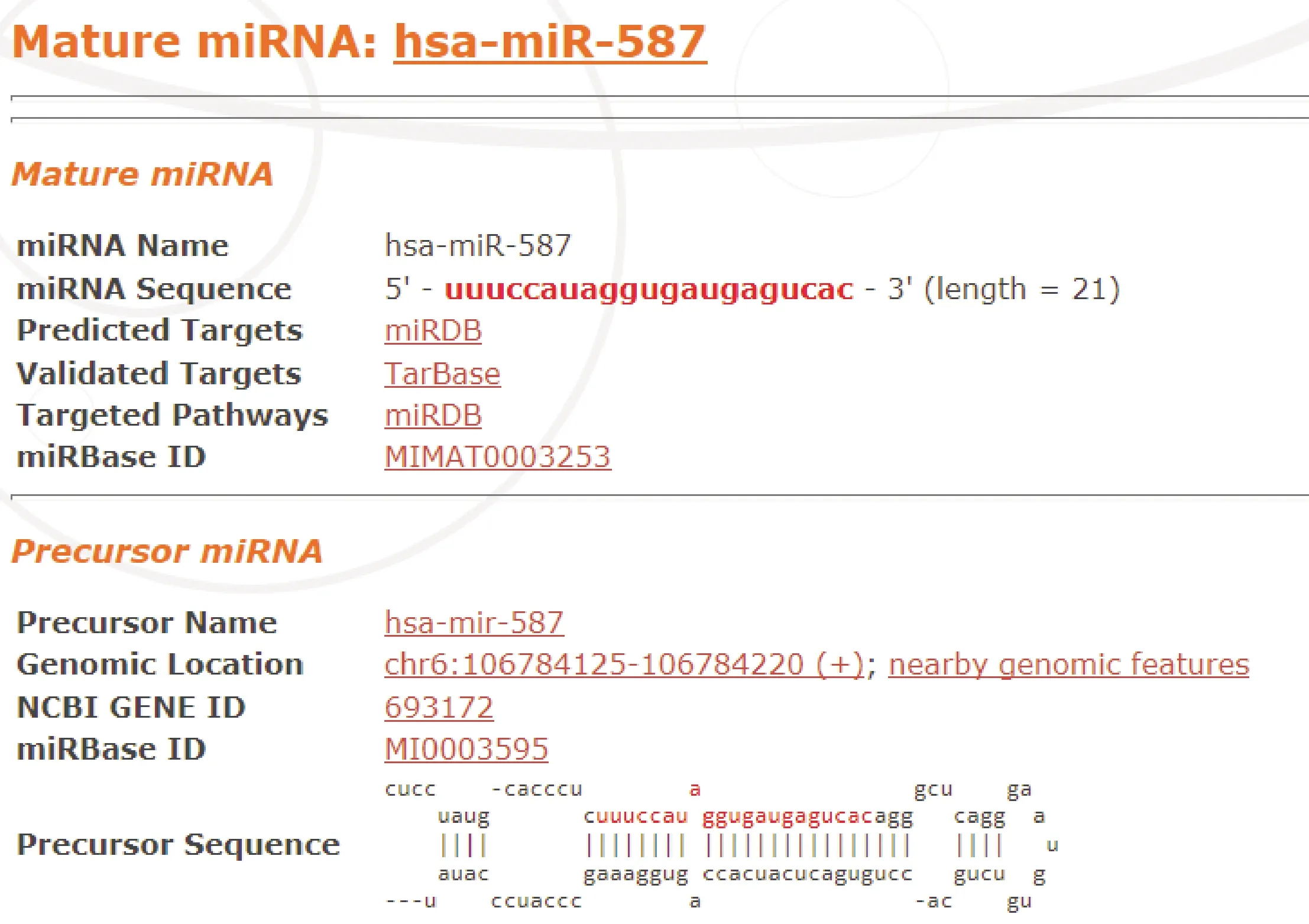
图3 miR-587与TLR4的结合位点预测
2.3.1 荧光素酶报告基因实验 当miR-587与TLR4共同转染时,TLR4的活性显著下调,当miR-587与TLR4 MUT共同转染时,不会影响TLR4的活性, miR-587可以直接作用于TLR4,见图4。

注:*与control相比P<0.05
2.3.2 构建了miR-587过表达/沉默表达的细胞系 结果发现miR-587对TLR4有一定的抑制作用,见图5。
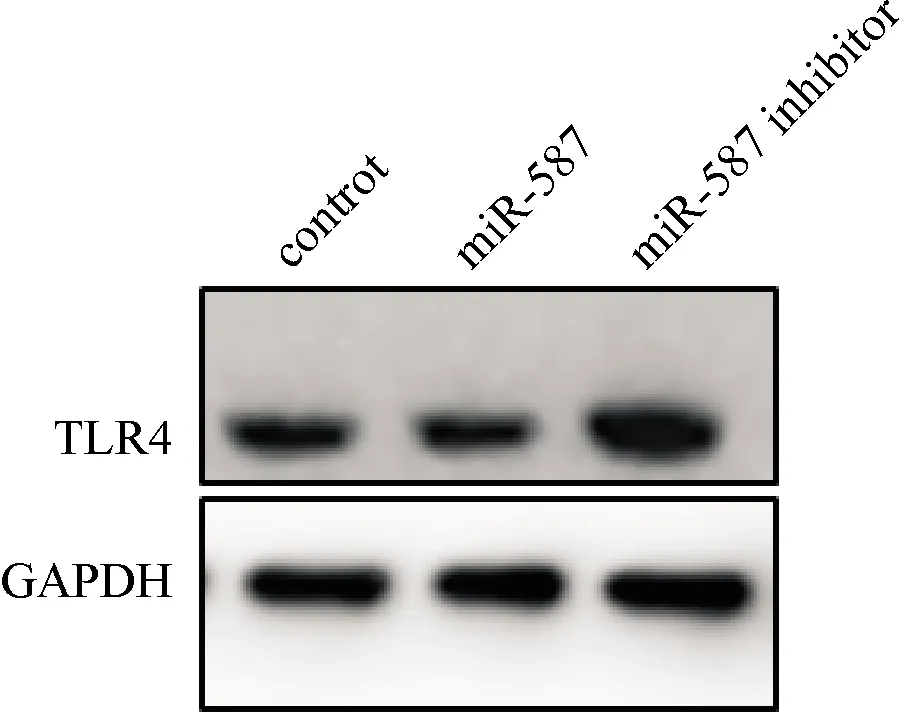
图5 miR-587对TLR4蛋白的影响
2.3.3 miR-587对Caspase 8的影响 miR-587过表达能够下调Caspase 8的表达,见图6。
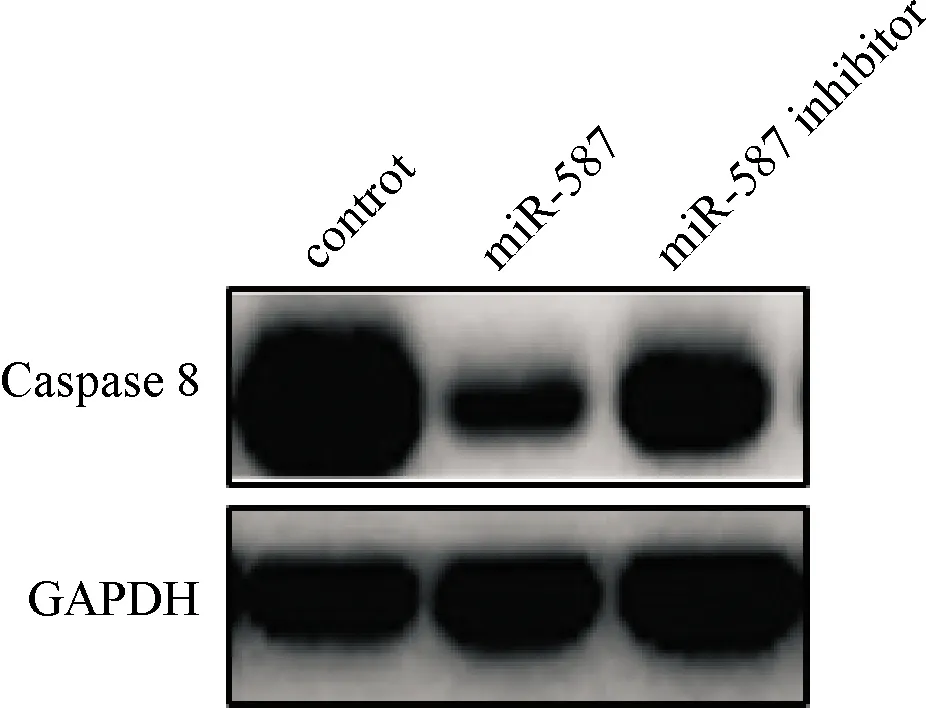
图6 miR-587对相关蛋白的影响
2.3.4 TLR4对miR587促进增殖作用的影响 miR-587明显促进细胞增殖,与对照组相比差异有统计学意义(P<0.05),TLR4可以恢复由miR-587过表达导致的细胞增殖的促进作用,与miR-587组相比差异有统计学意义(P<0.05),见表2。
表2 不同处理因素对细胞增殖情况的影响
2.3.5 TLR4对miR578抑制凋亡作用的影响 TLR4的添加能够恢复由miR-587造成的凋亡抑制,见图7。

图7 细胞凋亡能力的检测
2.3.6 Western blot检测miR-587对于细胞凋亡相关蛋白Caspase 8的调节作用 结果发现TLR4能够恢复由于miR-587导致的TLR4和Caspase 8表达下调,见图8。
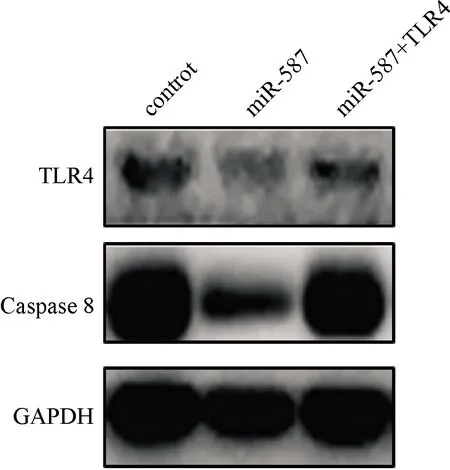
图8 相关蛋白的检测
3 讨论
研究表明动脉粥样硬化的进展是一个复杂的多步骤过程。内皮细胞功能障碍可能受到内皮细胞增殖和凋亡的影响,被认为是动脉粥样硬化发病的主要因素[8]。近年来,由于其在动脉粥样硬化进展中的重要调控作用,miRNA越来越引起人们的关注。据报道,miR-98可促进暴露于ox-LDL的人脐静脉内皮细胞的增殖并减轻其凋亡[12]。miR-126可抑制ox-LDL诱导的Thp-1巨噬细胞脂质积聚,从而成为动脉粥样硬化的潜在治疗靶点[13]。外源性的miR-590过度表达可减轻HFD喂养的ApoE-/-小鼠的动脉粥样硬化病变,维持细胞增殖,并抑制ox-LDL治疗的血管内皮细胞的凋亡[14]。
在目前的研究中,我们首先证明了在ox-LDL诱导的HAECs细胞中miR-587表达下调。并且通过MTT和JC-1实验证实miR-587具有促进HAECs细胞增殖抑制其凋亡的作用。
TLR是一种进化上保留的模式识别受体,由于其固有免疫、炎症和动脉粥样硬化之间的联系,最近受到越来越多的关注。作为TLR家族中研究最广泛的受体,TLR4在动脉粥样硬化不同阶段的动脉粥样硬化病变中大量表达,据报道,TLR4缺乏可减弱ApoE-/-小鼠的主动脉动脉粥样硬化病变区域和炎症细胞因子水平,提示TLR4在动脉粥样硬化发病机制中起着关键作用[15]。有报道指出,miR-590过表达通过抑制TLR4/ NF-κB途径,抑制高脂饮食诱导的载脂蛋白E缺陷小鼠动脉粥样硬化病变,促进ox-LDL治疗的内皮细胞增殖和抑制凋亡[8]。在我们的研究中,我们发现TLR4在ox-LDL诱导的HAECs细胞中表达上调,这一结论与前人的结果相似。由于miR-587能够促进细胞增殖,抑制细胞的凋亡,抑制caspase 8的表达,并且其表达变化情况与TLR4相反。研究者通过生物学软件分析,发现miR-587与TLR4具有靶向结合位点。进一步的荧光素酶报告基因实验证明了miR-587能够通过靶向结合作用下调TLR4的生物学活性,western blot实验指出,miR-587能够抑制TLR4的表达,miR-587受到抑制后TLR4的表达受到促进。在本研究中,我们将TLR4转染到过表达miR-587的细胞中,结果发现,TLR4的转染能够在一定程度上恢复由于miR-587造成的细胞增殖的促进和细胞凋亡的抑制,并且能够恢复miR-587造成的caspase 8的表达下调。
本研究表明,miR-587可以通过抑制TLR4参与调节动脉粥样硬化的发生发展,可能为动脉粥样硬化的临床治疗提供新的可能。
