TNF-α抑制剂对风湿性膝关节滑膜炎大鼠氧化应激抑制作用及下游信号通路的影响*
2020-07-23刘冰山阮昆鹏张登峰武豪杰赵清
刘冰山, 阮昆鹏, 张登峰, 武豪杰, 赵清
河南大学淮河医院 1骨科关节科, 2风湿免疫科(河南开封 475000)
作为临床的一种常见病、多发病,风湿性滑膜炎多发于膝关节部位,可累及全身,其发病原因仍未完全阐明,且不能治愈,仍是目前临床治疗的难点。在风湿性滑膜炎发作期,可出现多关节肿痛,包括手、髋、膝关节等,若病情未能得以有效控制则会造成迁延不愈,导致病变关节病损,引起关节功能障碍。所以,及时进行有效治疗和干预,尽早控制病变关节的炎症状态显得尤为重要。有研究发现,肿瘤坏死因子-α(tumor necrosis factor-alpha,TNF-α)在类风湿性关节炎的病理过程和发病机制中具有关键作用,也是治疗该病的重要靶点[1]。另有研究指出,TNF-α抑制剂具有下调TNF-α表达和减缓炎性反应进展的作用[2]。氧化应激不仅是风湿性滑膜炎的一种主要诱因,而且是该病发生的一种病理结果。基于既往以TNF-α抑制剂为代表的生物制剂成为治疗多种自身免疫性疾病(如强直性脊柱炎、类风湿性关节炎等)的热点,我们于2017年6月至2018年12月开展动物实验研究,旨在分析TNF-α抑制剂对膝关节类风湿性滑膜炎大鼠氧化应激抑制作用及下游信号通路的影响,从而为探究TNF-α抑制剂在风湿性膝关节滑膜炎中的应用奠定实验基础和理论依据。
1 材料与方法
1.1 实验动物 取36只健康雄性成年SD大鼠,8~10周龄,体重180~220 g,均由广州吉妮欧生物科技有限公司提供。在无菌环境下,于本院动物实验室进行常规饲养,室内温度控制在22~26℃,相对湿度55%~65%,可自由进食、饮水,给予充足光照。
1.2 实验方法
1.2.1 动物模型的建立及分组 在适应性饲养1周后,36只SD大鼠随机分为对照组、模型组、干预组各12只。其中,对照组为正常大鼠,未进行任何用药;模型组和干预组均采用风(风速4~5 m/s)、寒(室内温度7~9℃)、湿(相对湿度80%~90%)的环境因素联合膝关节内注射0.5%木瓜蛋白酶(南宁东恒华道生物科技有限责任公司)0.30 mL+0.03 mol/L半胱氨酸蛋白酶(上海联迈生物工程有限公司)0.20 mL制备风湿性膝关节滑膜炎大鼠模型;模型组经尾静脉注射等量生理盐水,干预组经尾静脉注射TNF-α抑制剂阿达木单抗(英国AbbVie Ltd.公司)0.50 mg/kg。
1.2.2 外周血细胞因子和氧化应激指标的检测 造模后4周,于大鼠腹腔注射体积分数为10%的戊巴比妥钠进行常规麻醉,腹主动脉采血2 mL,以3 000 r/min离心10 min,取血清标本置于-80℃冰箱中冷冻保存。采用酶联吸附试验法检测血清细胞因子TNF-α、白细胞介素(interleukin,IL)-1β、IL-6和基质金属蛋白酶9(matrix metalloproteinase-9,MMP-9),速率散射比浊法检测大鼠血清C反应蛋白,检测试剂盒购自上海斯信生物科技有限公司;亚硝酸还原法检测血清超氧化物歧化酶(superoxide dismutase,SOD),硫代巴比妥酸比色法检测谷胱甘肽和丙二醛,试剂盒购自浙江迈康生物工程有限公司,严格按照试剂盒说明书指示完成检测。
1.2.3 膝关节病理学检查 取大鼠膝关节滑膜组织,置于4%多聚甲醛固定、梯度乙醇脱水、透明、浸蜡、包埋、切片、脱蜡,行苏木精-伊红染色(染色液购自上海基尔顿生物科技有限公司),并于显微镜(日本Olympus公司)下进行观察。
1.2.4 Western blot法检测膝关节滑膜组织蛋白表达 采用Western blot法检测膝关节滑膜组织TNF-α转换酶(TNF-α converting enzyme,TACE)和核转录因子-κB(nuclear factor-kappa B,NF-κB)蛋白表达。取大鼠膝关节软骨滑膜组织,经液氮进行研磨,加入RIPA裂解液进行裂解;离心,取上清液,加入十二烷基硫酸钠缓冲液充分混匀;提取总蛋白,匀浆,检测蛋白含量;行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转膜、封闭。以β-actin为内参照,加入β-actin、TACE、NF-κB一抗(美国CST公司),于4℃孵育并过夜;次日,加入经辣根过氧化物酶标记的羊抗兔二抗(英国Abcam公司),于37℃温度下反应30 min,洗膜,对目的条带的吸光度值进行定量分析。

2 结果
2.1 3组大鼠膝关节病理学观察 3组大鼠造模成功,期间无大鼠死亡的情况。对照组大鼠膝关节滑膜无新生血管形成,未出现炎性细胞浸润,滑膜层较薄;模型组大鼠膝关节滑膜组织中可见明显增多的炎性细胞,并且新生血管形成,滑膜层增厚明显;干预组大鼠膝关节滑膜组织中出现少量新生血管,可见少量炎性细胞浸润。提示本实验成功建立风湿性膝关节滑膜炎大鼠模型。见图1。
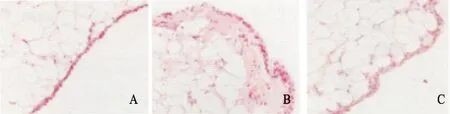
注:A:对照组;B:模型组;C:干预组
2.2 3组大鼠血清细胞因子水平的比较 相比对照组,模型组和干预组血清TNF-α、IL-1β、IL-6、MMP-9及C反应蛋白含量均明显升高(P<0.05),且干预组血清TNF-α、IL-1β、IL-6、MMP-9及C反应蛋白含量较模型组均明显降低(P<0.05)。见表1。

表1 3组大鼠血清细胞因子水平的比较
2.3 3组大鼠外周血氧化应激指标的比较 模型组和干预组血清丙二醛含量较对照组均明显升高,谷胱甘肽和SOD的水平较对照组均明显降低(P<0.05);相比模型组,干预组血清丙二醛的水平显著降低,谷胱甘肽和SOD含量均明显升高(P<0.05)。见表2。

表2 3组大鼠外周血氧化应激指标的比较
2.4 3组大鼠膝关节滑膜组织TACE和NF-κB蛋白表达的比较 模型组、干预组膝关节滑膜组织TACE和NF-κB蛋白表达水平较对照组均明显上调(P<0.05),干预组TACE和NF-κB蛋白表达较模型组均明显下调(P<0.05)。见图2、表3。

表3 3组大鼠膝关节滑膜组织TACE和NF-κB蛋白表达的比较
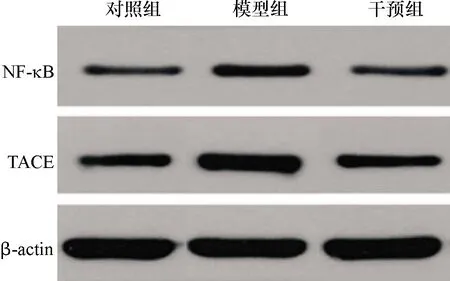
图2 3组大鼠膝关节滑膜组织TACE和NF-κB蛋白表达的检测(Western blot法)
3 讨论
风湿性滑膜炎是临床常见的一种风湿病,具有反复发作的特点,其发病机制目前尚未完全明确,但可能与自身免疫系统相关性疾病密切相关。采用膝关节内注射药物的方式制备膝关节滑膜炎动物模型,具有操作简单方便、造模成功率高等优势。国外研究报道,于大鼠膝关节内注射木瓜蛋白酶联合半胱氨酸蛋白酶的方法诱导膝关节滑膜炎模型,结果显示造模1周内大鼠关节明显肿胀,且持续加重至第24天,经病理学检查提示滑膜炎[3]。为此,本实验采用风、寒、湿环境因素联合木瓜蛋白酶+半胱氨酸蛋白酶的方式制备风湿性膝关节滑膜炎大鼠模型。
在风湿性滑膜炎中,因炎症反应的发生而刺激膝关节滑膜组织,使得分泌液异常,导致滑膜细胞异常增生,出现大量滑液,而滑液中含IL-1、IL-6、TNF-α等多种炎症细胞因子和血浆、吞噬细胞、白细胞等,大量分布于外周血和关节腔中[4-5]。另外,滑膜细胞的异常增生、骨破坏、类肿瘤样生长等与炎性细胞因子及其炎症信号通路转导有关。作为一种具有多种生物活性的促炎因子,TNF-α是诱导炎症反应发生的主要细胞因子,可促使炎症细胞活化,诱导黏附分子和趋化因子的分泌[6]。在风湿性滑膜炎发生和发展的病理过程中,TNF-α作为一种重要的炎性反应因子起到重要的作用。IL-1、IL-6及TNF-α均是参与膝关节退变的主要炎症介质,其中IL-1与TNF-α均可作用于成纤维细胞和软骨细胞,导致关节软骨损伤[7];而IL-6既可诱导B细胞和T细胞增殖及活化,亦可有效调节急性期C反应蛋白的表达,从而诱导各种炎症介质的产生[8]。此外,IL-1与IL-6等炎症细胞因子可通过相互作用,形成恶性循环,造成关节损伤进一步加重。IL-1β与TNF-α等促炎细胞因子是引起类风湿性关节炎滑膜炎的“中心罪犯”,可通过协同诱导该病血管翳增生,导致滑膜后期骨破坏的发生[9]。国内研究指出,IL-1、IL-6、TNF-α在膝关节类风湿性滑膜炎患者血清中的水平均明显升高,控制机体炎症状态,通过检测外周血IL-1、IL-6、TNF-α含量可作为评价风湿性滑膜炎患者炎症状态和治疗效果的重要指标[10]。C反应蛋白在健康人群血清中的浓度较低,但在机体出现创伤、急性炎性反应等情况时的水平明显升高[11-12]。MMP-9是MMPs家族的主要成员之一,其在降解关节软骨中起到重要作用,可与基质金属蛋白抑制物相互平衡而维持软骨结构的完整性。但在膝关节滑膜炎等病理情况下,MMP-9可导致软骨基质损伤,使得软骨组织胶原暴露,胶原形成的网状结构受破坏,导致软骨损伤[13-14]。阿达木单抗是一种靶向TNF-α的全人源重组单克隆抗体,具有高亲和力,可特异性地结合TNF-α,抑制其与细胞表面TNF-α受体结合,降低TNF-α水平,可起到拮抗TNF-α生物活性的作用[15]。本研究发现,相比对照组,模型组和干预组血清TNF-α、IL-1β、IL-6、MMP-9及C反应蛋白均明显升高,且干预组血清TNF-α、IL-1β、IL-6、MMP-9及C反应蛋白较模型组均明显降低。结果表明,采用TNF-α抑制剂(阿达木单抗)干预可有效减轻风湿性膝关节滑膜炎大鼠炎症状态,从而可减轻膝关节损伤。
机体氧化应激的发生可促使中性粒细胞炎性浸润,进而大量生成活性氧簇和活性氮簇自由基,而大量自由基可导致机体内多种分子的氧化损伤、硝化损伤,这与风湿性滑膜炎等多种炎症性疾病的发生存在密切关系[16]。本实验显示,模型组和干预组血清丙二醛含量较对照组均明显升高,谷胱甘肽和SOD的水平较对照组均明显降低;相比模型组,干预组血清丙二醛的水平显著降低,谷胱甘肽和SOD含量均明显升高。结果表明,采用TNF-α抑制剂干预具有抑制风湿性膝关节滑膜炎大鼠氧化应激反应的效果,减轻大鼠机体应激损伤,提示TNF-α抑制剂具有抗氧化应激的作用。结果表明,采用TNF-α抑制剂可有效抑制风湿性膝关节滑膜炎大鼠氧化应激,减轻大鼠氧化应激损伤,其原因可能因TNF-α抑制剂具有清除羟自由基和氧自由基作用,促使TNF-α和丙二醛含量减少,GSH-Px和SOD活性提高,阻滞IL-1β过度分泌,因而具有抗氧化损伤的功能。
TACE具有调控内毒素诱导下TNF-α酶解的作用,可作为炎症性疾病的一种潜在治疗靶点。作为一种参与多种炎症的信号转导因子,NF-κB在促进细胞增殖、细胞凋亡、刺激炎症因子的生成、细胞外基质交联等方面发挥着重要的作用[17]。并且,NF-κB是核内炎性转录因子家族重要成员之一,具有调控TNF-α表达的作用,可调节凋亡信号和炎症反应。TNF-α刺激滑膜细胞后,NF-κB在胞质中的表达下调,在细胞核中的表达上调,TNF-α可促使NF-κB信号通路活化,而使之发挥调节炎症反应过程中多种细胞黏附因子和促炎因子表达的作用[18]。本实验经Western blot法检测可知,模型组、干预组大鼠膝关节滑膜组织TACE和NF-κB蛋白表达水平较对照组均明显上调,干预组TACE和NF-κB蛋白表达较模型组均明显下调。结果表明,采用TNF-α抑制剂干预可有效下调风湿性膝关节滑膜炎大鼠TACE和NF-κB蛋白表达水平,抑制其过度表达,降低NF-κB活性,从而可有效阻滞TACE/NF-κB信号通路异常活化,抑制下游IL-1β、IL-6等多种炎症因子的释放,减轻炎症程度,由此推测这可能是TNF-α抑制剂改善大鼠风湿性膝关节滑膜炎的一种作用机制。
综上所述,采用TNF-α抑制剂可有效减轻风湿性膝关节滑膜炎大鼠氧化应激和炎症状态,缓解膝关节损伤程度,下调TACE和NF-κB蛋白表达,其作用机制可能与TNF-α抑制剂可通过阻滞TACE/NF-κB信号通路而发挥减轻大鼠风湿性膝关节滑膜炎的作用密切相关。但本实验尚处于初步研究阶段,且有关TNF-α抑制剂对风湿性膝关节滑膜炎的具体作用机制目前尚未完全明确,且动物模型与人体内环境存在明显不同,因此今后需进一步分析以深入探究。
