控制桃果实采后病害拮抗酵母的筛选及其固体制剂的制备
2020-07-23张晓云闫雪莉顾香玉赵利娜张世涛张红印
张晓云,闫雪莉,吴 锋,顾香玉,赵利娜,张世涛,张红印,*
(1.江苏大学食品与生物工程学院,江苏 镇江 212013;2.江苏科技大学粮食学院,江苏 镇江 212004;3.江苏益群农业科技有限公司,江苏 新沂 221400)
桃甜美多汁、营养价值高,但在贮藏和运输过程中极易受到病原菌侵染而发生病害。由匍枝根霉(Rhizopus stolonifer)引起的软腐病是桃果实采后主要病害之一,发病的果实会丧失可食用性,造成巨大的经济损失[1]。因此必须采取有效的措施控制桃果实采后病害。传统的物理控制法存在对设备要求较高、影响果蔬品质等缺点,而化学控制法易引起病原菌抗性、残留的化学杀菌剂对消费者健康造成危害等[2-3]。近年来,利用拮抗微生物控制果蔬采后病害逐渐成为研究的热点,并有望成为替代化学杀菌剂的新方法[4-5]。其中拮抗酵母因其自身诸多优点而受到广泛的关注[6]。因此利用拮抗酵母控制桃果实采后病害具有广阔的应用前景。
拮抗酵母制剂化是其实际应用的前提和基础。但目前,我国无商品化的拮抗酵母制剂,国际上也只有少数几种拮抗酵母制剂产品上市。虽然拮抗酵母液体制剂的制备相对简单,但其运输和保存较为困难,因此制备拮抗酵母的固体制剂对其应用尤为重要。喷雾干燥法是一种将溶液、乳液或悬浮液快速干燥成固态产品的方法,具有干燥速率快、时间短(一般为15~40 s)、工艺简单和可连续化生产等优点[7-8]。与其他干燥方式如低温冷冻干燥法相比,喷雾干燥法具有更高的干燥效率和更快的干燥速率,干燥的产品脱水彻底、质量轻、便于运输和贮藏,且低温冷冻干燥费用比喷雾干燥高6~10 倍[9]。喷雾干燥过程中,可以利用保护剂包覆活性微生物(如酵母菌、乳酸菌等),使微生物本体与外界环境隔离,增强其抵抗氧、热等不良刺激的能力,从而提高微生物的存活率[10],所制备的固体制剂一般能在低温或常温条件下保存较长时间[11]。
本研究从实验室分离保存的4 株酵母菌中筛选对桃果实采后软腐病具有控制作用的拮抗酵母菌,进一步考察拮抗酵母对桃果实自然腐烂的控制效果及其对桃果实品质的影响;然后通过单因素试验考察喷雾干燥过程中所用保护剂种类、阿拉伯胶和海藻糖比、保护剂质量浓度、雾化压强、进风温度和进料速率对固体制剂中拮抗酵母活菌数的影响,从而优化喷雾干燥的条件,并测定所制备的固体制剂在25 ℃和4 ℃保存过程中拮抗酵母的存活率以及保存90 d的固体制剂对桃果实采后软腐病的控制效果,为制备可用于控制桃果实采后病害的拮抗酵母制剂提供参考,对加快拮抗酵母的实际应用进程具有促进作用。
1 材料与方法
1.1 材料与试剂
实验所用白凤水蜜桃(Prunus persica (L.) Batsch cv.Baifeng)采摘于江苏省镇江市有机果园中桃树向阳部位,挑选外观良好、大小均一、无器械损伤、果实表面粉红色、八成熟的桃果实作为实验材料。果实用清水冲洗后,以体积分数0.2%次氯酸钠溶液浸泡2 min,再次冲洗,自然晾干后备用。
阿拉伯胶、麦芽糊精、β-环糊精均为分析纯;海藻糖、酪蛋白酸钠、脱脂乳粉均为食品级。
NYDA培养基:酵母浸膏5 g,牛肉浸膏8 g,葡萄糖10 g,琼脂15 g,溶于1 000 mL水;NYDB培养基:NYDA培养基不加琼脂;PDA培养基:称取切碎的马铃薯200 g于适量水中煮沸20 min,8 层纱布过滤,滤液加入20 g葡萄糖和20 g琼脂粉,加水至1 000 mL。
1.2 仪器与设备
LRH-250生化培养箱 上海一恒科技有限公司;大型喷雾干燥机 常州市鲁腾公司;恒流蠕动泵 常州维西尔公司;5810R多功能台式离心机 艾本德中国有限公司;生物显微镜 麦克奥迪公司;HYL-C3组合式摇床 太仓市强乐实验设备厂。
1.3 方法
1.3.1 酵母悬浮液的制备
1.3.1.1 新鲜酵母悬浮液
实验室分离的酵母菌Pichia occidentalis、Debaryomyces hansenii、P. anomala、P. membranaefaciens于NYDA培养基上28 ℃培养2 d。分别挑取2 环于装有50 mL NYDB培养基的三角瓶(250 mL)中,28 ℃、180 r/min振荡培养20 h;培养液于8 000 r/min离心15 min,弃上清液。沉淀以无菌生理盐水洗涤2 次并重悬,用血球计数板计数并调至浓度为1×108cells/mL备用。
1.3.1.2 固体制剂悬浮液
称取适量经喷雾干燥获得的固体制剂,于50 mL 0.85%生理盐水中,28 ℃、180 r/min振荡至均匀悬浮,血球板计数并调整酵母浓度至1×108cells/mL。
1.3.2 病原菌孢子悬浮液的制备
R. stolonifer分离于自然腐烂的桃果实,接种至PDA培养基上,25 ℃培养5~7 d后,挑取适量孢子于10 mL离心管中,振荡混匀,用血球计数板计数并调整浓度至5×104spores/mL。
1.3.3 酵母菌对桃果实采后软腐病的抑制
用无菌打孔器在桃果实腰部等距离刺出3 个伤口(5 mm深、3 mm宽),每个伤口加入30 µL新鲜酵母悬浮液,以等体积的无菌生理盐水作为对照。2 h后在伤口处加入30 µLR. stolonifer孢子悬浮液,待桃果实放置2 h后摆放至己消毒的塑料筐(47 cm×35 cm×12 cm)内,保鲜膜密封,贮藏于恒温恒湿培养箱内(20 ℃、相对湿度95%),分别于第60小时和第72小时记录果实腐烂直径和发病果实数目,并计算果实腐烂率。每个处理包含12 个果实,3 次重复。腐烂率的计算式如下:

1.3.4 酵母菌对桃果实采后品质影响及自然腐烂抑制
采摘的桃果实当天运回实验室,对果实逐一喷洒新鲜P. membranaefaciens悬浮液,以覆盖整个果实表面为标准,对照组(CK)喷洒相同体积的无菌生理盐水。喷洒后的果实置于消毒塑料筐内,室温放置2 h,然后转移至恒温恒湿培养箱内(20 ℃、相对湿度95%),贮藏8 d后,计算桃果实的自然腐烂率及测定品质相关指标。每个处理3 个平行,每个平行12 个桃果实,实验重复2 次。
桃果实品质相关指标测定方法如下:硬度参考邵秀芝等[12]的方法,采用TA-XT质构分析仪对桃果实果实的硬度进行测定;可溶性固形物采用手持式糖度计进行测定[13];可滴定酸度采用酸碱滴定法[14],测定结果以酒石酸百分比表示,每个处理重复4 次;VC含量采用氢氧化钠滴定法[14],每个处理重复4 次。
桃果实质量损失率和自然腐烂率按式(2)、(3)计算:

1.3.5P. membranaefaciens固体制剂的制备
1.3.5.1 喷雾干燥流程
将离心收集的菌体与保护剂溶液混合,使菌体质量浓度达到50 g/L,28 ℃、180 r/min振荡混匀45 min。设置喷雾干燥机参数,待出风温度达到80 ℃时,打开空气压缩机,调整蠕动泵进料速率后开始进行喷雾干燥,结束后测定所得固体制剂中酵母活菌数并换算成对数值。进料前及结束后分别用适量无菌水进样,以冲洗干燥机内残渣。
1.3.5.2 保护剂的筛选
根据表1,分别称取一定量的阿拉伯胶、脱脂乳粉和酪蛋白酸钠于装有适量0.85%生理盐水的三角瓶中,50 ℃水浴搅拌至完全溶解,再等比例加入其他保护剂,制备总质量浓度为100 g/L的保护剂溶液。然后按照1.3.5.1节方法进行喷雾干燥,以每克干粉中活菌数的对数值作为指标选取合适的保护剂。

表1 保护剂种类的筛选Table 1 Screening of protectants
1.3.5.3 阿拉伯胶与海藻糖比对固体制剂中活菌数的影响
按照1.3.5.2节的方法,分别制备阿拉伯胶与海藻糖质量比为3∶1、2∶1、1∶1、1∶2和1∶3的保护剂溶液。在雾化器压强200 kPa、进风温度120 ℃、进料速率20 mL/min条件下,按1.3.5.1节方法进行喷雾干燥。
1.3.5.4 保护剂质量浓度对固体制剂中活菌数的影响
按1.3.5.2节的方法分别制备总质量浓度为60、80、100、120、140 g/L的阿拉伯胶与海藻糖(1∶1)溶液。在雾化器压强200 kPa、进风温度120 ℃、进料速率20 mL/min条件下,按1.3.5.1节方法进行喷雾干燥。
1.3.5.5 雾化器压强对固体制剂中活菌数的影响
按1.3.5.2节的方法制备总质量浓度为100 g/L的阿拉伯胶与海藻糖(1∶1)溶液,设置喷雾干燥机雾化器压强分别为100、150、200、250、300 kPa,进风温度为120 ℃、进料速率为20 mL/min,按照1.3.5.1节方法进行喷雾干燥。
1.3.5.6 进风温度对固体制剂中活菌数的影响
按1.3.5.2节的方法制备总质量浓度为100 g/L的阿拉伯胶与海藻糖(1∶1)溶液,设置喷雾干燥机进风温度分别为90、100、110、120、130 ℃,雾化器压强为200 kPa,进料速率为20 mL/min,按1.3.5.1节方法进行喷雾干燥。
1.3.5.7 进料速率对固体制剂中活菌数的影响
按1.3.5.2节的方法制备总质量浓度为100 g/L的阿拉伯胶与海藻糖(1∶1)溶液,将蠕动泵进料速率分别设置为10、15、20、25、30 mL/min,进风温度为100 ℃、雾化器压强为200 kPa,按1.3.5.1节方法进行喷雾干燥。
1.3.6 固体制剂相关指标的测定
1.3.6.1 活菌数的测定
准确称取1 g喷雾干燥获得的固体制剂,溶于50 mL无菌0.85%生理盐水中,28 ℃、180 r/min振荡至均匀悬浮,梯度稀释后,分别吸取各梯度稀释液100 μL均匀涂布于NYDA培养基上,28 ℃培养2 d,计数活菌数并换算成lg(CFU/g)固体制剂。
1.3.6.2 水分含量的测定
称取3 g左右喷雾干燥获得的固体制剂于干燥至质量恒定的铝制称量盘中,在105 ℃烘箱内干燥至质量恒定(前后2 次称质量误差小于2 mg)后立即转移至干燥器内,待温度降至室温后称质量[13]。每个处理3 次平行,实验重复2 次。水分含量按下式计算:

式中:ma为空称量盘质量/g;mb为干燥前称量盘和干粉的总质量/g;mc为干燥后称量盘和干粉的总质量/g。
1.3.6.3 保存期间酵母菌存活率的测定
固体制剂置于无菌、干燥的50 mL离心管中,分别于25 ℃和4 ℃条件下密封保存。每30 d取样测定活菌数,计算固体制剂中的酵母存活率。每个处理3 次平行,实验重复2 次。酵母菌存活率按下式计算:

式中:C1为保存一定时间的单位固体制剂的活菌数/CFU;C2为保存前单位固体制剂的初始活菌数/CFU。
1.3.7 固体制剂对桃果实软腐病的控制效果
按1.3.3节处理桃果实,伤口处分别接种30 μL新鲜制备的酵母悬浮液、于25 ℃以及4 ℃条件下保存90 d的固体制剂悬浮液,并以等体积的无菌生理盐水和保护剂溶液代替拮抗酵母悬浮液分别作为阴性(CK)和阳性对照,其他操作同1.3.3节。3 d后统计腐烂率。
1.4 数据处理
采用SPSS软件对数据进行分析和处理。实验数据不低于3 个时,采用ANOVA进行方差分析,Duncan多重比较进行差异分析,P<0.05,差异显著。
2 结果与分析
2.1 拮抗酵母的筛选
拮抗酵母对水果采后病害的控制效果与其在水果上与病原菌竞争空间和营养的能力、对病原菌上的直接寄生作用、对宿主抗病性的诱导能力等相关[15],因此不同拮抗酵母对果蔬水果采后病害的控制效果不同。秦国政等[16]利用P. membranaefaciensHansen控制“绿化3号”桃果实软腐病,在桃果实伤口处接种酵母菌悬浮液4 h后,再接种较低量R. stolonifer孢子悬浮液(15 μL,5×104spores/mL),72 h后桃果实腐烂率近20%,显著低于对照(约为60%)。而林丽等[17]在“大久保”桃果实伤口处接种Cryptococcus laurentii悬浮液4 h后,再接种低量R. stolonifer孢子悬浮液(20 μL,1×104spores/mL),7 d后桃果实腐烂率(23.3%)显著低于对照(93.3%)。本实验中,将4 株酵母菌接种在白凤水蜜桃伤口处2 h后,再接种较高量R. stolonifer孢子悬浮液(30 μL,5×104spores/mL),桃果实的腐烂率和腐烂直径如图1、2所示。由图1可知,60 h后,P. occidentalis和D. hansenii处理的桃果实腐烂率与对照组(71.31%)没有显著性差异(P>0.05),而P. anomala和P. membranaefaciens处理的桃果实腐烂率显著低于对照组,尤其是P. membranaefaciens处理的桃果实腐烂率仅为20.10%。72 h后,4 株酵母菌处理的桃果实腐烂率均显著低于对照组(95.70%),其中P. membranaefaciens处理的桃果实腐烂率仍然最低(26.23%)。从图2可以看出,4 株酵母菌处理对桃果实腐烂直径的影响结果与腐烂率相似。因此,后续以菌株P. membranaefaciens作为研究对象,开展进一步的研究。

图1 4 株酵母菌对桃果实软腐病腐烂率的影响Fig. 1 Effect of four yeast strains on the decay incidence of peaches caused by Rhizopus rot

图2 4 株酵母菌对桃果实软腐病腐烂直径的影响Fig. 2 Effect of four yeast strains on the lesion diameter of peaches caused by Rhizopus rot
2.2 新鲜P. membranaefaciens悬浮液对桃果实采后自然腐烂及贮藏品质的影响
由表2可以看出,在20 ℃条件下贮藏8 d,相比于对照组,酵母处理的桃果实自然腐烂率显著降低(P<0.05),且品质相关指标(如质量损失率、硬度和可溶性固形物等)与对照组相比均无显著性差异(P>0.05)。该结果表明,P. membranaefaciens能显著抑制采后桃果实的自然腐烂,并对桃果实的品质无显著不良影响。

表2 新鲜P. membranaefaciens悬浮液对桃果实采后自然腐烂率和品质指标的影响Table 2 Effects of fresh P. membranaefaciens suspension on natural decay incidence and quality indicators of peach fruit
2.3 P. membranaefaciens固体制剂的制备
2.3.1 保护剂的筛选
喷雾干燥过程中,选择适当的保护剂可降低喷雾干燥对菌体的损害,提高酵母菌存活率[18]。如图3所示,在第1组实验中,阿拉伯胶单独作为保护剂,制剂中P. membranaefaciens活菌数显著低于其与β-环糊精、麦芽糊精、海藻糖作为复合保护剂时的活菌数。其中阿拉伯胶与海藻糖作为复合保护剂时活菌数最高,为8.1(lg(CFU/g))。第2组和第3组实验结果与第1组类似,组内活菌数最高的保护剂分别是脱脂乳粉与海藻糖、酪蛋白酸钠与海藻糖。可见加入海藻糖作为保护剂对提高固体制剂中P. membranaefaciens活菌数具有显著作用,这可能与海藻糖能和微生物细胞膜组分形成氢键,取代水的位置,从而提高细胞膜的稳定性有关[19]。3 组实验中,阿拉伯胶与海藻糖作为复合保护剂时,制剂中酵母菌活菌数最高。因此,后续实验选择阿拉伯胶和海藻糖作为复合保护剂。

图3 保护剂种类对固体制剂中酵母活菌数的影响Fig. 3 Effect of protectants on the number of viable cells in solid preparation
2.3.2 阿拉伯胶与海藻糖质量比对固体制剂酵母活菌数的影响
在喷雾干燥时,不同保护剂的配比对微生物的抗逆性也有一定的影响[20-22],因此考察阿拉伯胶与海藻糖质量比对固体制剂中P. membranaefaciens活菌数的影响至关重要。由图4可知,随着海藻糖所占比例的增加,固体制剂活菌数先升高后降低,当阿拉伯胶与海藻糖质量比为1∶1时活菌数最高,为8.07(lg(CFU/g))。因此后续实验选择阿拉伯胶与海藻糖质量比为1∶1作为复合保护剂。
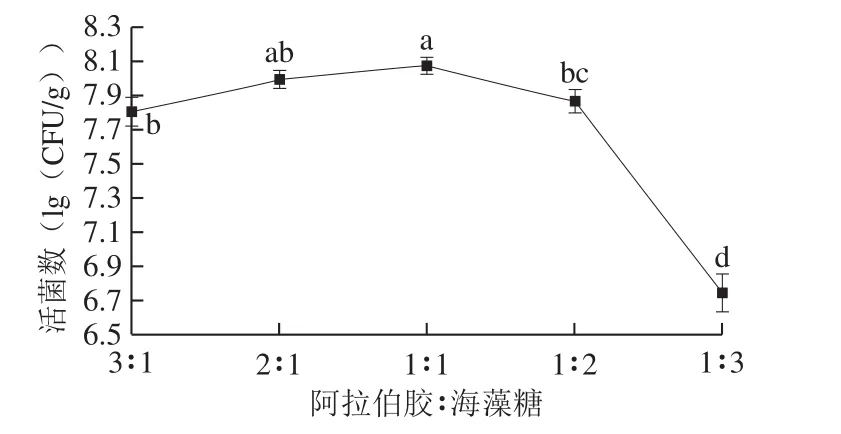
图4 阿拉伯胶与海藻糖质量比对固体制剂酵母活菌数的影响Fig. 4 Effect of ratio between gum Arabic and trehalose on the number of viable cells in solid preparation
2.3.3 保护剂质量浓度对固体制剂酵母活菌数的影响
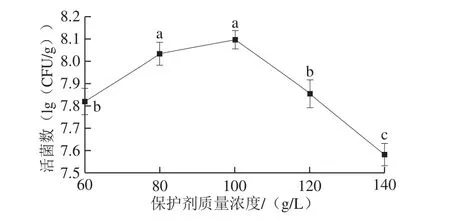
图5 保护剂质量浓度对固体制剂酵母活菌数的影响Fig. 5 Effect of protectant concentration on the number of viable cells in solid preparation
由图5可知,固体制剂中P. membranaefaciens活菌数随着保护剂质量浓度的增加而呈现先升高后降低的趋势,保护剂质量浓度为100 g/L时,活菌数最高。在喷雾干燥过程中,当保护剂质量浓度过低时,对酵母菌保护作用减弱,菌体暴露在高温下导致其死亡;而当保护剂质量浓度过高时,形成的颗粒直径增加,为了达到干燥目的,则需延长干燥时间,造成菌体暴露在高温下的时间延长,从而导致固体制剂中活菌数迅速降低[23-24]。因此后续实验选择保护剂质量浓度为100 g/L。
2.3.4 雾化压强对固体制剂酵母活菌数的影响

图6 雾化压强对固体制剂酵母活菌数的影响Fig. 6 Effect of atomization pressure on the number of viable cells in solid preparation
如图6所示,随着雾化压强的增大,固体制剂中P. membranaefaciens活菌数先升高后降低,当雾化压强为200 kPa时,活菌数最高,为8.08(lg(CFU/g))。在喷雾干燥过程中,增大雾化压强可以减小液滴大小,提高雾化效果。但雾化压强过高时,菌体由喷嘴喷出时受到的剪切力增大,导致菌体损伤甚至死亡[25-26]。因此后续实验选择雾化压强为200 kPa。
2.3.5 进风温度对固体制剂酵母活菌数的影响
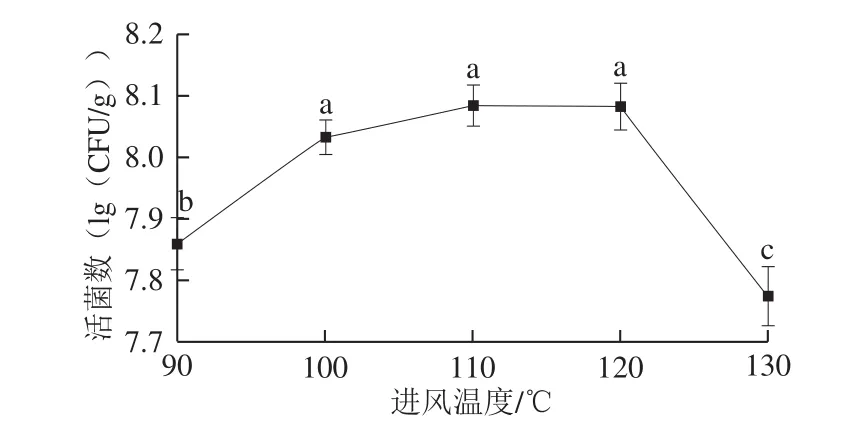
图7 进风温度对固体制剂酵母活菌数的影响Fig. 7 Effect of inlet temperature on the number of viable cells in solid preparation
进风温度是影响喷雾干燥效果的主要因素之一[27-29]。由图7可知,随着进风温度的升高,固体制剂中P. membranaefaciens活菌数呈上升趋势,在110 ℃达到最大值,但与100 ℃无显著性差异。继续升高进风温度至120 ℃,活菌数维持不变。在喷雾干燥过程中,随着进风温度的升高,酵母菌表面的水分蒸发加快,干燥时间缩短,单位质量制剂中酵母活菌数增加。但是,酵母菌作为一种热敏性微生物,虽然保护剂对菌体起到一定的保护作用,但过高的温度也会导致菌体在喷雾干燥过程中大量死亡[27]。因此,当进风温度超过120 ℃后,制剂中活菌数迅速降低。综合考虑温度对酵母菌活性的影响和能耗等因素,最终选择100 ℃作为后续实验的进风温度。
2.3.6 进料速率对固体制剂酵母活菌数的影响

图8 进料速率对干粉中活菌数的影响Fig. 8 Effect of feeding rate on the number of viable cells in solid preparation
如图8所示,随着进料速率的提高,活菌数呈现先上升后下降的趋势,当进料速率为15 mL/min时,固体制剂中P. membranaefaciens活菌数最高,为8.35(lg(CFU/g))。进料速率较低时,单位物料承受的热量增加,导致菌体因受热过多而出现部分死亡,在进料速率达到15 mL/min时,进料速率与其他影响因素的相互作用达到平衡,制剂中活菌数达到最大。随着进料速率的进一步增加,单位时间内雾化的小液滴增多,物料表面水分蒸发量减少,最终导致固体制剂中含水量增加,因而单位质量固体制剂中酵母活菌数降低[18,30]。因此后续实验选择进料速率为15 mL/min。
2.4 固体制剂的水分含量及保存期间酵母菌的存活率
在单因素试验优化的条件下(阿拉伯胶与海藻糖质量比1∶1、壁材质量浓度100 g/L、雾化器压强200 kPa、进风温度100 ℃、进料速率15 mL/min)进行喷雾干燥,获得的固体制剂活菌数为2.25×108CFU/g;水分质量分数为4.78%,达到GB 20287—2006《农用微生物菌剂标准》对农用微生物菌剂水分含量的要求。从图9可以看出,固体制剂中P. membranaefaciens存活率均随着保存时间的延长而缓慢降低,保存90 d后,P. membranaefaciens的存活率分别为66.97%(25 ℃)和82.91%(4 ℃),表明该固体制剂于4 ℃保存效果明显优于25 ℃。
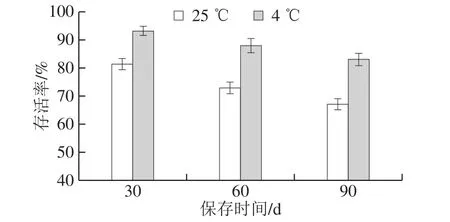
图9 固体制剂在25 ℃和4 ℃保存时酵母菌的存活率Fig. 9 Survival rate of yeast in solid preparation preserved at 25 or 4 ℃
2.5 固体制剂对桃果实软腐病的控制作用
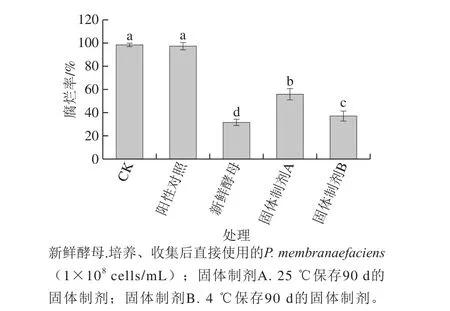
图10 25 ℃和4 ℃保存90 d的固体制剂的生防效果Fig. 10 Biocontrol effect of solid preparation stored at 25 or 4 ℃ for 90 days
由图10可以看出,CK组(阴性对照)和阳性对照组的腐烂率无显著性差异(P>0.05)。新鲜酵母、25 ℃和4 ℃保存90 d的固体制剂对桃果实软腐病均有显著的控制效果。4 ℃保存90 d的固体制剂的控制效果(发病率37.04%)与新鲜制备的酵母(腐烂率31.48%)虽有显著性差异(P<0.05),但控制效果仍然非常明显。因此该固体制剂于4 ℃保存90 d后,仍然具有良好的防治效力,具备商业化开发和实际应用的价值。
3 结 论
本实验筛选到1 株对桃果实采后软腐病具有良好防治效力的拮抗酵母P. membranaefaciens。该拮抗酵母处理的桃果实贮藏72 h后,软腐病引起的腐烂率(26.23%)显著低于对照(95.70%),还可以显著降低桃果实采后自然腐烂率,且对桃果实品质无显著不良影响。因此,该拮抗酵母应用于桃果实采后病害的控制,可减少化学农药的使用,对保障食品安全和环境保护具有重要意义,具有良好的应用前景。单因素试验优化的喷雾干燥法制备该拮抗酵母固体制剂的条件为:保护剂阿拉伯胶与海藻糖的质量比1∶1、保护剂质量浓度100 g/L、雾化器压强200 kPa、进风温度100 ℃、进料速率15 mL/min。制备的P. membranaefaciens固体制剂在25 ℃和4 ℃保藏90 d后,酵母存活率分别为66.97%和82.91%。4 ℃保存90 d的固体制剂处理的桃果实采后软腐病发病率(37.04%)与新鲜制备的拮抗酵母处理的桃果实发病率(31.48%)虽有显著性差异,但控制效果仍然非常明显。该拮抗酵母喷雾干燥固体制剂制备技术的建立,可加速拮抗酵母在桃果实采后病害控制中实际应用的进程,促进拮抗酵母生防制剂的产业化。
