辣根过氧化物酶催化阿魏酸交联果胶物化特性
2020-07-23刘延照刘功继严守雷
刘延照,李 想,刘功继,李 洁,2,严守雷,2,*
(1.华中农业大学食品科学技术学院,湖北 武汉 430070;2.湖北省水生蔬菜保鲜加工工程技术研究中心,湖北 武汉 430070)
阿魏酸是一种羟基肉桂酸,属于酚酸类物质。阿魏酸在植物细胞壁中广泛存在,是细胞壁的重要结构成分[1]。按结构分为顺式和反式2 种,植物细胞壁中绝大多数为反式阿魏酸,呈纤维状结晶;顺式阿魏酸为黄色油状物,自然界中含量较少[2]。阿魏酸具有多种生理功能,如抗炎、抗病毒、抗辐射、抗细胞凋亡、抗癌等,具有很好的生理保健作用[3]。阿魏酸在食品工业中有多种应用,可作为天然食品防腐剂,抑制脂肪酸的过氧化[4],抑制微生物的生长[5]。此外,富含阿魏酸的多糖在过氧化物酶和过氧化氢存在下会发生凝胶化,利用这一性质可以使多糖凝胶化制备食品胶[6-7]。
果胶的分子结构较为复杂,由多个结构域组成,其中最丰富的结构域是同型半乳糖醛酸聚糖(homogalacturonan,HG)和鼠李糖半乳糖醛酸(rhamnogalacturonan,RG)[8]。HG是一条由α-1,4键连接的线性半乳糖醛酸链,植物中的HG在C-3位可以被甲基化,在O-2或O-3位可被乙酰化[9]。RG-I型果胶的主链由(1→2)-α-L-Rha-(1→4)-D-GalA重复组成,主链一部分的鼠李糖残基被中性和酸性低聚糖取代,侧链的组成主要为阿拉伯糖和半乳糖[10],RG-I上的半乳糖醛酸可乙酰基化,却不可能存在甲基化[11]。RG-II的主链是HG,其侧链包含4 个不同的低聚物侧链。
研究表明,阿魏酸在酶催化条件下,能与果胶、淀粉、壳聚糖等分子发生交联反应,可以有效提高果胶的乳化性和抗氧化性[12],提高淀粉溶胀力[13],改善壳聚糖的结构和缓释性能[14]。有研究表明在甜菜细胞壁中发现阿魏酸残基酯可以与果胶的阿拉伯糖和半乳糖侧链相连[15],这种联系可能是通过阿拉伯糖链α-1,5-阿拉伯糖单元的O-2和半乳糖链β-1,4-半乳糖单元的O-6发生[16],其中阿魏酸酯可能由于细胞壁中的氧化反应而形成脱氢二聚体[15]。在Oosterveld等[17]的研究中,过氧化氢和过氧化物酶被应用于甜菜果胶的氧化交联后,观察到阿魏酸单体量的减少和脱氢二亚硫酸盐的增加,Ishii[18]发现RG-I的阿拉伯聚糖支链可通过阿魏酸的氧化反应形成交联。由于天然的甜菜果胶中大约含有50%~60%的阿魏酸[19],因此很多研究将甜菜果胶作为研究对象,利用虫漆酶或辣根过氧化物酶等对其改性,可有效促进果胶的凝胶化[20],增大果胶分子质量并增强了乳液稳定性[21-22],提高了果胶茹度等性质[23],但在白萝卜中鲜见类似报道,通过实验室前期研究发现[24],阿魏酸处理白萝卜会对其细胞壁中的果胶产生影响。因此本实验将白萝卜中的果胶提取出来,用阿魏酸和辣根过氧化物酶对果胶进行改性处理,并对相关性质进行测定,为改善果胶的功能性质、确定阿魏酸处理影响果胶性质的机理提供理论依据。
1 材料与方法
1.1 材料与试剂
白萝卜购于武汉市华中农业大学农贸市场,品种为长羽裂萝卜,经过冷冻干燥后用于果胶的提取和相关性质的测定。
阿魏酸(反式)、辣根过氧化物酶(标定酶活力为300 U/mg) 上海源叶生物科技有限公司;乙醇、甲醇、盐酸、磷酸氢二钠、磷酸二氢钠、VC(均为分析纯)国药集团化学试剂有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、透析袋(3 500 Da) 美国Sigma公司。
1.2 仪器与设备
UitraScan XE色度测定仪 美国Hunterlab公司;Nexus 470傅里叶变换红外光谱仪 美国梅特勒-托利多公司;UV-1750紫外-可见分光光度计 日本岛津公司;DHR2流变仪 美国沃特斯公司;LGJ-30F真空冷冻干燥机 北京松原华兴科技发展有限公司;HH-2恒温水浴锅 江苏金坛市荣华仪器制造有限公司;BSA124S分析天平 德国赛多利斯集团;R-210旋转蒸发仪 瑞士Büchi公司;GM-0.22A隔膜真空泵 中国津腾公司;SU-8010扫描电镜 日本株式会社日立制作所;Sorvall ST16R高速离心机 美国Thermo公司。
1.3 方法
1.3.1 白萝卜果胶的提取与改性
1.3.1.1 白萝卜果胶的提取
参考彭小燕等[25]的提取方法,略有改动。取烘干的白萝卜醇不溶组分粉末10 g,加入pH 2的盐酸250 mL,70 ℃加热2 h,并抽滤取滤液。滤渣再加入200 mL盐酸溶液,70 ℃加热提取2 h,抽滤取滤液。合并2 次滤液,用3 500 Da透析袋透析24 h,并将样品溶液旋转蒸发,加入95%乙醇溶液沉淀果胶,抽滤,冻干得到白萝卜果胶。
1.3.1.2 白萝卜果胶的改性
参考Zaidel等[20]的方法,略有改动。将冻干的白萝卜果胶溶解到pH 6.5的磷酸盐缓冲液中,然后加入0.5 mmol/L的阿魏酸1 mL和0.5 mL过氧化物酶(15 U/mL含少量H2O2),对照组加入等量的蒸馏水。将2 组样品放入45 ℃水浴锅中反应30 min,将处理好的样品冷冻干燥,并放入-20 ℃冰箱保存。
1.3.2 果胶色度的测定
将改性和未改性的果胶配制成1%的果胶溶液,分别用UitraScan XE型色度仪测定其颜色差异。通过L*、a*、b*值可以表征改性果胶和未改性果胶之间的颜色差异。L*代表白度,其值越大,表明样品颜色越白;a*值代表红绿,若a*值为正值且越大,表明样品颜色越红,若a*值为负值且越小,表明样品颜色越绿;b*值代表黄蓝,值越大则颜色越偏向黄色,反之b*值越小则越偏向蓝色。
1.3.3 流变学的测定
1.3.3.1 茹度的测定
参考Karaki等[26]的方法,略有改动。将改性和未改性的果胶分别用pH 6.5的缓冲液配制成6%的果胶溶液(预实验确定),用直径为60 mm的平板,25 ℃条件下进行测量,剪切速率从0.001~100 s-1变化。
1.3.3.2 动态流变学测定
动态流变学特性用储能模量G’和损耗模量G”表征,用直径为60 mm的平板,在25 ℃条件下进行测量,应变扫描频率0.1~100 Hz,压力0.1 Pa。
1.3.4 抗氧化性的测定
参考王杰等[27]的方法。提取液制备:分别取改性果胶、未改性果胶和VC各375 mg,定容至50 mL,分别取其中1、2、3、4、5 mL用蒸馏水定容至25 mL,即得质量浓度分别为0.15、0.30、0.45、0.60、0.75 mg/mL的溶液。
DPPH试剂配制:精确称取0.026 2 g的DPPH,用无水甲醇进行溶解并定容至50 mL,摇匀,作为储备液保存于冰箱中,测定时用无水甲醇将其稀释10 倍。
抗氧化活性测定:准确移取4 mL样品于试管中,加入4 mL的DPPH溶液,充分摇匀,暗置30 min,在波长517 nm处测定其吸光度A1;同时测定样品待测液4 mL与50%甲醇溶液4 mL混合液在波长517 nm处吸光度A2;DPPH溶液4 mL与50%甲醇溶液4 mL在波长517 nm处测定吸光度A3(空白)。每种样品测3 个平行,取平均值,DPPH自由基清除率按下式计算:

1.3.5 紫外波长全扫描
将改性果胶和未改性果胶分别配制成质量浓度为0.005 g/mL的果胶溶液,用紫外分光光度计在200~600 nm波长范围内进行全扫描,测定改性和未改性果胶最大吸收波长。
1.3.6 扫描电镜
分别取干燥后的阿魏酸样品、果胶样品,阿魏酸和果胶直接混合样品和阿魏酸改性的果胶样品,用扫描电镜观察表面结构特性。将4 种样品分别固定、喷金后,用SU-8018型扫描电镜各放大100 倍和250 倍进行观察。
1.3.7 傅里叶变换红外光谱扫描
分别取果胶提取样品和改性果胶样品1~2 mg与100 mg KBr混合研磨压片,进行红外光谱扫描。在4 000~400 cm-1范围内扫描收集谱峰,扫描次数为32 次,光谱分辨率为4 cm-1,每个样品重复扫描16 次,并扣除KBr背景光谱。
1.4 数据处理
所有实验重复3 次,所得数据用Data Processing System(DPS 15.10)软件进行差异显著性分析,采用Origin 8.0软件进行数据处理和图表制作。
2 结果与分析
2.1 阿魏酸处理对萝卜果胶色度的影响

图1 不同处理果胶色度图Fig. 1 Photographic images of native and modified pectin
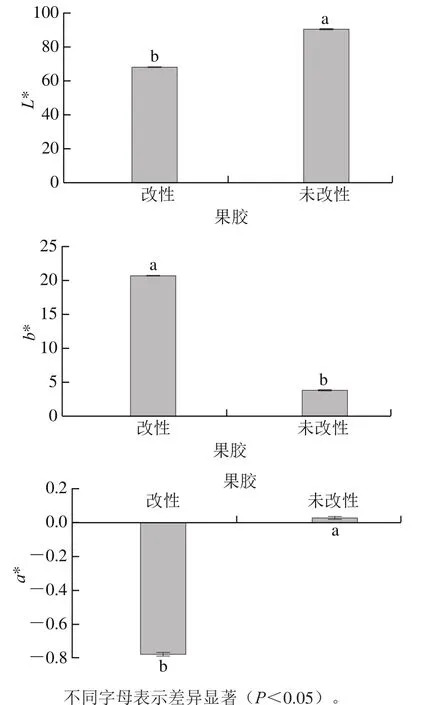
图2 不同处理果胶的L*、a*、b*值Fig. 2 L*, a* and b* values of native and modified pectin
由图1、2可以看出,未改性果胶的L*值显著大于改性果胶(P<0.05),说明未改性的果胶颜色更白;改性果胶的a*值为负值,显著小于未改性的果胶,表明改性后果胶偏向绿色;改性果胶的b*值显著大于未改性果胶(P<0.05),说明改性后的果胶颜色偏黄。综上所述,改性后的果胶白度下降,颜色呈现黄色,这与肉眼观察到的结果一致。导致改性果胶颜色变黄的原因可能是阿魏酸在酶的催化作用下发生氧化交联反应,改变了果胶原来的颜色。
2.2 阿魏酸处理对果胶抗氧化性的影响
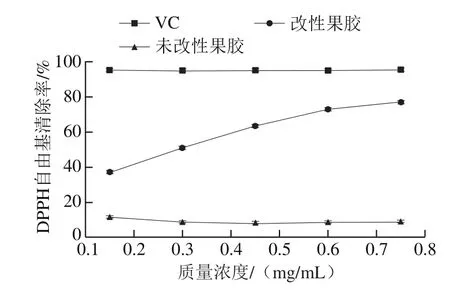
图3 不同处理果胶的DPPH自由基清除率Fig. 3 DPPH radical scavenging effect of VC and native and modified pectin
由图3可知,VC的抗氧化性高达95%左右;未改性果胶的DPPH自由基清除率只有10%,说明未改性的果胶抗氧化性很低;而改性的果胶抗氧化性随着果胶质量浓度的增大而增强,在质量浓度大于0.6 mg/mL后趋于平缓,虽然VC和未改性果胶的质量浓度选取不是最佳,但仍可以说明阿魏酸改性显著增强了果胶的抗氧化能力。这可能是由于经阿魏酸改性果胶的羧基更加活泼更容易解离出氢离子与DPPH自由基结合还原成DPPH—H,导致改性果胶清除DPPH自由基的能力更强[28-29],具体原因还需进一步分析。
2.3 阿魏酸处理对果胶流变学性质的影响

图4 改性果胶和未改性果胶黏度(A)和频率(B)扫描图Fig. 4 Viscosity versus frequency curves of native and modified pectin
如图4A所示,改性果胶和未改性果胶的茹度都随着剪切速率的增大而减小,均为假塑性流体。此外,改性后的果胶茹度大于未改性的果胶。阿魏酸改性显著增加了果胶茹度,这可能与阿魏酸与果胶发生交联反应有关[30]。
由图4B可知,改性果胶和未改性果胶G”增长趋势相似;但改性果胶G’的增长趋势要高于未改性果胶,表明果胶用阿魏酸改性后更趋向于固体性质。
2.4 阿魏酸处理对萝卜果胶紫外吸光度的影响
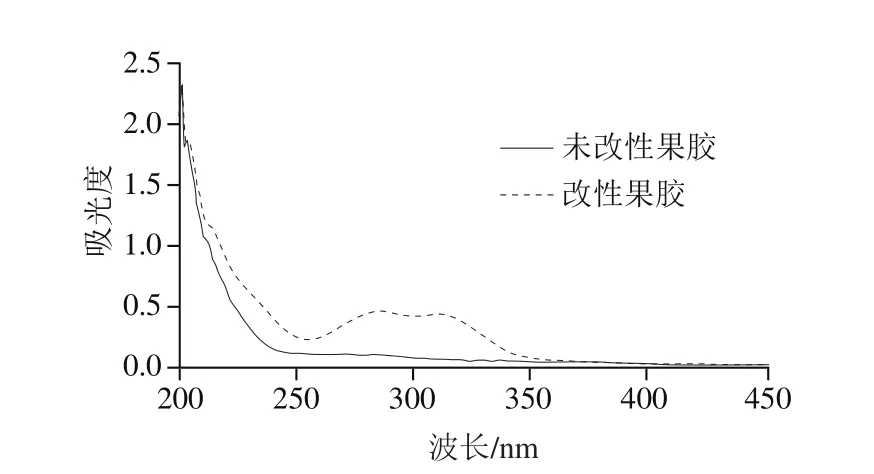
图5 改性果胶和未改性果胶的紫外-可见吸光度Fig. 5 UV-visible absorption spectra of native and modi fied pectin
如图5所示,2 种果胶在波长200 nm处都有强吸收峰,这是水溶液的溶剂峰,除此之外,未改性的果胶没有其他吸收峰;但改性果胶在260~280 nm有吸收峰,芳香族化合物在此波长处会有吸收峰。改性的果胶在300~320 nm也有吸收峰,因为阿魏酸在320 nm波长处有特征吸收峰,这说明改性果胶中己经含有一定量的阿魏酸,有研究指出阿魏酸可以通过酯键与果胶多糖共价连接[31],此结果证实了果胶与阿魏酸可能发生了共价交联。
2.5 阿魏酸处理果胶对其表面微观结构的影响

图6 阿魏酸、果胶、阿魏酸和果胶混合物、改性果胶的扫描电镜图Fig. 6 SEM micrographs of ferulic acid, pectin, their physical mixture and modified pectin
如图6所示,阿魏酸其结构形状呈针状晶体;果胶呈现蓬松的块状结构;阿魏酸和果胶的直接混合物可以明显看出,针状结构的阿魏酸和块状疏松的果胶散落分布;阿魏酸改性的果胶可以看出,果胶与阿魏酸发生结合,改变了原有的蓬松块状的表面结构,呈现出与物理混合完全不同的结构,这表明阿魏酸改性果胶己使其表面结构发生变化。
2.6 阿魏酸处理果胶对其傅里叶变换红外光谱的影响

图7 阿魏酸(a)、果胶(b)、阿魏酸和果胶混合(c)、改性果胶(d)的傅里叶变换红外光谱Fig. 7 FT-IR spectra of ferulic acid (a), pectin (b), their physical mixture (c) and modified pectin (d)
如图7所示,阿魏酸的红外光谱具有明显的羟基吸收峰(3 436 cm-1)、芳香族共轭羰基(1 692 cm-1)和芳香环吸收带(1 620、1 517 cm-1),这都是酚类物质的特征吸收峰。果胶的红外光谱,其在3 410 cm-1处有较宽的—OH伸缩振动吸收峰,并且在1 090 cm-1处有—OH的形变振动吸收峰。阿魏酸和果胶直接混合物的红外光谱,与阿魏酸的红外光谱相似,可能是阿魏酸相对于果胶比例过多造成的。阿魏酸改性的果胶,其红外光谱与阿魏酸和果胶直接混合的红外谱图相比,改性的果胶在3 400 cm-1处峰变宽加深,且2 920 cm-1处甲基—CH的振动峰增强。此外,物理混合于改性果胶相比,1 620、1 517、1 113 cm-1处的谱带发生移动,这个结果与Wang Jing等[32]的结果一致,推测可能是由于阿魏酸的多酚羟基和果胶的羟基之间形成氢键造成的。
3 结 论
用阿魏酸和辣根过氧化物酶对白萝卜果胶进行改性,使果胶的颜色、流变学性质、表面微观结构、基团性质等方面发生改变。改性后的果胶与原果胶相比颜色变黄,DPPH自由基清除率显著增强,显著增强了白萝卜果胶的抗氧化性。果胶的流变学性质发生改变,改性果胶的茹度增强,且G’增大,样品更偏向于固体性质。白萝卜果胶在阿魏酸和过氧化物酶的作用下表面的微观结构发生了变化,阿魏酸使原本分散的果胶分子紧密连接在一起。此外,果胶的最大吸光度和基团特征吸收峰的峰值发生变化,说明阿魏酸处理果胶形成了新的物质。阿魏酸和辣根过氧化物酶处理能够改进果胶的功能性,这一研究结果为改善果胶的功能性质提供了新的方法,为推广到其他多糖的改性生产提供了理论依据。
