苹果梨酵素发酵过程中的褐变与抗氧化活性
2020-07-23范昊安沙如意薛淑龙崔艳丽毛建卫
范昊安,沙如意,*,方 晟,薛淑龙,陈 雨,黄 俊,崔艳丽,毛建卫,4,*
(1.浙江省农产品化学与生物加工技术重点实验室,浙江省农业生物资源生化制造协同创新中心,浙江科技学院生物与化学工程学院,浙江 杭州 310023;2.绍兴文理学院元培学院,浙江 绍兴 312000;3.浙江大学理学部,浙江 杭州 310027;4.浙江工业职业技术学院,浙江 绍兴 312000)
食用酵素是以一种或多种新鲜蔬菜、水果和谷豆类、海藻类、食药两用本草类、菌菇类等食材为原料,加(或不加)糖类物质,经多种有益菌通过较长时间发酵而生产的功能性微生物发酵产品,拥有丰富的次生代谢产物、原料本身营养成分和益生菌等功能性成分,特别是富含小分子功能成分[1-2]。
苹果梨是蔷薇科(Rosaceae)梨属果树的果实,多产自吉林省延边自治州[3]。苹果梨富含氨基酸、微量元素、维生素、多酚类及黄酮类化合物等营养物质[4-6],研究表明其具有燥湿健脾、消炎止咳、润肺、利尿、抗真菌、抗氧化等多种功效[7-10]。苹果梨的贮藏方式单一,贮藏量仅占总产量的3%,加工量不足总量的10%,大部分用于鲜果或者冻梨销售[11],目前苹果梨可开发加工的产品形式有苹果梨酒、苹果梨澄清饮料、苹果梨果脯、苹果梨果汁、苹果梨脆片等[3],但苹果梨在加工过程中极易发生褐变,影响产品的外观品质与营养价值,研究表明果蔬原料中的酶促褐变主要是由多酚氧化酶(polyphenol oxidase,PPO)引起的[11-12]。PPO能催化酚类物质氧化成为醌,进而生成棕褐色或黑色的色素。
基于苹果梨的加工企业及加工形式较少,食用酵素作为一种绿色高效的农产品加工方式,可以在解决苹果梨贮藏问题的同时,实现苹果梨的精深加工,拓宽苹果梨的应用市场。本研究以苹果梨酵素为研究对象,通过跟踪检测苹果梨发酵过程中色度、褐变程度、PPO活力等参数反映苹果梨酵素在发酵过程中的色泽变化与褐变状况,通过跟踪检测pH值、可滴定酸、有机酸、总酚、总黄酮含量变化分析酶促褐变的影响因素及苹果梨发酵过程中活性成分的变化;以1,1-二苯基-2-苦苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力、2,2’-联氮双(3-乙基苯并噻唑啉-6-磺酸)(2,2’-azinobis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)阳离子自由基清除能力、羟自由基清除能力、过氧化氢清除能力和还原力为抗氧化性指标,评价苹果梨酵素的抗氧化活性,以期为苹果梨酵素的综合开发提供相关理论依据。
1 材料与方法
1.1 材料与试剂
苹果梨由吉林省延吉市苹果梨种植基地提供;白砂糖(食品级) 太古糖业(中国)有限公司;酵液由浙江省农产品化学与生物加工技术重点实验室提供。
标准品(柠檬酸、抗坏血酸) 美国Sigma公司;甲醇(色谱纯) 美国Thermo Fisher Scientific公司;KH2PO4(色谱纯)、邻苯二酚、ABTS 上海阿拉丁化学试剂有限公司;DPPH 日本TCI公司;其他试剂均为国产分析纯。
1.2 仪器与设备
316L型50 L不锈钢发酵罐由浙江省农产品化学与生物加工技术重点实验室提供。
916 Ti-Touch电位滴定仪 瑞士Metrohm公司;PHS-3C精密酸度计 杭州齐威仪器有限公司;UV-5500PC紫外分光光度计 上海市元析仪器有限公司;CM-5分光测色计 日本Konica Minolta公司;e2695高效液相色谱(配有Waters 2998二极管阵列检测器)仪 美国Waters公司;SpectraMax iD5多功能酶标仪 美国Molecular Devices公司。
1.3 方法
1.3.1 苹果梨酵素的制备
用无菌水冲洗新鲜苹果梨(果实完全成熟且无虫害溃烂),自然沥干后切块,将苹果梨和白砂糖以质量比1∶1加入高压蒸汽灭菌过的50 L不锈钢发酵罐中,并加入适量酵液,于(20±5)℃避光发酵,定期取样,将样品离心后的上清液保存于-80 ℃超低温冰箱中,待测。
1.3.2 色度的测定
使用分光测色计对苹果梨酵素进行测定,记录L*、a*、b*值。其中,L*值表示样品色泽的亮度,a*值表示红度或绿度,b*值表示黄度或蓝度。以鲜榨苹果梨汁为参比标准溶液,计算色差值ΔE,ΔE越小表示待测样品与参比样品色泽越接近,反之为相差越大。ΔE计算公式如下:
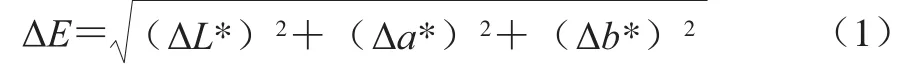
1.3.3 褐变程度的测定[13]
取2 mL酵素样品,以去离子水作空白对照,测定其在420 nm波长处吸光度,吸光度即为苹果梨酵素的褐变程度。
1.3.4 PPO活力的测定[14]
在96 孔板中快速加入磷酸盐缓冲液(pH 7.4)160 μL,0.1 mol/L邻苯二酚溶液15 μL,酵素样品30 μL,混匀,于30 ℃反应5 min,利用酶标仪在420 nm波长处测定吸光度,记录反应开始与结束时的吸光度。在此测定条件下,吸光度每分钟增加0.001定义为一个酶活力单位(U),计算如式(2)所示:
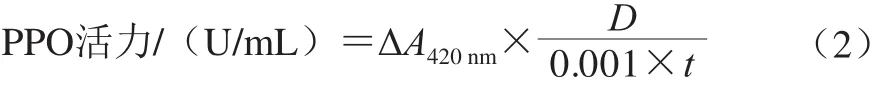
式中:ΔA420nm为反应前后吸光度差值;D为稀释倍数;t为反应时间/min。
1.3.5 pH值与可滴定酸的测定
使用精密pH计测定酵素样品的pH值。
使用电位滴定仪测定酵素样品的可滴定酸含量,参照GB/T 12456—2008《食品中总酸的测定方法》中的pH电位法,结果参考T/CBFIA 08003—2017《食用植物酵素》,以乳酸质量浓度(g/100 mL)计。
1.3.6 有机酸含量的测定[15]
取400 μL酵素样品,使用0.01 mol/L KH2PO4(pH 2.7)溶液稀释至1 mL,经0.22 μm微孔滤膜过滤,待测。配制质量浓度均为1 mg/mL的抗坏血酸、柠檬酸标准溶液经0.22 μm微孔滤膜过滤,待测。
检测条件:色谱柱:Atiantis®T3柱(250 mm×4.6 mm,5 μm);流动相:甲醇-KH2PO4(pH 2.7)2∶98(V/V);流速:1.0 mL/min;柱温:25 ℃;进样量:10 μL;检测波长:210 nm。检测器:二极管阵列检测器。
1.3.7 总酚含量的测定
采用福林-酚法[16]测定苹果梨酵素中总酚含量。取100 μL酵素样品,用去离子水稀释至0.5 mL,加入体积分数为10%的福林-酚溶液2.5 mL,常温避光静置反应3 min后,加入75 g/L Na2CO3溶液2 mL,混匀。于25 ℃反应1 h,在765 nm波长处测定吸光度。
1.3.8 总黄酮含量的测定
采用NaNO2-Al(NO3)3比色法[17]测定苹果梨酵素中总黄酮含量。取400 μL酵素样品,加入50 g/L NaNO2溶液150 μL,混匀静置6 min,加入100 g/L Al(NO3)3溶液150 μL,混匀静置6 min,加入40 g/L NaOH溶液2.0 mL,用去离子水定容至5 mL,混匀静置15 min,在510 nm波长处测吸光度。
1.3.9 DPPH自由基清除能力的测定[18]
取200 μL酵素样品,用去离子水稀释至2 mL,加入0.1 mmol/L DPPH-甲醇溶液4 mL,50 mmol/L Tris-HCl缓冲液(pH 7.4)450 μL,于25 ℃恒温水浴反应30 min,以去离子水为空白对照,在517 nm波长处测定吸光度。自由基清除率计算如式(3)所示:

式中:A0为空白对照吸光度;A1为样品吸光度;A2为样品本底管吸光度。
1.3.10 ABTS阳离子自由基清除能力的测定[19]
ABTS稀释液配制:称取96.02 mg ABTS和16.55 mg过硫酸钾,用5 mmol/L磷酸盐缓冲液(pH 7.4)定容至25 mL,在暗处室温放置12~16 h,使用前,用上述磷酸盐缓冲液稀释,使其在波长734 nm处的吸光度为0.70±0.02。
取4 μL酵素样品,用上述磷酸盐缓冲液稀释至300 μL,加入ABTS稀释液5 mL,于30 ℃反应1 h。以去离子水为空白对照,在734 nm波长处测吸光度。ABTS阳离子自由基清除率计算如式(3)所示。
1.3.11 羟自由基清除能力的测定[20]
取500 μL酵素样品,用去离子水稀释至2 mL,加入6 mmol/L H2O2溶液1.4 mL,20 mmol/L水杨酸钠溶液0.6 mL和1.5 mmol/L FeSO4溶液2 mL,混匀,于37 ℃恒温水浴反应1 h。以去离子水为空白对照,在510 nm波长处测定吸光度。羟自由基清除率计算如式(3)所示。
1.3.12 过氧化氢清除能力的测定[21]
取500 μL酵素样品,用去离子水补至1 mL,加入8 mmol/L H2O2溶液1.2 mL,混合均匀,于室温静置10 min。以去离子水为空白对照,在230 nm波长处测定吸光度。过氧化氢清除率计算如式(3)所示。
1.3.13 还原力的测定[22]
取200 μL酵素样品,用0.2 mol/L磷酸盐缓冲液(pH 6.6)补至2.5 mL,加入10 g/L铁氰化钾溶液2.5 mL,混合均匀,于50 ℃反应30 min,再加入100 g/L三氯乙酸溶液2.5 mL,混合均匀,静置10 min,立即取2.5 mL上清液,加入去离子水2.5 mL和1 g/L三氯化铁溶液0.5 mL,混合均匀。以去离子水为空白对照,在700 nm波长处测定吸光度。
1.4 数据统计与分析
2 结果与分析
2.1 苹果梨酵素发酵过程中色度的变化
色泽是衡量酵素品质质量的重要物理指标,同时也可以反映苹果梨酵素在发酵过程中的褐变状况。如表1所示,发酵过程中色度变化显著(P<0.05)。L*代表亮度,L*值下降可以直观反映苹果梨加工过程中褐变的发生[23]。随着发酵时间的延长,L*值呈现先下降后上升的趋势,发酵第80天L*值达到最低值,为58.71±0.00,发酵140 d,L*值回升至96.32±0.11。a*>0代表红色色调,b*>0代表黄色色调,在发酵过程中两者均呈先上升后下降的趋势。发酵5~80 d,a*值从0.66±0.01上升至18.98±0.02,说明随着褐变的发生,苹果梨酵素逐渐呈现红褐色。发酵80~140 d,a*值回降至0.90±0.06,说明发酵后期红色色调基本消失,复色为苹果梨汁本色。在发酵过程中,b*值从5.32±0.01上升至10.23±0.15,说明长期发酵适当加深了苹果梨酵素的淡黄色色调。结果表明,发酵140 d的苹果梨酵素总色调呈鲜亮的淡黄色,复色效果明显。
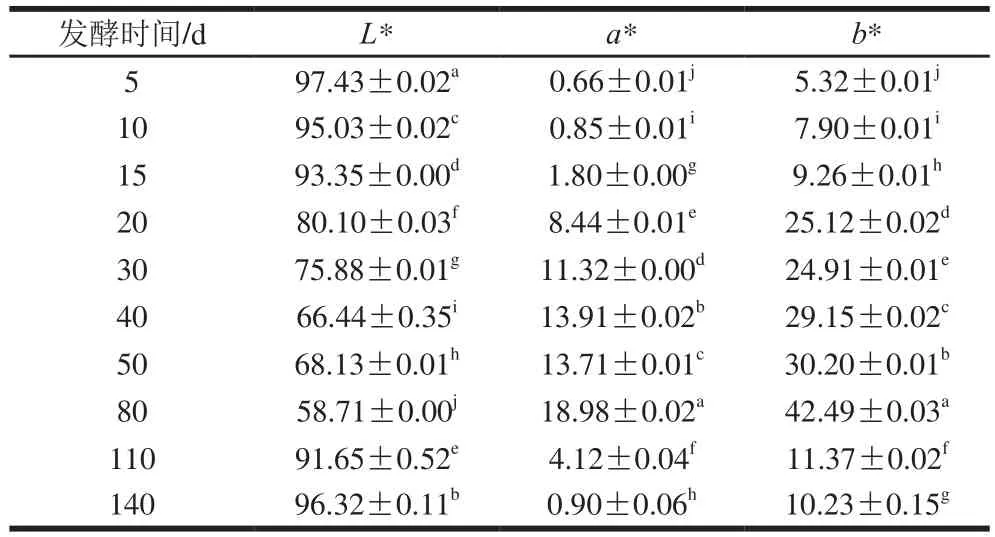
表1 发酵过程中色度的变化Table 1 Changes in chroma during fermentation

图1 发酵过程中色差的变化Fig. 1 Changes in chromatic aberration during fermentation
色差值ΔE越小,苹果梨酵素的色度越接近鲜榨苹果梨汁(L*=96.94±0.01,a*=-0.56±0.01,b*=8.26±0.03)。如图1所示,发酵过程中ΔE值呈现先上升后下降的趋势。发酵前15 d,ΔE值均小于5,说明无明显褐变发生。发酵20~80 d,ΔE快速上升,酵素总体呈现红褐色。发酵80 d后,ΔE值急剧下降,并在发酵第140天达到最低值2.53±0.19。发酵第140天时色泽变化最小,且其ΔE值与发酵第10天无显著差异(P>0.05),说明较长期的发酵过程保持了苹果梨的综合色度,起到了有效的护色复色效果。
2.2 苹果梨酵素发酵过程中褐变程度的变化

图2 发酵过程中褐变程度的变化Fig. 2 Changes in browning degree during fermentation
由图2可知,褐变程度在发酵过程中呈先上升后下降的趋势,其变化趋势与L*值相反。发酵5~40 d,褐变程度快速上升且于发酵15~20 d上升速度最快,增幅达到312.46%。发酵40~80 d,褐变程度进一步上升,并在发酵第80天时达到最高值2.010±0.002。发酵前期褐变程度的上升主要源于PPO引起的酶促褐变,高糖渗透压导致多酚、黄酮类物质的溶出与细胞内PPO的释放,使得底物、酶与氧气充分接触,从而促进酶促褐变的发生[24]。在发酵后期,褐变程度持续下降至0.706±0.004,由此可知酶促褐变在发酵后期受到控制。李梅等[25]研究发现毛竹笋自然发酵63 d的L*值相较发酵21 d明显回升,更有效保持毛竹笋的综合色泽,说明延长发酵具有一定的生物护色效果。
2.3 苹果梨酵素发酵过程中PPO活力的变化
梨中的PPO是引起酶促褐变的主要原因之一,酚类物质在PPO催化作用下氧化为邻醌及其聚合物类黑色素,进而导致色泽加深、变暗[26]。如图3所示,PPO活力在发酵过程中呈现先上升后下降的趋势,与褐变程度变化趋势相似,说明苹果梨酵素的褐变一定程度上由PPO引起的酶促褐变所致。发酵前50 d,PPO活力快速上升,于第50天达到酶活力峰值(26.26±0.28)U/mL,发酵前期PPO活力增强可能与苹果梨果肉组织损伤有关[27]。发酵50 d后,随着发酵时间的延长,PPO活力不断下降,发酵第80天苹果梨酵素中PPO活力与发酵第20天己无明显差异(P>0.05),这可能与发酵过程中有机酸、多酚类、黄酮类化合物等活性物质的生成代谢有关。在生产实践中,抑制PPO活力是加工过程中抑制酶促褐变的主要方法,在苹果梨酵素制作的过程中,通过自身因素抑制PPO活力,从而达到护色目的,为有效控制酶促褐变提供了经济环保的新思路。

图3 发酵过程中PPO活力的变化Fig. 3 Changes in PPO activity during fermentation
2.4 苹果梨酵素发酵过程中pH值与可滴定酸的变化

图4 发酵过程中pH值和可滴定酸含量的变化Fig. 4 Changes in pH value and total titratable acidity during fermentation
如图4所示,pH值和可滴定酸含量在发酵过程中呈现相反的变化趋势。pH值在20 d内由5.10±0.05迅速下降至4.37±0.06,后期缓慢下降直至稳定于4.14±0.02。权伍荣等[28]研究表明当pH值小于4.20时,苹果梨PPO活力几乎为0。其原因在于PPO为含铜蛋白质,在低pH值时,PPO中的辅基铜会被解离成铜离子,同时酸性较强会使蛋白质变性,导致PPO失活[29]。发酵第50天,苹果梨酵素pH值降至4.20±0.02,由图3可知,同期PPO活力亦开始下降,说明发酵产生的低pH值环境较好地抑制了PPO活力。发酵过程中,可滴定酸呈逐渐上升趋势,且在前30 d上升速率较快,后期趋于平缓,由(0.017±0.003)g/100 mL上升至(0.320±0.004)g/100 mL。发酵前期可滴定酸含量的快速上升是由于发酵过程中醋酸、草酸等多种有机酸的生成所致[30]。发酵后期可滴定酸含量的缓慢上升可能是因为PPO引起的酶促褐变消耗大量氧气,微生物在溶氧不足的条件下将乙醇转化为醋酸,将己糖转化为乳酸等有机酸[31],但同时柠檬酸与抗坏血酸含量不断下降,使可滴定酸含量上升趋势较为平缓。
2.5 苹果梨酵素发酵过程中有机酸含量的变化
如图5所示,发酵过程中抗坏血酸和柠檬酸含量呈先上升后下降的趋势。柠檬酸前15 d未检出,说明柠檬酸是由苹果梨酵素发酵代谢产生的,并在发酵第40天达到最大值(0.587±0.011)mg/mL。抗坏血酸是苹果梨中主要有机酸之一[32],其质量浓度在发酵第50天达到最大值(0.794±0.001)mg/mL。发酵后期两者含量的降低可能是与PPO及其褐变产物反应消耗所致。部分有机酸对酶促褐变具有双重抑制作用,在降低pH值的同时,抗坏血酸可以将醌类及其衍生物还原成酚类物质[33],甚至可以作为竞争性抑制剂被PPO直接氧化,从而起到控制褐变的作用;柠檬酸可以鳌合PPO的铜离子辅基,进而抑制其活力[27]。Sapers等[34]研究发现相较单独使用褐变抑制剂,抗坏血酸和柠檬酸两者联用具有更好的褐变抑制效果。由此可知,苹果梨酵素通过微生物发酵代谢生成抗坏血酸和柠檬酸,在解决抗坏血酸自身成本问题的同时,有效控制酶促褐变,达到护色效果。

图5 发酵过程中有机酸含量的变化Fig. 5 Changes in organic acid content during fermentation
2.6 苹果梨酵素发酵过程中总酚含量的变化
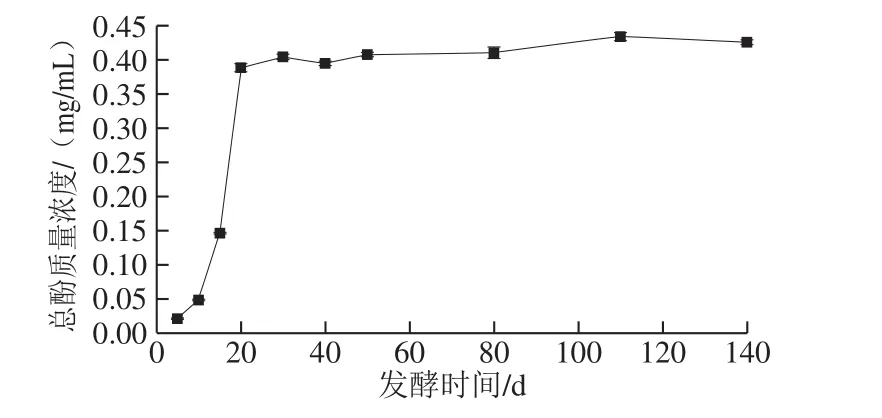
图6 发酵过程中总酚含量的变化Fig. 6 Changes in total phenolic content during fermentation
如图6所示,发酵过程中总酚含量呈迅速上升后趋于平缓的趋势。在发酵前20 d,总酚含量快速上升,增长约17.52 倍,可能与发酵前期苹果梨中的多酚类物质大量溶出有关。发酵20 d后,总酚含量缓慢上升,于第140天达到最大值(0.426±0.004)mg/mL,这可能是随着发酵的进行,在微生物作用下,单体酚类物质的合成所致[35]。王磊等[36]研究表明底物浓度(即总酚含量)在低范围时,随着总酚含量的增加,PPO活力也相应增强,但随着总酚含量的持续增长,高浓度的底物会对PPO活力起到抑制作用,进一步说明苹果梨酵素发酵过程中总酚含量的上升抑制了PPO活力,从而控制酶促褐变的发生。
2.7 苹果梨酵素发酵过程中总黄酮含量的变化

图7 发酵过程中总黄酮含量的变化Fig. 7 Changes in total flavonoid content during fermentation
如图7所示,发酵过程中总黄酮含量呈先迅速上升,后有所下降,再持续上升的趋势。在发酵前30 d,总黄酮质量浓度快速上升,并于第30天达到最大值(44.522±0.338)μg/mL。发酵第50天总黄酮含量的下降可能是因为此时PPO活力最强,黄酮类化合物在PPO的作用下被氧化分解。随后,总黄酮质量浓度持续上升至(44.443±0.276)μg/mL,这可能是由于游离态的黄酮醇类物质与糖苷结合而成的黄酮醇配糖体在发酵后期发生水解,导致总黄酮含量回升[37]。
2.8 苹果梨酵素发酵过程中DPPH自由基清除率的变化
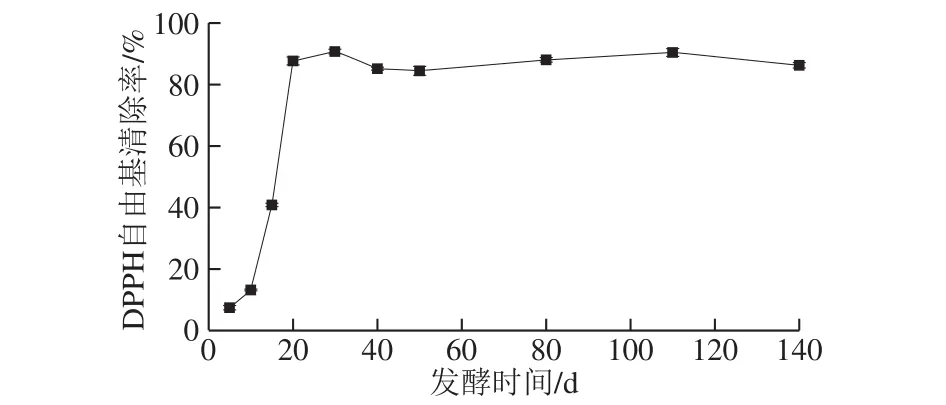
图8 发酵过程中DPPH自由基清除率的变化Fig. 8 Changes in DPPH radical scavenging activity during fermentation
如图8所示,发酵过程中DPPH自由基清除率呈迅速上升后趋于平缓的趋势。发酵前30 d,DPPH自由基清除率快速上升至最大值(90.91±0.74)%,随后趋于平缓,说明适当延长发酵时间可明显提高苹果梨酵素的抗氧化活性。Galvis Sáchez等[38]研究表明6 种不同梨品种的果实及其果皮均具有良好的DPPH自由基清除能力,且清除DPPH自由基可能是梨中多种酚类物质共同作用的结果。
2.9 苹果梨酵素发酵过程中ABTS阳离子自由基清除率的变化
如图9所示,发酵过程中ABTS阳离子自由基清除率呈迅速上升后趋于平缓的趋势。发酵前20 d,ABTS阳离子自由基清除率从(12.86±0.48)%快速上升至(93.74±0.65)%。随后清除率缓慢上升直至平缓,并于第80天达到最大值(99.82±0.18)%。苹果梨酵素ABTS阳离子自由基清除能力变化趋势与其总酚含量变化相似,说明两者具有极显著的相关性(P<0.01),与葡萄酵素的研究结果一致[39]。

图9 发酵过程中ABTS阳离子自由基清除率的变化Fig. 9 Changes in ABTS cation radical scavenging activity during fermentation
2.10 苹果梨酵素发酵过程中羟自由基清除率的变化
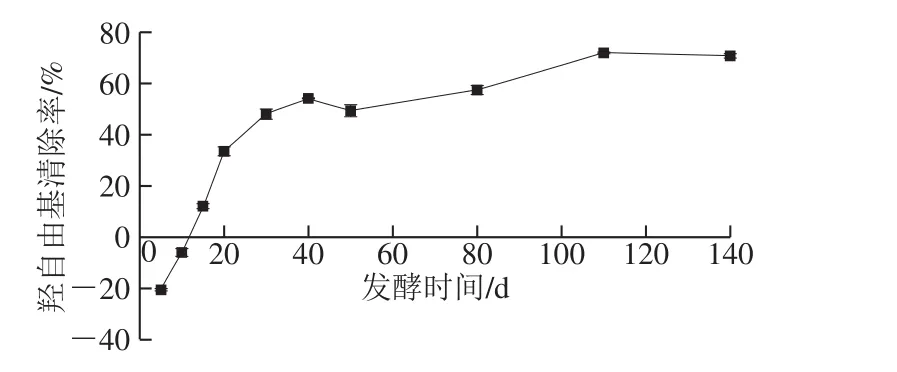
图10 发酵过程中羟自由基清除率的变化Fig. 10 Changes in hydroxyl radical scavenging activity during fermentation
如图10所示,发酵过程中羟自由基清除率呈持续上升的趋势。发酵前10 d,苹果梨酵素对羟自由基具有促氧化作用,但随着发酵时间的延长,羟自由基清除率不断上升,当发酵第110天时达到最大值(70.74±0.88)%。赵金伟等[10]研究表明苹果梨酚类物质对羟自由基的清除能力较强,说明适当发酵可以抑制苹果梨酵素发酵前期不良的促氧化作用,并进一步增强其在发酵后期的羟自由基清除能力。
2.11 苹果梨酵素发酵过程中过氧化氢清除率的变化

图11 发酵过程中过氧化氢清除率的变化Fig. 11 Changes in hydrogen peroxide scavenging activity during fermentation
过氧化氢自身在细胞内并不活跃,但其在金属离子作用下会产生羟自由基,从而造成细胞损伤[40]。如图11所示,发酵过程中过氧化氢清除率呈迅速上升后趋于平缓的趋势。在发酵第20天快速上升至(96.25±1.06)%后,过氧化氢清除率基本稳定,且于发酵第80天达到最大值(98.81±1.21)%。陈斐冷等[41]研究表明高异黄酮和酚类等物质具有极强的过氧化氢清除能力,苹果梨酵素过氧化氢清除能力的快速提升可能与其总酚和总黄酮含量的变化有关。
2.12 苹果梨酵素发酵过程中还原力的变化
Fe3+的还原反应通常被用来判断供电子基团的强弱,其所反映的还原力与众多抗氧化机制密切相关[42]。如图12所示,发酵过程中还原力呈持续上升的趋势,并于发酵第140天达到最大值0.666±0.001,相较发酵第5天增长了4.4 倍。郭红莲等[43]研究表明相较于未发酵的枸杞液,枸杞酵素的还原力显著提高。发酵时间的延长有利于苹果梨酵素还原力的增强。
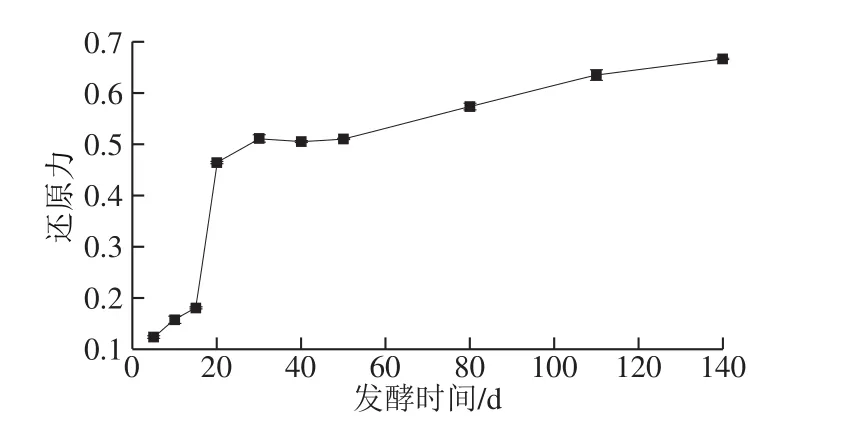
图12 发酵过程中还原力的变化Fig. 12 Changes in reducing power during fermentation
2.13 相关性分析
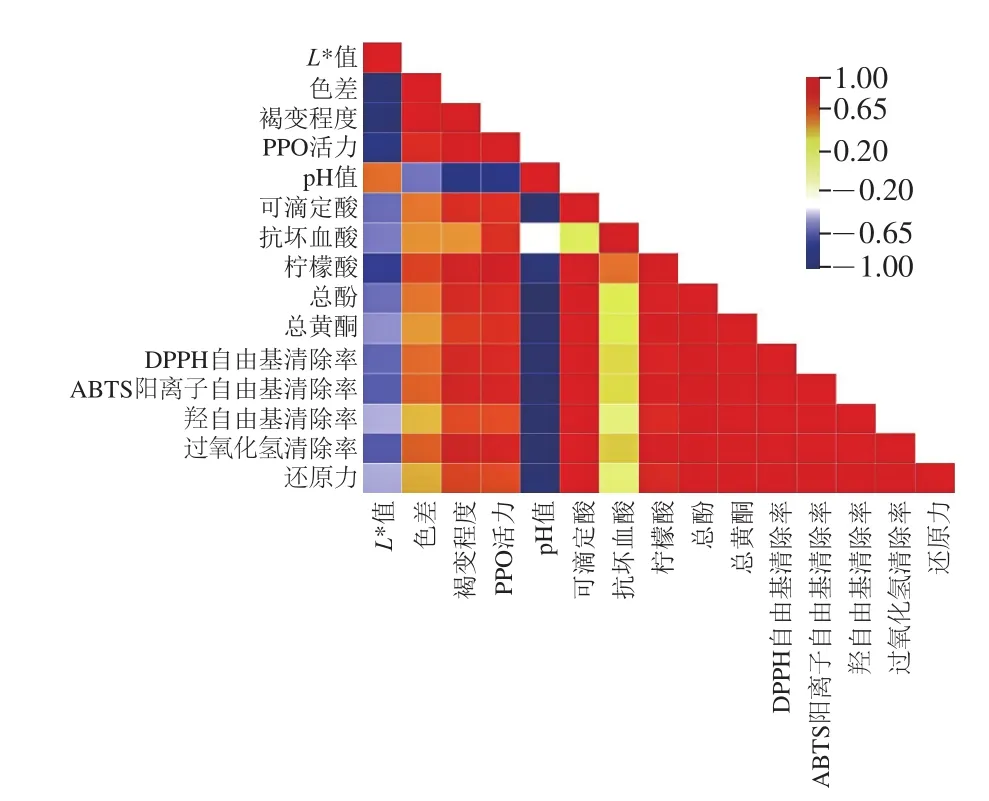
图13 发酵过程中各理化指标与抗氧化活性的相关性分析热图Fig. 13 Heatmap from correlation analysis between physicochemical parameters and antioxidant activity during fermentation
由图13可知,褐变状况方面,L*值、色差、褐变程度、PPO活力间呈现极显著相关(P<0.01);褐变控制方面,pH值、可滴定酸、抗坏血酸、柠檬酸、总酚、总黄酮与褐变程度、PPO活力亦具有显著相关性(P<0.05),说明pH值、可滴定酸、抗坏血酸、柠檬酸、总酚、总黄酮等因素可以有效抑制苹果梨酵素的褐变;抗氧化活性方面,总酚、总黄酮、柠檬酸含量与DPPH自由基、ABTS阳离子自由基、羟自由基清除能力、过氧化氢清除能力、还原力之间均存在极显著正相关性(P<0.01),说明多酚类物质、黄酮类物质和有机酸具有较好的抗氧化活性。
3 结 论
本研究通过测定色度、色差、褐变程度、PPO活力等参数反映苹果梨酵素在发酵过程中的色泽变化与褐变状况,结果表明:较长期发酵可以有效控制PPO引起的酶促褐变,其褐变控制与pH值、可滴定酸、抗坏血酸、柠檬酸、总酚、总黄酮等理化指标的变化显著相关(P<0.05),为苹果梨的加工、护色、复色提供科学合理的新方法。同时测定DPPH自由基清除率、ABTS阳离子自由基清除率、羟自由基清除率、过氧化氢清除率、还原力等指标,结果表明:苹果梨酵素在发酵过程中抗氧化活性均呈先快速增加后趋于平缓的趋势。经过发酵,其抗氧化活性得以大幅度提升,抗氧化活性的提高与总酚、总黄酮、柠檬酸含量的变化显著相关(P<0.05)。苹果梨酵素富含有机酸、多酚类化合物、黄酮类化合物等活性成分,其协同作用可能抑制褐变,且具有良好的抗氧化活性,说明发酵制备酵素是苹果梨高值化利用的一种加工方式。
