叉叶茅膏菜组培快繁的研究
2020-07-23张艺萍杨秀梅王丽花张丽芳瞿素萍
许 凤,张艺萍,,宋 杰,杨秀梅,王丽花,苏 艳,张丽芳,瞿素萍*
(1.云南省农业科学院 花卉研究所,云南 昆明 650205;2.国家观赏园艺工程研究中心,云南 昆明 650205;3.云南省花卉育种重点实验室,云南 昆明 650205)
茅膏菜(DroseraspatulataJ. E. Smith)为茅膏菜科(Droseraceae)茅膏菜属(Drosera)植物,又称石龙牙草、地上明珠等,在我国主要分布于长江以南和东北等地区,生于潮湿的山坡草地、灌丛、疏林及小溪流旁边等[1-2]。作为药用植物,茅膏菜具有解疮毒等功效[3],同时其新奇的外形以及所独有的食虫植物的特殊形态结构,在花卉园艺界有着相当高的观赏价值,是一种极具经济价值的植物[4-7]。目前,有关茅膏菜属植物的研究主要集中于其药用价值[8-16]、食虫机制[17-18]、生态学研究[18-19],对于其繁育技术的研究只限于少数种[20-24]。
随着市场需求量的不断增大,现有茅膏菜的数量已经供不应求,同时由于生态环境日益受损,湿地及林地资源不断缩减,茅膏菜家族已经濒临灭绝[25],对茅膏菜进行组织培养和离体快繁,可短期内培养出大量生长健壮、均匀一致的优质种苗,能够有效挽救匮乏的种质资源,填补市场供应的空缺。目前,并未见有关于叉叶茅膏菜组织培养的报道,因此本研究对于食虫植物的资源保护及应用推广具有重要意义[22]。
1 材料与方法
1.1 材料
供试叉叶茅膏菜为2018年引自浙江省嘉兴市,栽植于云南省农业科学院花卉研究所品种资源圃。于春夏季茅膏菜生长旺盛季节,花序伸直未显色时,剪下作为外植体。
1.2 外植体的消毒
参照杨爽等[22]的方法,并进行改进。具体方法为:将剪下的花序,用洗衣粉水清洗一遍后,在自来水下冲洗15~20 min。放入超净工作台,使用75%酒精处理30 s,再用0.15%氯化汞溶液处理5~8 min,之后用0.5%次氯酸钠混合液(100 mL 0.5%次氯酸钠溶液加入2滴吐温20配制而成)消毒10~20 min,具体设置见表1,最后用无菌水冲洗5次。

表1 外植体消毒试验
1.3 愈伤组织的诱导
外植体消毒完成后,用无菌滤纸将表面水分吸干,把花序底部的花序轴切除0.5 cm左右,然后把处理好的花序接种于不同的诱导培养基上进行愈伤组织诱导。愈伤组织诱导培养基以MS为基本培养基,设置不同浓度的6-BA、KT、NAA共组成6个组合(表2)。

表2 愈伤组织诱导培养基
1.4 叉叶茅膏菜的愈伤组织分化
选取生长情况一致的愈伤组织团,每团0.1 g,以MS为基本培养基,根据表3中的组合。每个组合分别接种3瓶,每瓶接种5团愈伤组织。在光照16 h/8 h(光/暗),温度25 ℃/15 ℃(白天/昼夜)的条件下培养20 d后,对愈伤组织分化率、丛生芽苗高度、丛生芽状态进行观察并统计(表3)。
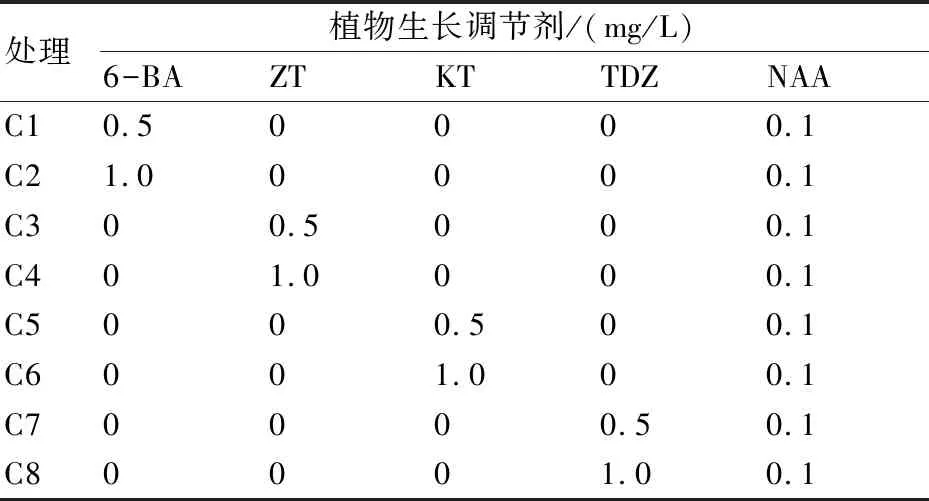
表3 愈伤组织分化培养基
2 结果与分析
2.1 不同消毒剂组合对叉叶茅膏菜花序消毒效果的影响
不同的消毒剂组合及处理时间对叉叶茅膏菜花序的消毒效果见表4。从表4可以看出,相同时间的氯化汞处理后,随着次氯酸钠混合液处理时间的延长,外植体的污染率呈现下降趋势,而褐化率却呈上升的趋势,外植体成活率呈上升的趋势,这表明在氯化汞处理时间不变的前提下,延长次氯酸钠混合液的处理时间可有效降低污染率,但时间过长又会对供试材料产生伤害,导致褐化率升高,进而影响成活率。同时,在次氯酸钠混合液处理时间相同时,延长氯化汞的处理时间,污染率降低,但褐化率却升高。
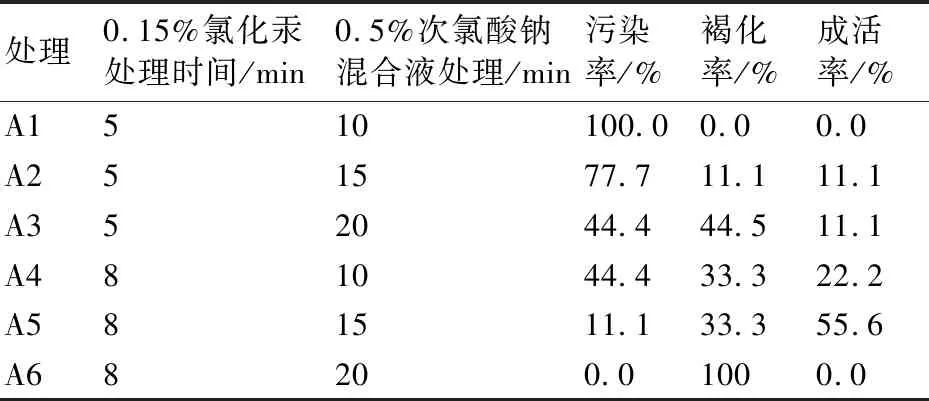
表4 花序消毒试验结果
因此,本研究认为叉叶茅膏菜花序消毒的最适宜方法:75%酒精处理30 s后用0.15%氯化汞溶液消毒8 min,之后用0.5%次氯酸混合液处理15 min。
2.2 不同生长调节及诱导叉叶茅膏菜愈伤组织发生的影响
由表5可以看出,当NAA的浓度相同时,随着6-BA、KT浓度的提高,愈伤组织团的形成时间缩短,且愈伤组织的状态从致密向疏松变化。同时,从图1可以看出,当6-BA、KT的浓度达到2.0 mg/L时,愈伤组织出现玻璃化现象,因此,叉叶茅膏菜愈伤组织诱导培养基应选择B2、B5培养基。

图1 不同植物生长调节剂影响下产生的愈伤组织

表5 不同生长调节剂诱导叉叶茅膏菜愈伤组织发生的影响
2.3 不同植物生长调节剂对叉叶茅膏菜愈伤组织分化的影响
将B2和B5培养基诱导出的状态良好的愈伤组织转接到8种不同的分化培养基上。从表6和图2可以看出,相同浓度的不同植物生长调节剂对愈伤组织分化的影响是不同的,综合愈伤组织分化率、丛生芽高度、丛生芽状态来看,可以得出,对于愈伤组织分化影响的大小依次为:ZT>KT>6-BA>TDZ。相同的生长调节剂,不同浓度对愈伤组织分化的影响也是不同的,当ZT为0.5 mg/L时,芽较高,叶片过粗,生长过于成熟,不利于下一步进行丛生苗增殖培养;当ZT为0.1 mg/L,丛生苗高度适中,生长一致,丛生芽较多。因此,综合上述分析结果,本研究认为MS+ZT 0.1 mg/L+NAA 0.1 mg/L是叉叶茅膏菜愈伤组织分化的最佳培养基。

图2 不同生长调节剂对叉叶茅膏菜愈伤组织分化的影响
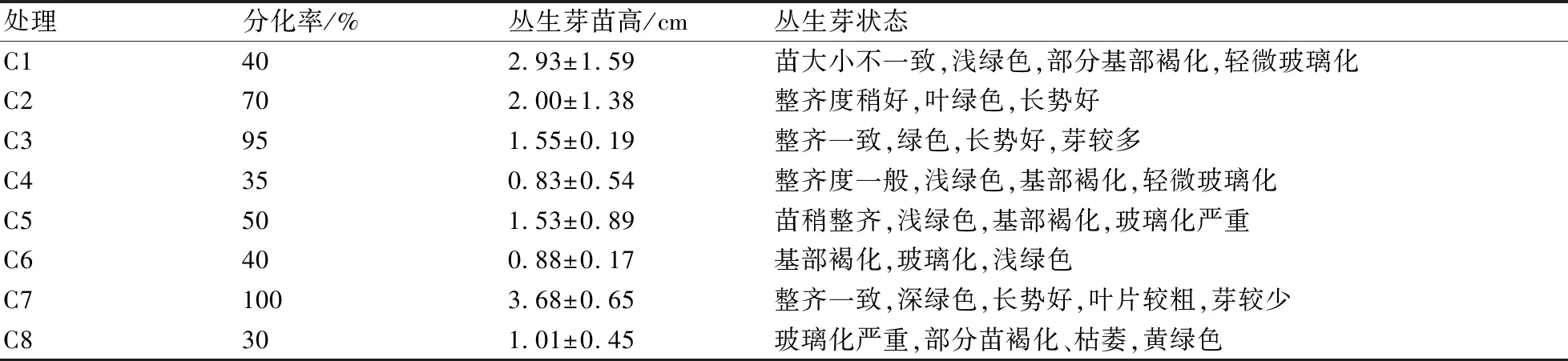
表6 不同植物生长调节剂对叉叶茅膏菜愈伤组织分化的影响
2.4 叉叶茅膏菜的生根与移栽
叉叶茅膏菜丛生苗高度为2.5 cm左右时,将其接入到不加植物生长调节剂的MS培养基中培养10~15 d,再转入到MS+IBA 0.3 mg/L+NAA 0.1 g/L+活性炭0.2 g/L+琼脂6 g/L+蔗糖15 g/L的生根培养基中。
将根长0.5 cm左右的幼苗连瓶转移到覆盖遮阳网的小拱棚中放置3~5 d,之后放入0.1%的百菌清液中浸泡10 min,冲洗干净,插入消毒过的且含饱和水的栽培基质(珍珠岩∶草炭=1.5∶1)中。
将种好苗的穴盘放入含接水盘的育苗箱中,之后放入覆盖遮阳率80%的小拱棚中,10 d后将育苗箱顶部的透气孔打开,之后每隔10 d向接水盘中注水进行浸盆,30 d后可获得移栽成活的苗。
3 讨论
建立叉叶茅膏菜组培快繁体系的首要目标是得到干净无菌的材料,本研究结果表明:叉叶茅膏菜花序外植体最佳的消毒方法组合:75%酒精30 s+0.15%氯化汞8 min+0.5%次氯酸混合液15 min。这与张国庆[20]的70%酒精30 s+0.1%氯化汞8 min、靖晶等[21]的75%酒精5 s+0.1%氯化汞5 min、杨爽等[22]的75%酒精30~60 s+0.1%氯化汞5~10 min有一定的差异。可能与本研究所用材料为花序,且为不同的品种有关。
本研究认为诱导叉叶茅膏菜产生愈伤组织的最适宜培养基:MS+6-BA 1.0 mg/L+NAA 0.1 mg/L、MS+KT 1.0 mg/L+NAA 0.1 mg/L。在低浓度的6-BA和KT培养基中,叉叶茅膏菜虽然能产生愈伤组织,但时间较长,诱导率较低;在高浓度的6-BA和KT培养基中,诱导愈伤组织的效率较高,但是愈伤组织的状态为颗粒状且颜色为紫红色,不利于下一步愈伤组织的分化。
研究不同的生长调节剂及浓度对叉叶茅膏菜愈伤组织分化的影响,6-BA、KT、ZT、TDZ都能诱导愈伤组织分化,在相同浓度的生长调节剂作用下,以ZT的效果最好,分化出的芽较健壮;在高浓度的生长调节剂作用下,分化出的芽呈黄绿色或黄色,尤其当TDZ 1.0 mg/L时,分化出的芽还出现玻璃化现象,因此,适于叉叶茅膏菜愈伤组织分化的培养基为MS+ZT 0.5 mg/L+NAA 0.1 mg/L。
4 结论
综上所述,对于叉叶茅膏菜最佳组培快繁体系的建立,最佳消毒处理方式:75%酒精30 s+0.15%氯化汞8 min+0.5%次氯酸混合液15 min;愈伤组织诱导的最适宜培养基:MS+6-BA 1.0 mg/L+NAA 0.1 mg/L、MS+KT 1.0 mg/L+NAA 0.1 mg/L;愈伤组织分化的适宜培养基:MS+ZT 0.5 mg/L+NAA 0.1 mg/L。
