磷酸二酯酶4各亚型mRNA在特应性皮炎及银屑病皮损中的表达水平及其在发病机制中的作用▲
2020-07-22吴志洪
罗 浩 吴志洪 钟 江 张 衍 陈 娜
(广西中医药大学第一附属医院皮肤科,南宁市 530023,电子邮箱:luohao1943@163.com)
磷酸二酯酶4(phosphodiesterase 4,PDE4)由4个基因编码,分别为PDE4A、PDE4B、PDE4C、PDE4D,因其能特异性水解,使细胞内环腺苷酸浓度区域化,对下行信号传导及各种细胞功能具有重要调控作用,可作为多种炎症性疾病的潜在治疗靶点,如哮喘、慢性阻塞性肺疾病、银屑病及克罗恩病等[1-3]。本研究通过检测特应性皮炎(atopic dermatitis,AD)及银屑病皮损中PDE4各亚型mRNA的表达情况,探讨其在AD和银屑病的发病机制中的作用。
1 资料和方法
1.1 临床资料 选取2017年11月至2018年9月于我院皮肤科门诊就诊的AD患者21例(AD组),银屑病患者19例(银屑病组)及于我院激光美容科手术切除皮肤组织(未见病理改变)的患者15例(对照组)。AD诊断符合Williams诊断标准[4],银屑病诊断符合寻常性银屑病的诊断标准[5]。所有研究对象近2个月内未使用抗组胺药物、类固醇皮质激素、免疫调节剂等药物,均排除心、脑、肺、肾脏器疾病及高血压等疾患。AD组男性8例,女性13例,年龄(34.85±11.43)岁;银屑病组男性12例,女性7例,年龄(37.62±13.37)岁;对照组男性4例,女性11例,年龄(35.51±10.29)岁。3组患者的性别、年龄差异均无统计学意义(均P>0.05)。本研究经我院伦理委员会批准,所有研究对象均对本研究知情了解并签署知情同意书。
1.2 方法
1.2.1 实验试剂与仪器:TRIzol购于美国Thermo公司(批号:15596-026),反转录试剂盒购于美国Thermo Fisher公司(批号:K1622),定量PCR检测试剂盒购于QIAGEN公司(批号:208054),RNA酶抑制剂购于ABI公司(批号:N8080119),DNA酶购于NEB公司(批号:M0303S),琼脂糖(批号:A610013-0250)购于上海生工公司,荧光定量PCR仪购于ABI公司(型号:7500)。
1.2.2 引物的设计与合成:从GenBank(http://www.ncbi.nlm.nih.gov/genbank)中检索下载PDE4各基因亚型的核苷酸序列,用Primer 5.0引物设计软件在保守区域进行特异性上、下游引物的设计,见表1。引物均由上海生工生物工程技术服务有限公司合成。

表1 荧光定量PCR引物基因序列
1.2.3 实时荧光定量PCR检测PDE4各亚型相对表达水平:门诊行病理活检时取部分皮肤组织(以四肢皮损为主),直径约3~4 mm。皮损标本采集后置于液氮速冻,-80℃超低温冰箱中保存备用。将冻存的皮损标本进行液氮研磨,加入1 mL TRIzol使其裂解充分后加入200 μL氯仿,用力摇15 s,静置5 min。4℃下12 000 r/min离心15 min。小心吸取上层水相,加入等量异丙醇混匀,静置10 min。4℃下12 000 r/min离心10 min,弃上清。加入1 mL 75%乙醇,使沉淀悬浮,4℃下12 000 r/min离心10 min,弃上清。干燥沉淀5 min,加入20 μL经焦碳酸二乙酯处理并经高温高压消毒的超纯水。去DNA操作:从离心管中取出上述液体2 μL,加入DNA酶0.2 μL、缓冲液1 μL、RNA酶抑制剂0.3 μL,加去酶水至10 μL,轻混匀,37℃温育30 min,75℃热变性10 min。反转录:使用反转录试剂盒将RNA样本逆转录为cDNA,反应条件为37℃ 15 min,98℃ 5 min,使酶失活后置于冰上。将逆转录好的cDNA稀释10倍后行PCR检测,反应体系:2×浓缩的实时定量PCR扩增的预混液5 μL,引物A 0.5 μL,引物B 0.5 μL,荧光染料ROX 0.05 μL,模板cDNA 1 μL,无酶水2.95 μL,总体积10 μL。反应条件:95℃预变性2 min,95℃变性5 s,60℃退火30 s,共40个循环。根据所得的Ct值,以甘油醛-3-磷酸脱氢酶为内参照,△Ct=(目的基因Ct-内参基因Ct),△△Ct=各样品ΔCt值-空白组ΔCt平均值;2-ΔΔCt计算PDE4各亚型的相对表达水平。
1.3 统计学分析 应用SPSS 23.0软件进行统计学分析。计量资料以(x±s)表示,方差齐时,多组间比较采用方差分析,两两比较采用LSD-t检验,方差不齐时,多组间和两两比较采用秩和检验;计数资料以例数或百分比表示,比较采用χ2检验。以P<0.05表示差异具有统计学意义。
2 结 果
3组患者的PDE4A、PDE4B、PDE4C、PDE4D mRNA的相对表达水平比较,差异均有统计学意义(均P<0.05)。其中,AD组患者的PDE4B、PDE4D mRNA相对表达水平高于对照组(P<0.05),而PDE4A、PDE4C mRNA相对表达水平与对照组比较,差异无统计学意义(P>0.05);银屑病组患者的PDE4A、PDE4D mRNA相对表达水平高于对照组(P<0.05),而PDE4B、PDE4C mRNA相对表达水平与对照组比较,差异无统计学意义(P>0.05);AD组与银屑病组中,AD组患者皮损中PDE4B mRNA相对表达水平呈特异性高表达,银屑病组患者皮损中PDE4A mRNA相对表达水平呈特异性高表达(P<0.05)。见表2。
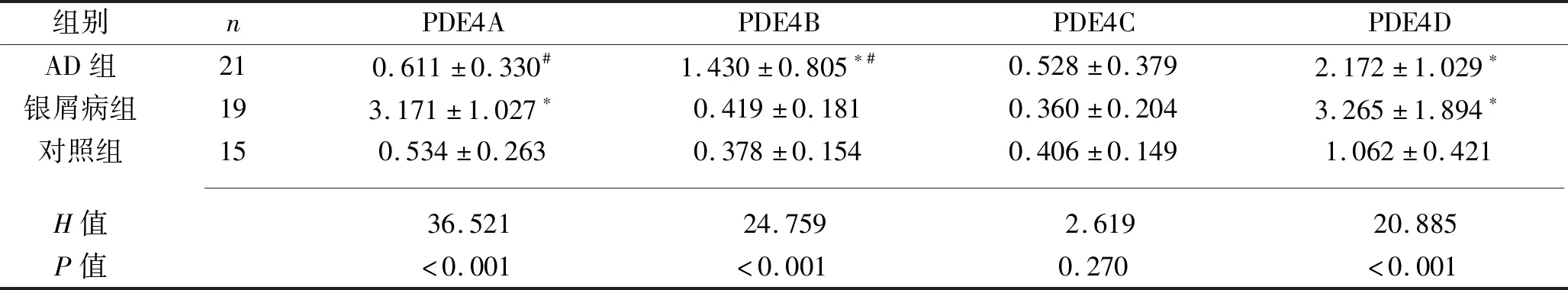
表2 3组PDE4A、PDE4B、PDE4C、PDE4D mRNA的相对表达水平(x±s)
3 讨 论
PDE4属于磷酸二酯酶的重要亚型之一,主要存在于嗜酸性粒细胞、中性粒细胞和CD4+淋巴细胞中[6]。PDE4家族由PDE4A、PDE4B、PDE4C和PDE4D这4个类似基因编码的20多个亚型组成,作为PDE家族中水解环腺苷酸的一个最大群体,在环腺苷酸信号通路中占有重要地位。环腺苷酸作为细胞内的第二信使,它的信号传递过程是通过环腺苷酸空间降解后形成细胞内浓度差异,随后细胞内环腺苷酸与环腺苷酸效应分子(如蛋白激酶A和环腺苷酸直接激活的交换蛋白Epac)结合,调节不同的细胞过程[7]。PDE4通过水解环腺苷酸,可以控制多种细胞反应,在哮喘、慢性阻塞性肺疾病、中枢神经系统疾病、银屑病等疾病中发挥重要作用[6,8]。然而,PDE4各亚型的功能作用尚未得到证实,目前国内外对PDE4各亚型的研究多集中在神经系统领域。Pérez-Torres等[9]对人脑组织进行原位杂交免疫组化分析发现,PDE4A、PDE4B、PDE4D广泛分布在大脑皮层、海马、脑干、丘脑和基底细胞节等结构中,且在大脑不同结构中的分布不同,PDE4C只局限地分布在皮层、小脑、丘脑等,这种分布差异表明PDE4各亚型可能具有不同的作用。Barber等[10]的研究结果显示,与健康人相比,慢性阻塞性肺疾病患者血液单核细胞和中性粒细胞中的PDE4A、PDE4B和PDE4D的转录水平明显增高,PDE4C转录水平低于PDE4其他亚型的转录水平。Landells等[11]的研究证实,除PDE4C外,PDE4A、PDE4B和PDE4D在正常人和哮喘患者的CD4+和CD8+T淋巴细胞中大量存在。这些研究表明,在多种免疫细胞中(如嗜碱性细胞、嗜酸性细胞、T细胞及单核细胞等)的PDE4可能以PDE4A、PDE4B和PDE4D这3个亚型为主。
Schafer等[8]通过检测PDE4亚型在银屑病外周血单核细胞及皮损中的分布情况,并评估成纤维细胞中PDE4/CD271复合物的功能,发现银屑病患者外周血单核细胞中PDE4B及PDE4D mRNA表达水平较健康人群升高,在银屑病病灶皮肤组织中,特别是内皮细胞与成纤维细胞中,PDE4A及PDE4D mRNA的表达增加,表明PDE4及PDE4/CD271复合物在银屑病成纤维细胞的功能调节中起重要作用。本研究结果显示,银屑病组患者皮损中PDE4A、PDE4D mRNA相对表达水平高于对照组(P<0.05),这与Schafer等[8]的研究结果相似。Huston等[12]研究证实PDE4A5基因的过表达可以保护成纤维细胞免受细胞凋亡。而成纤维细胞表型和功能的改变在银屑病的发生发展过程中起重要作用[13-14]。本研究中,银屑病皮损中PDE4A及PDE4D mRNA相对表达水平增高可能是阻止成纤维细胞凋亡,进而控制细胞的过度增生,维持表皮增生与凋亡动态平衡的一个保护性变化。
目前,皮肤屏障功能障碍是AD发病的首要机制。AD表皮的脂肪酸、胆固醇及神经酰胺的合成减少,会导致角质层的水分减少和皮肤屏障功能降低。皮肤的屏障功能还与皮肤炎症有密切关系,当皮肤屏障功能受损时,大量免疫细胞如巨噬细胞、单核细胞、淋巴细胞、嗜酸性粒细胞、树突状细胞等的聚集和浸润会促使多种促炎介质释放,从而导致皮肤炎症反应[15]。而PDE4B作为PDE4炎症调控的主要亚型,在激活肿瘤坏死因子α反应中起着至关重要的作用,研究显示,PDE4B缺陷小鼠在脂多糖刺激后出现PDE4B mRNA表达增高,PDE4活性增加,肿瘤坏死因子α分泌减少[16],表明脂多糖激活PDE4B基因从而刺激肿瘤坏死因子α的分泌是构成有效免疫反应所必需的调节过程。国外多项研究发现PDE4D与整合素5结合可以减弱环腺苷酸/蛋白激酶A信号传导,激活内皮细胞炎症反应,且小鼠体内敲除PDE4D后,动脉粥样硬化易发部位的炎症反应减弱,表明整合素5与PDE4D的相互作用可能与细胞外基质的重塑及炎症密切相关[17-19]。PDE4B和PDE4D不仅具有重要的抗炎作用,其在脂肪代谢、蛋白质合成中也起重要作用。研究显示,脂肪细胞中PDE3B和PDE4D的过表达可导致基础脂解率降低及胰岛素诱导的脂解抑制作用增强,进而导致糖尿病代谢调节改变[20]。Avila等[21]发现,酒精能够诱导肝脏PDE4尤其是PDE4B的表达增加,阻断环腺苷酸信号传导,肝脏细胞更易发生脂肪酸氧化损伤和脂肪变性。本研究中,AD组患者皮损组织中的PDE4B、PDE4D mRNA相对表达水平高于对照组(P<0.05),因此我们推测AD组中PDE4B及PDE4D mRNA相对表达水平特异性增高可能涉及表皮炎症和脂质代谢过程。此外,AD组和银屑病组相比,AD组患者皮损组织中的PDE4B mRNA相对表达水平呈特异性高表达,银屑病组患者皮损组织中的PDE4A mRNA相对表达水平呈特异性高表达(P<0.05),提示PDE4A与细胞的增殖和凋亡密切相关,PDE4B与细胞炎症和脂质代谢密切相关;而PDE4D在AD组与银屑病组中的表达都明显增高,提示PDE4D可能在调控表皮细胞增殖和炎症反应中都发挥一定作用。
综上所述,PDE4各亚型mRNA在AD及银屑病皮损组织中的表达水平呈差异性,这种差异性表达可能在AD和银屑病的发生及病情演变过程中发挥重要作用。目前已有多种PDE4抑制剂进入临床实验阶段,但由于部分患者出现恶心、呕吐等副反应而被迫中止使用,而针对PDE4亚型的特异性抑制剂可能可以减轻或消除PDE4抑制剂的副反应,具有广阔的市场前景。
