质子守恒书写的“管道法”模型认知
2020-07-22杨文月
杨文月
(广东省广州市第十六中学 510000)
一、问题的提出
离子浓度关系比较是高考的高频考点和研究热点,也是学生的难点.三大守恒中的质子守恒在平时的教学中常常被当做电荷守恒和物料守恒式的数学叠加“副产物”.笔者认为,图示其实是一种直观的可视化的表达方式,只是以往的研究往往从某种溶液类型出发,且没有清晰地从本质上阐明图示模型与质子守恒意义的关系.基于此,笔者提出了“管道法”模型,解释其与质子守恒的关系,并用该模型分析各种类型的溶液.旨在培养学生“宏观辨识和微观探析”和“模型认知”的化学核心素养.
二、模型认知
1.质子守恒的意义
根据酸碱质子理论,酸是能给出质子的物质,碱是能接受质子的物质.当酸碱反应达到平衡时,酸给出质子的量(mol)应等于碱所接受的质子的量,即酸失去质子后的产物与碱得到质子后的产物在浓度上必然有一定的关系,这种关系称为质子平衡方程,简写为PBE(Proton Balance Equation).利用这种酸碱得失质子的等衡关系可以直接写出PBE.
2.“管道法”模型表达质子守恒(PBE)步骤
(1)在“管道”中写出溶液中大量存在并参与质子转移反应的微粒,通常就是初始酸碱组分,包括溶剂分子.(2)在“管道”两边分别列出管道中微粒得失质子的产物及其得失质子的物质的量.(3)根据得失质子的量相等的原则写出PBE.如图1所示.
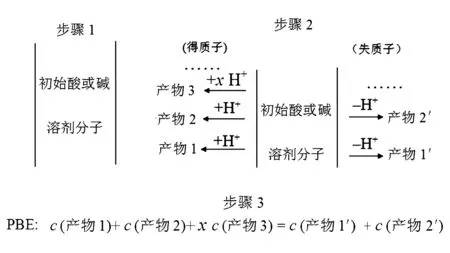
图1
说明:在正确的PBE中应不包括“管道”中的微粒,也不含与质子转移无关的组分.
①单一溶质的“管道法”
例1Na2CO3溶液的PBE.


图2

②混合溶液的“管道法”
例20.1mol·L-1CH3COOH溶液与0.1mol·L-1CH3COONa溶液等体积混合的PBE.
解析分析发现,CH3COOH失去质子后产物为CH3COO-,CH3COO-失去质子后产物为CH3COOH.之前已说明,在正确的PBE中应不包括“管道”中的微粒.所以不能将CH3COOH和CH3COO-放在同一个“管道”中,而应该将其放在两个“管道”中,并考虑“管道”中初始酸碱的平衡浓度的比例关系,然后再加和.
图3等浓度CH3COOH和CH3COONa溶液PBE “双管道法”模型在图3中,左图的PBE为:c(H+)=c(OH-)+c(CH3COO-) ①;右图的PBE为:c(H+)+c(CH3COOH)=c(OH-) ②.且“管道”中初始溶质CH3COOH和CH3COO-的浓度比为1∶1,所以将两式相加①+②,即为该混合溶液中的PBE:
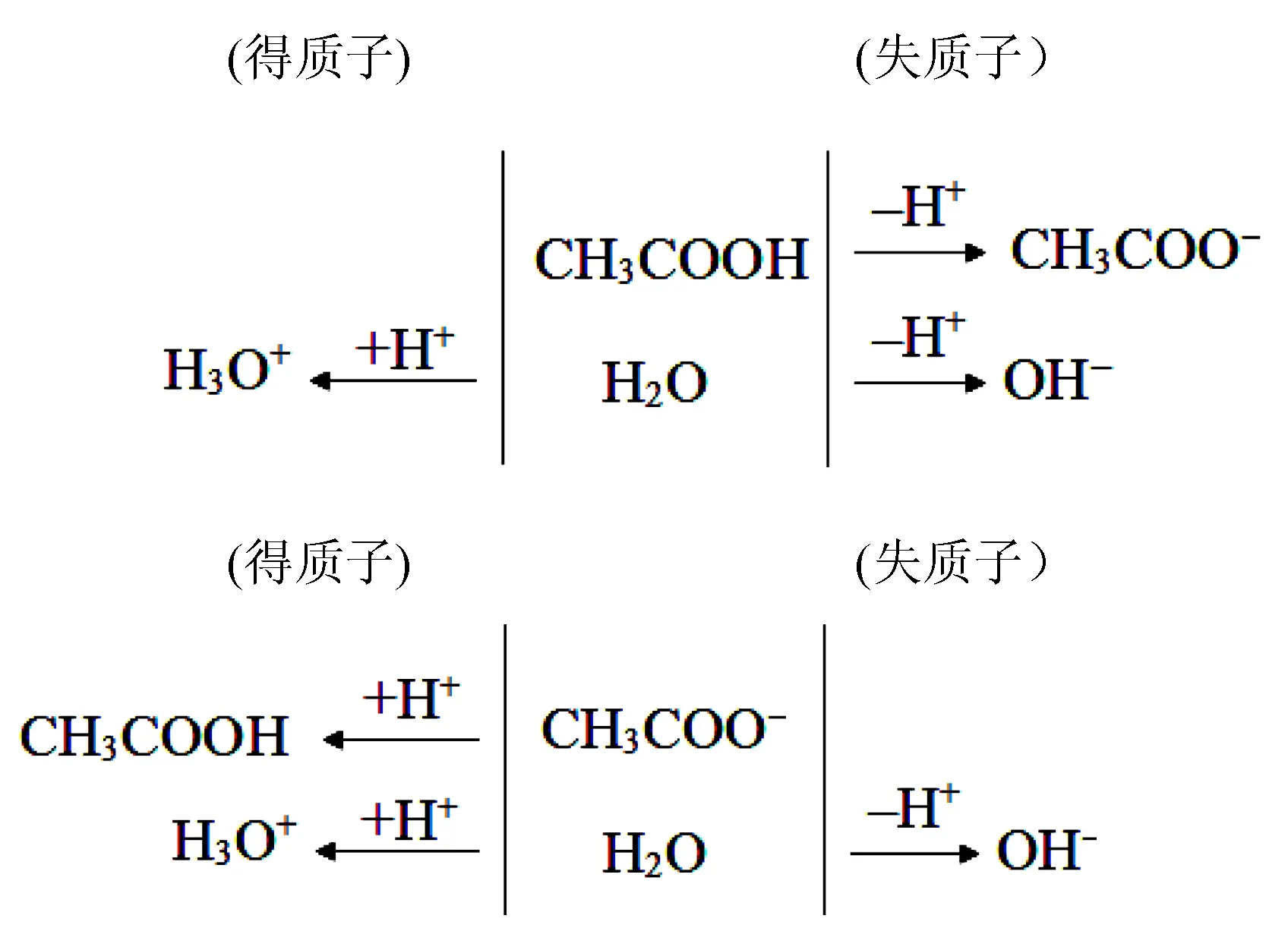
图3
2c(H+)+c(CH3COOH)=2c(OH-)+c(CH3COO-)
例30.2mol·L-1NaHC2O4溶液与0.1mol·L-1Na2C2O4溶液等体积混合后的PBE.
解析质子得失产物和初始酸碱相互重合,故采用“双管道”法,由于浓度比不同,在最后加和的时候考虑进去.

图4
例40.2mol·L-1NaCN溶液与0.1mol·L-1Na2CO3溶液等体积混合后的PBE.


图5
根据得失质子的量等衡的原则,该混合溶液的PBE为:
3.“双管道”法的数学支撑
以CH3COOH和CH3COONa溶液为例,“双管道法”模型可以通过数学角度演变计算而转化行成.分析如下:
如图6所示,该溶液中微粒之间的关系满足以下等式:
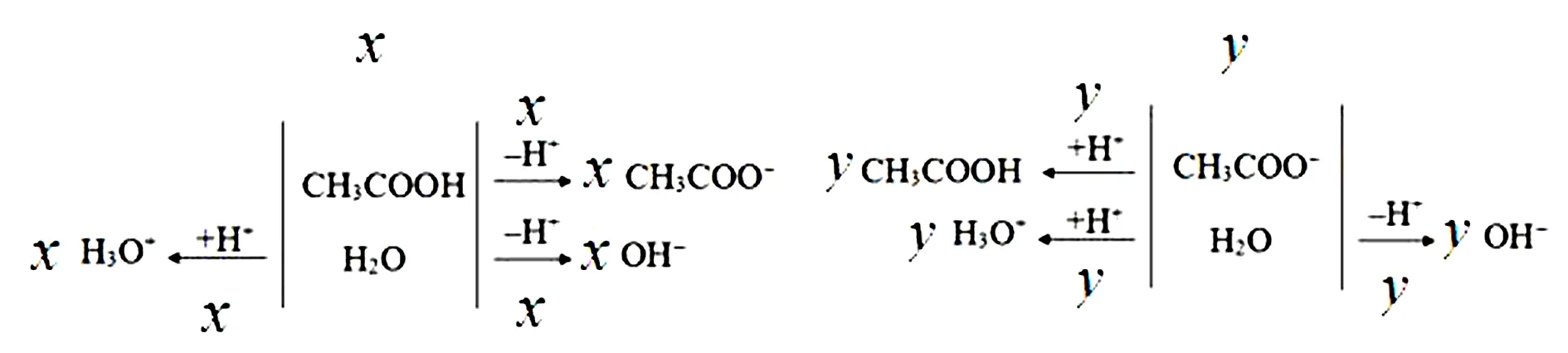
图6
c(Na+)=y/(x+y)[c(CH3COOH)+c(CH3COO-)](1)
c(Na+)+c(H+) =c(CH3COO-)+c(OH-) (2)
将(1)代入(2),得:
y/(x+y)c(CH3COOH)+y/(x+y)c(CH3COO-)+c(H+)=c(CH3COO-)+c(OH-)
(3)
化简:y/(x+y)c(CH3COOH)+c(H+)
=x/(x+y)c(CH3COO-)+c(OH-)
通分:yc(CH3COOH)+(x+y)c(H+)
=xc(CH3COO-)+(x+y)c(OH-)
