米脂小米多糖的提取及其体外抗氧化性能*
2020-07-22高晶晶陈锦中刘丽娜
高晶晶,慕 苗,陈锦中,刘丽娜
(榆林学院 化学与化工学院,陕西 榆林 719000)
小米具有很高的营养价值,含有丰富的碳水化合物、脂肪、维生素、蛋白质和氨基酸等[1-2]。陕北米脂小米因其营养更为丰富成为中国著名的小米之一[3]。据文献报道,米脂小米含有更多的蛋白质和脂肪,更是含有8种人体必需的氨基酸,营养比例更加适合[4-5]。
多糖是广泛存在于动植物体内的高分子碳水化合物[6-7],具有调节免疫、抑制肿瘤生长、延缓衰老、降血糖、抗辐射、抗菌抗病毒、保护肝脏等作用[8-14]。作者以陕北米脂小米为研究对象,对其中的多糖进行提取研究,利用单因素实验和响应面优化法对提取条件进行优化,得到了米脂小米多糖的提取工艺路线,然后对多糖进行了体外抗氧化性能测定,为小米多糖的后续应用研究提供了一定理论基础[15]。
1 实验部分
1.1 原料、试剂与仪器
陕北米脂小米:购自陕西米脂县。
浓硫酸:四川西陇科学有限公司;乙醇、苯酚:天津市瑞金特化学品有限公司;抗坏血酸(Vc)、1,1-二苯基-2-三硝基苯肼(DPPH):国药集团化学试剂有限公司;葡萄糖标准品:上海金穗生物科技有限公司;水杨酸、邻苯三酚、FeSO4:天津市科密欧化学试剂有限公司;H2O2、浓HCl:天津市富宇精细化工有限公司;以上所用试剂均为分析纯。
电子天平:FA1004,上海良平仪器仪表有限公司;紫外可见分光光度计:UV-1900,日本岛津公司;医用离心机:TL80-2,姜堰市天力医疗器械有限公司;集热式恒温加热磁力搅拌器:DF-101S,北京科伟永兴有限公司。
1.2 实验方法
1.2.1 多糖含量的测定及葡萄糖标准曲线的绘制
多糖的检测采用苯酚-硫酸法在490 nm处测其吸光度值[16]。配制质量浓度分别为0、20、30、40、50、60、70、80 μg/mL的葡萄糖标准品溶液,各取2 mL,分别加入1 mL质量分数为5%苯酚溶液,立即加入5 mL浓硫酸,混合均匀静置30 min,待冷却后,在490 nm处测吸光度值[17]。
1.2.2 多糖提取率的计算
多糖提取率计算见式(1)。
η=ρ×V×Nm×100%
(1)
式中:η为小米多糖的提取率,%;ρ为检测液多糖质量浓度,mg/mL;V为粗多糖溶解定容后的总体积,L;m为原料小米质量,g;N为稀释倍数。
1.2.3 单因素实验
小米预处理:将小米与w(乙醇)=95%溶液混合于三口烧瓶中,设置温度为50 ℃,水浴加热3 h进行脱脂,后晾干备用。
准确称取10 g脱脂后的小米置于三口烧瓶中,加入一定量的蒸馏水,在恒温水浴下搅拌,提取一定时间后,过滤,取上清液,加入3倍体积w(乙醇)=95%溶液进行醇沉,4 500 r/min离心30 min,取沉淀。溶解沉淀并定容,用苯酚硫酸法检测多糖的含量,计算多糖提取率。
1.2.4 响应面优化实验
单因素实验只能体现出各个因素单独对提取率的影响,而响应面优化法可以得出各个因素间的交互作用对提取率的影响[18]。因此,综合单因素实验结果,选提取时间、搅拌速率、V(提取液)∶m(小米)(以下简称“液料比”)3个对多糖提取率影响较大的因素,根据Box-Benhnken设计的基本原理[19-21],进行三因素三水平的响应面实验设计,并对实验数据进行分析,得到该提取过程的数学模型。
1.2.5 小米多糖抗氧化性测定
1.2.5.1 对1,1-二苯基-2-三硝基苯肼自由基(DPPH·)清除率的测定
配制浓度为0.2 mmol/L DPPH·无水乙醇溶液,置于棕色瓶中,现配现用。取经分离纯化后的小米多糖配制成质量浓度分别为0.02、0.04、0.06、0.08、0.10 mg/mL的溶液,取不同质量浓度待测液各2 mL,加入DPPH·乙醇溶液2 mL,摇匀,避光静置30 min,分光光度计于517 nm下测定其吸光度值。同时还需做空白对照及同条件下Vc的DPPH·清除率的测定[22]。具体计算见公式(2)。
X=(1-A0-A1A2)×100%
(2)
式中:X为DPPH·清除率,%;A0为小米多糖和DPPH·混合液的吸光度值;A1为小米多糖和空白溶剂(无水乙醇)混合液的吸光度值;A2为DPPH·溶液和空白溶剂混合液的吸光度值。
1.2.5.2 对羟基自由基清除率的测定
取一定量小米多糖冻干粉配制成质量浓度为0.2、0.4、0.6、0.8、1.0 mg/mL的多糖溶液。取2 mL 1.8 mmol/L FeSO4和2 mL水杨酸各5份置于不同试管中,摇匀后分别加入上述不同质量浓度的样品2 mL,最后各加入质量分数为0.3% 的H2O22 mL,37 ℃水浴下反应30 min,分光光度计于510 nm下测定其吸光度值。同时还需做空白对照及同条件下Vc的羟基自由基清除率的测定[23]。具体计算见公式(3)。
Y=A0-A1A0×100%
(3)
式中:Y为羟基自由基清除率,%;A0为空白对照的吸光度值;A1为多糖溶液的吸光度值。
1.2.5.3 对超氧阴离子清除率的测定
取一定量的小米多糖冻干粉配制成质量浓度分别为0.1、0.2、0.3、0.4、0.5 mg/mL的溶液各1 mL,各加入浓度为0.05 mol/L的Tris-HCl缓冲溶液(pH=8.2)3 mL,置于30 ℃恒温水浴20 min,各加入7 mmol/L邻苯三酚3 mL,摇匀,反应4 min后,加入1 mL浓盐酸终止反应。分光光度计于320 nm下测其吸光度值。同时还需做空白对照及同条件下Vc的超氧阴离子清除率的测定[24]。具体计算见公式(4)。
Z=(1-A0-A1A2)×100%
(4)
式中:Z为超氧阴离子清除率,%;A0为多糖溶液的吸光度值;A1为以H2O代替邻苯三酚的吸光度值;A2为以H2O代替多糖溶液的吸光度值。
2 结果与分析
2.1 葡萄糖标准曲线
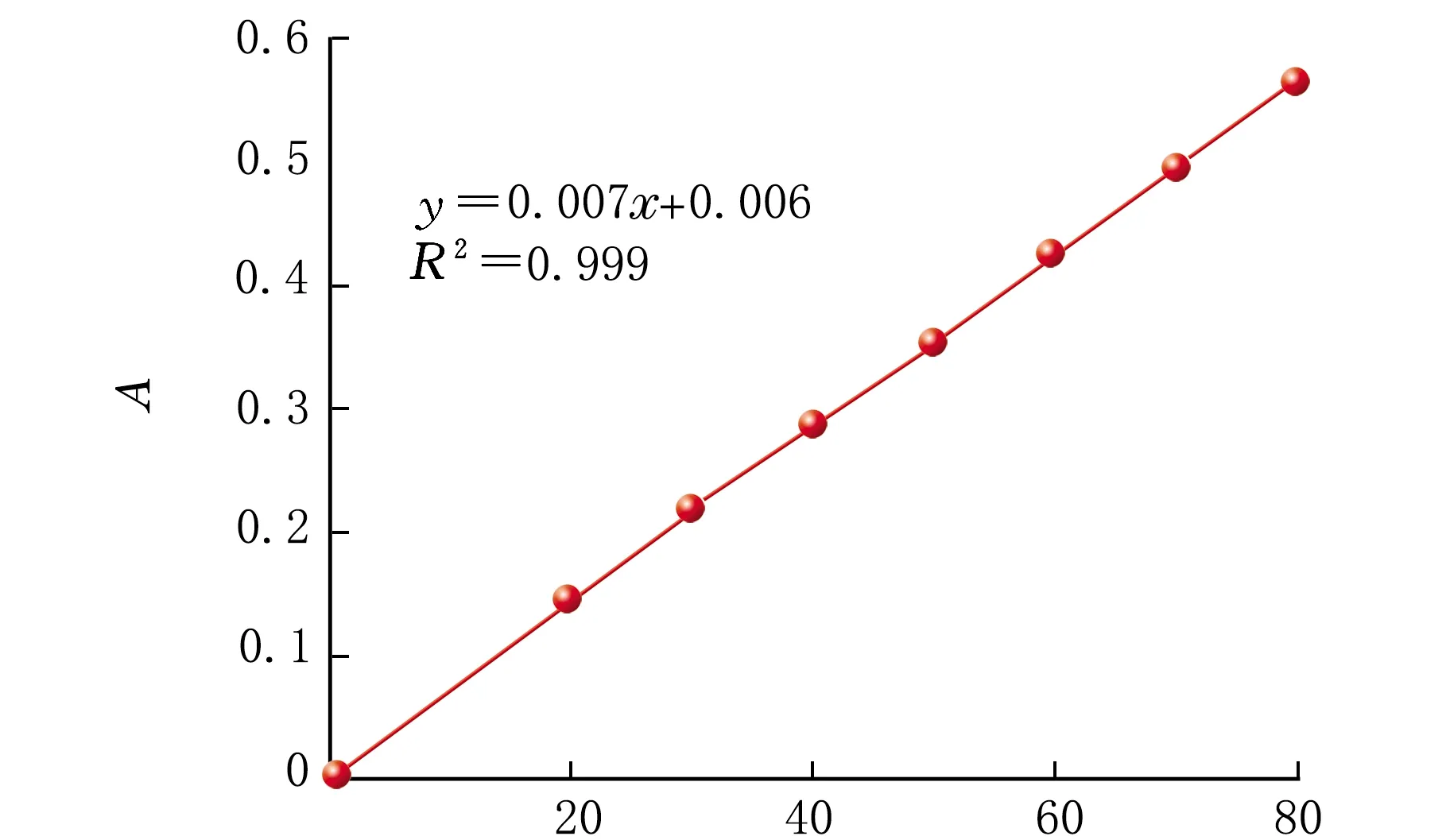
葡萄糖标准曲线见图1。
ρ(葡萄糖)/(μg·mL-1)
由图1可知,A与ρ(葡萄糖)线性关系良好。
2.2 单因素实验结果
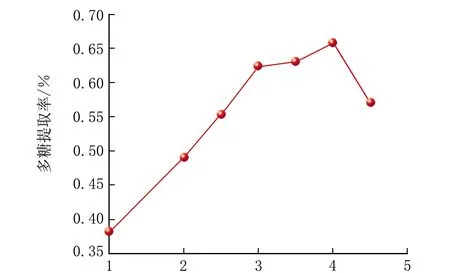
各影响因素对多糖提取率的影响见图2。
由图2a可知,多糖提取率随着提取时间的增加而增大,4 h时提取率最大,之后随着时间的增加提取率逐渐减小。因为用热水浸提时多糖从小米的内部由固相传递至液相需要一段较长的时间,在4 h后,多糖的稳定性下降,一部分多糖分解,导致多糖提取率反而降低[25]。因此,确定提取时间为4 h。由图2b可知,多糖提取率随温度的升高增加,因为温度的升高可以加快分子间的运动使物质的黏度减小,传质阻力减小,物质扩散系数增大,所以传质速度逐渐变大,在50 ℃达到了最大值。之后多糖提取率随着温度的升高反而减小,是因为温度的继续升高会导致部分多糖分解[26]。因此,确定最佳提取温度为50 ℃。由图2c可知,多糖的提取率随着液料比的增加而增加,在液料比为20∶1 mL/g时多糖的提取率达到最高,随着液料比的继续增加,多糖的提取率反而降低,说明过多的提取液反而不利于提取,因此,确定最佳液料比为20∶1 mL/g。由图2d可知,随着搅拌速率的增加,多糖的提取率呈上升趋势,说明适当的增加搅拌速率对多糖的提取有一定的加强作用,在30 r/min后,多糖的提取率变化不大,基本上趋于平稳,说明搅拌的加强作用已经不明显。因此,确定搅拌速率为30 r/min。
提取时间/ha 提取时间对提取率的影响
2.3 响应面优化实验结果
2.3.1 响应面优化实验结果及分析
以提取率为响应值R,根据单因素实验结果选出提取时间(A)、搅拌速率(B)和液料比(C)这3个对提取率影响较大的因素进行响应面优化设计,设计因素与水平见表1,实验设计及实验结果见表2,多糖提取模型的建立及方差分析见表3。

表1 设计因素与水平编码表

表2 Box-Benhnken实验设计与多糖提取率
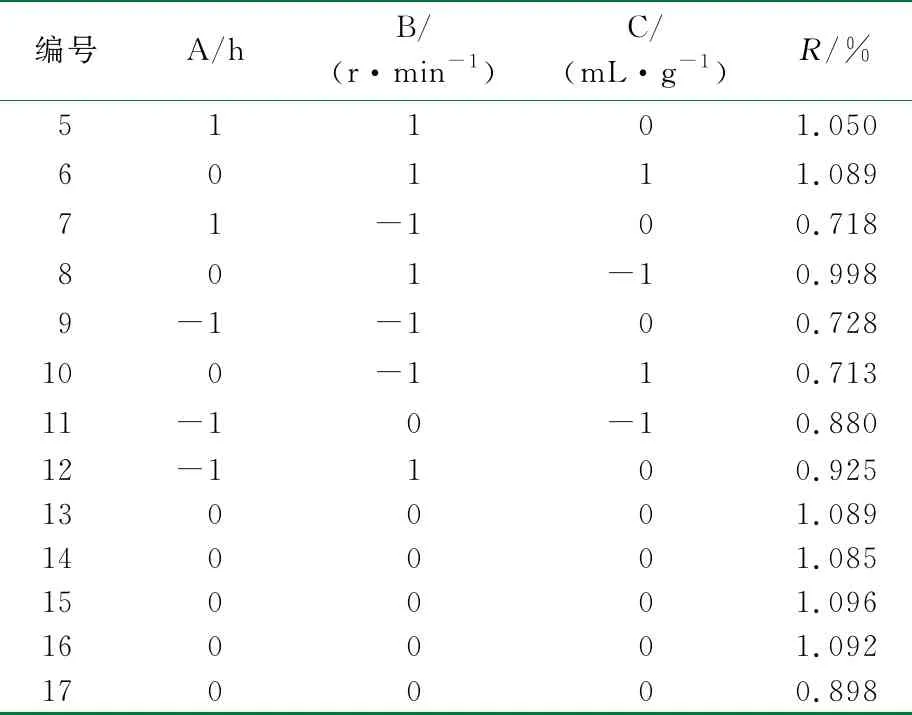
续表
由表3可知,响应面优化法所拟合的陕北小米多糖提取模型为显著(P=0.008 6<0.01),该模型失拟项P=0.794 4>0.01为不显著,说明该模型误差小,用于该提取过程是科学合理可靠的。由模型的P值可知(P值越小,说明该项对提取率的影响越大),X2和X22是显著的影响因素,因此,搅拌速率对提取率起着关键的作用,搅拌速率的轻微变化都会对小米多糖提取率有较大的影响[27]。不显著的影响因素为X1、X3、X1X2、X1X3、X2X3、X21、X23,根据P值的比较可知搅拌速率影响程度大于提取时间影响程度大于液料比影响程度。
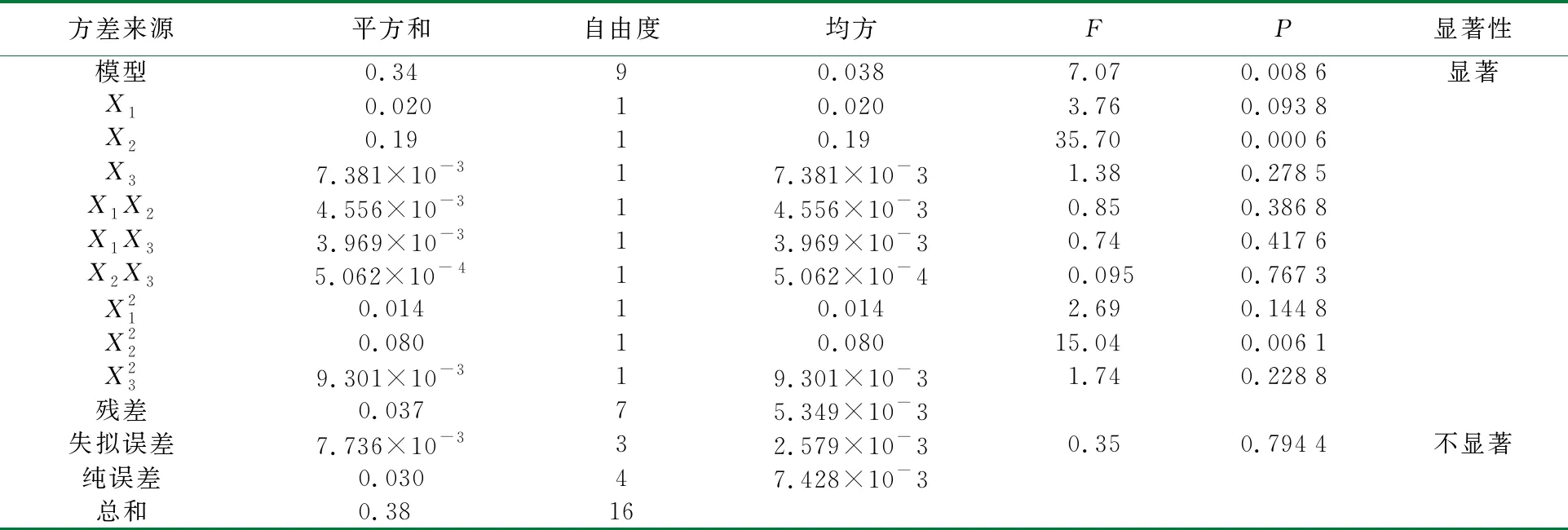
表3 陕北小米多糖提取模型方差分析
对以上的数据进行分析与拟合可以得到该提取模型的回归方程为:
Y=1.05+0.050X1+0.15X2+0.030X3+0.034X1X2+0.032X1X3+0.011X2X3-0.058X21-0.14X22-0.047X23
2.3.2 各因素间交互作用分析
根据响应面软件可以得到各因素间交互影响的立面图,见图3~图5。立面图中越陡峭的一方其对提取的影响越大。由图3可知,搅拌速率对陕北小米多糖提取率的影响大于提取时间的影响;由图4可知,提取时间的影响略大于液料比的影响;图5可知,且小米多糖提取率的影响要明显大于液料比的影响。由此可得,搅拌速率对陕北小米多糖的提取率影响最大,其次是提取时间和液料比,与方差分析得出的结论一致。
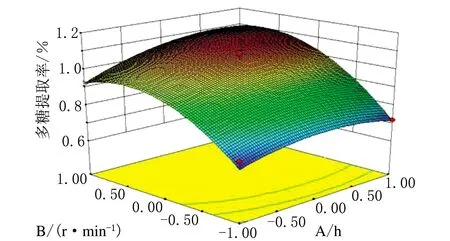
图3 提取时间和搅拌速率交互作用对多糖提取率的影响
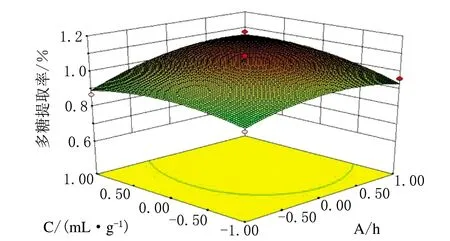
图4 提取时间和液料比交互作用对多糖提取率的影响
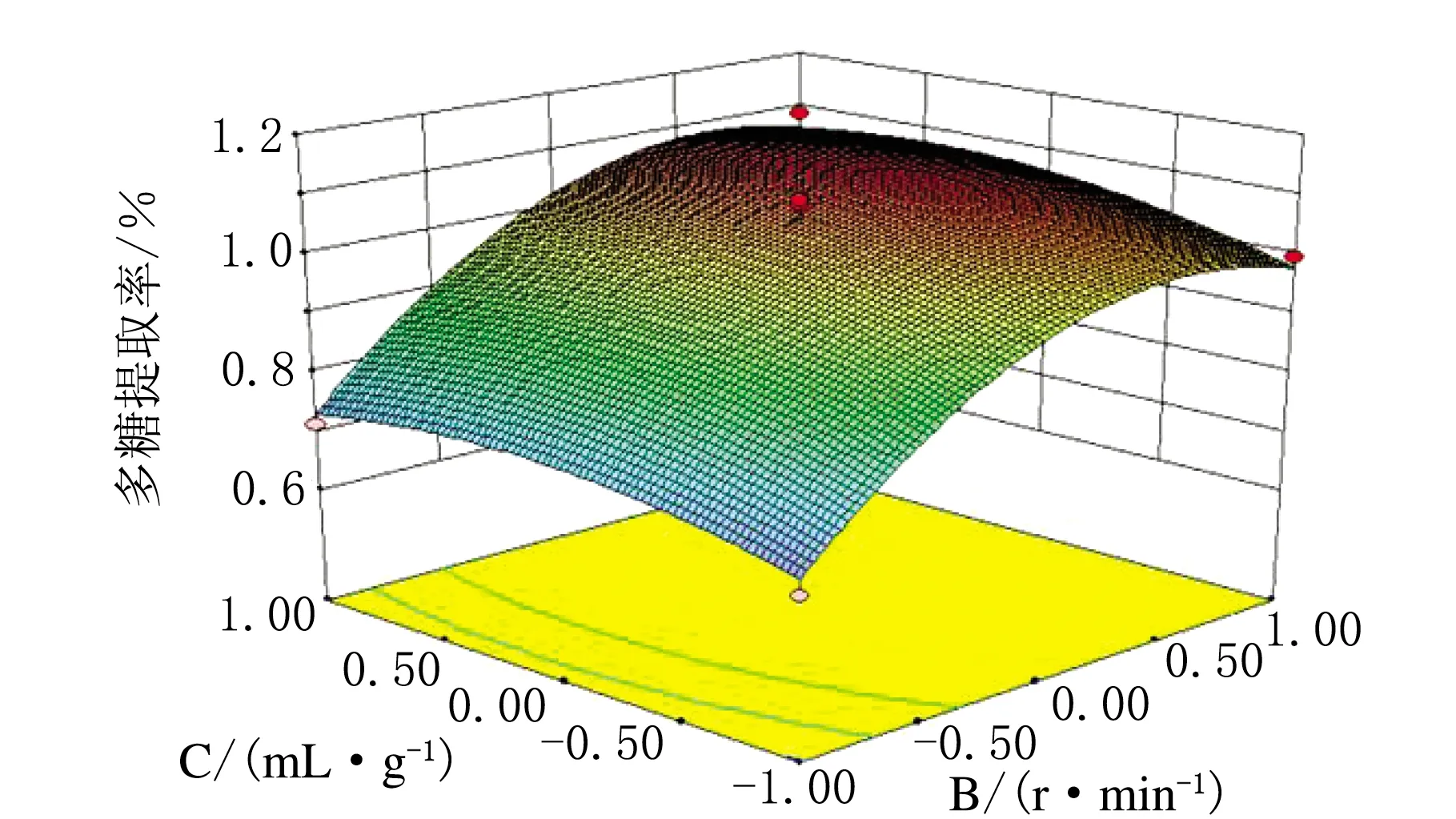
图5 液料比和搅拌速率交互作用对多糖提取率的影响
2.3.3 最优条件预测及验证
根据响应面得到的提取模型可以预测最佳提取时间为4.3 h,搅拌速率为36 r/min,液料比为20∶1 mL/g,该条件下预测陕北小米多糖提取率为1.051 4%。为了验证响应面优化实验的准确性,进行了3组平行验证实验,得出陕北小米多糖的平均提取率为1.046 7%,与预测值1.051 4%接近,证明上述响应面优化实验是准确可靠的。
2.4 小米多糖体外抗氧化性实验结果
2.4.1 对DPPH·清除率的测定结果
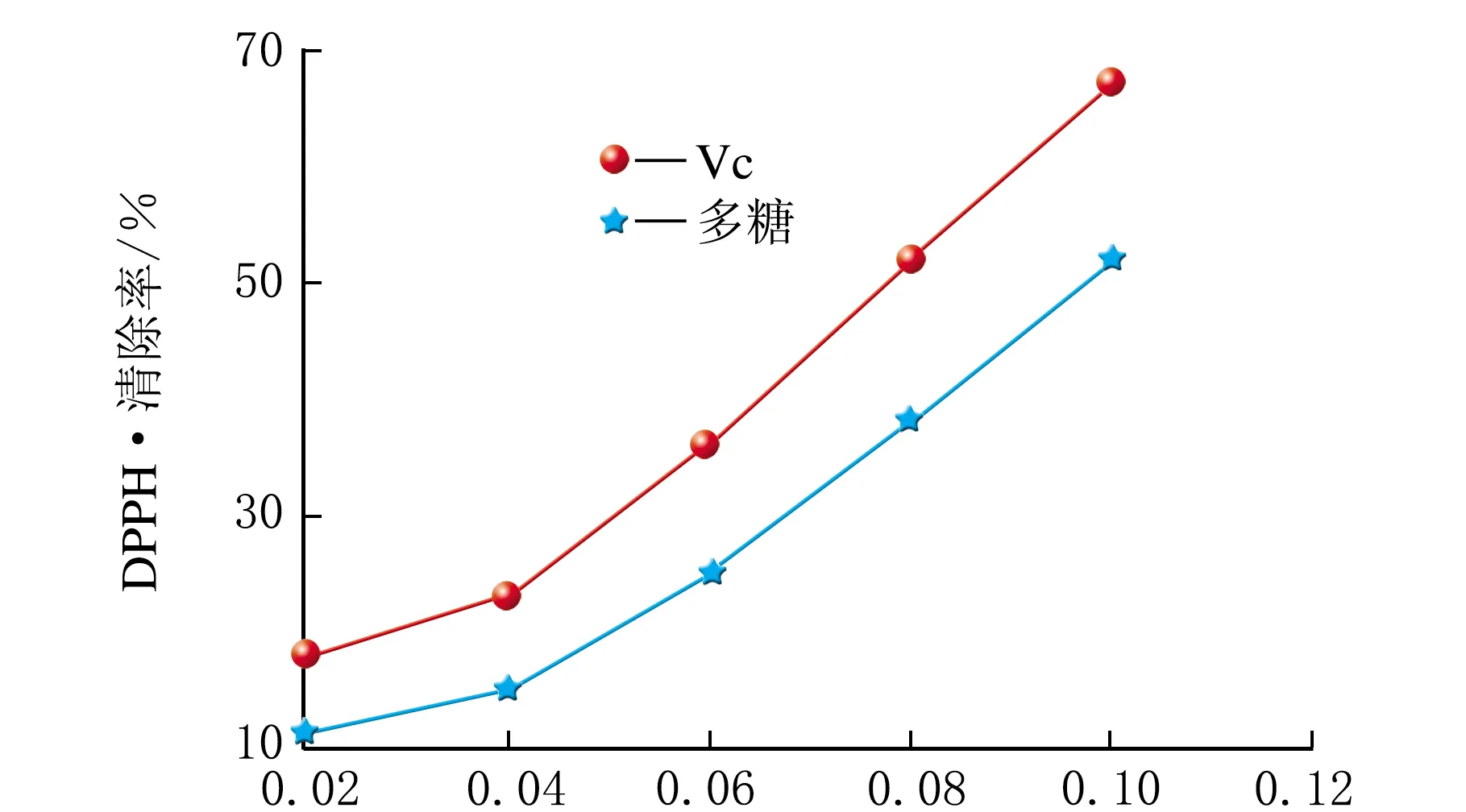
ρ(小米多糖)及ρ(Vc)对DPPH·的清除作用见图6。
ρ/(mg·mL-1)
由图6可知,ρ(Vc)和ρ(小米多糖)增加的同时,DPPH·的清除率也在增加。质量浓度相同时,Vc对DPPH·的清除率均要高于小米多糖。小米多糖清除DPPH·的IC50值为0.095 mg/mL。
2.4.2 对羟基自由基清除率的测定结果
小米多糖及Vc对羟基自由基的清除作用见图7。
由图7可知,随着ρ(Vc)和ρ(小米多糖)的增加,羟基自由基的清除率也在随之增加。质量浓度相同,Vc对羟基自由基的清除率要高于小米多糖。小米多糖清除羟基自由基的IC50值为0.78 mg/mL。
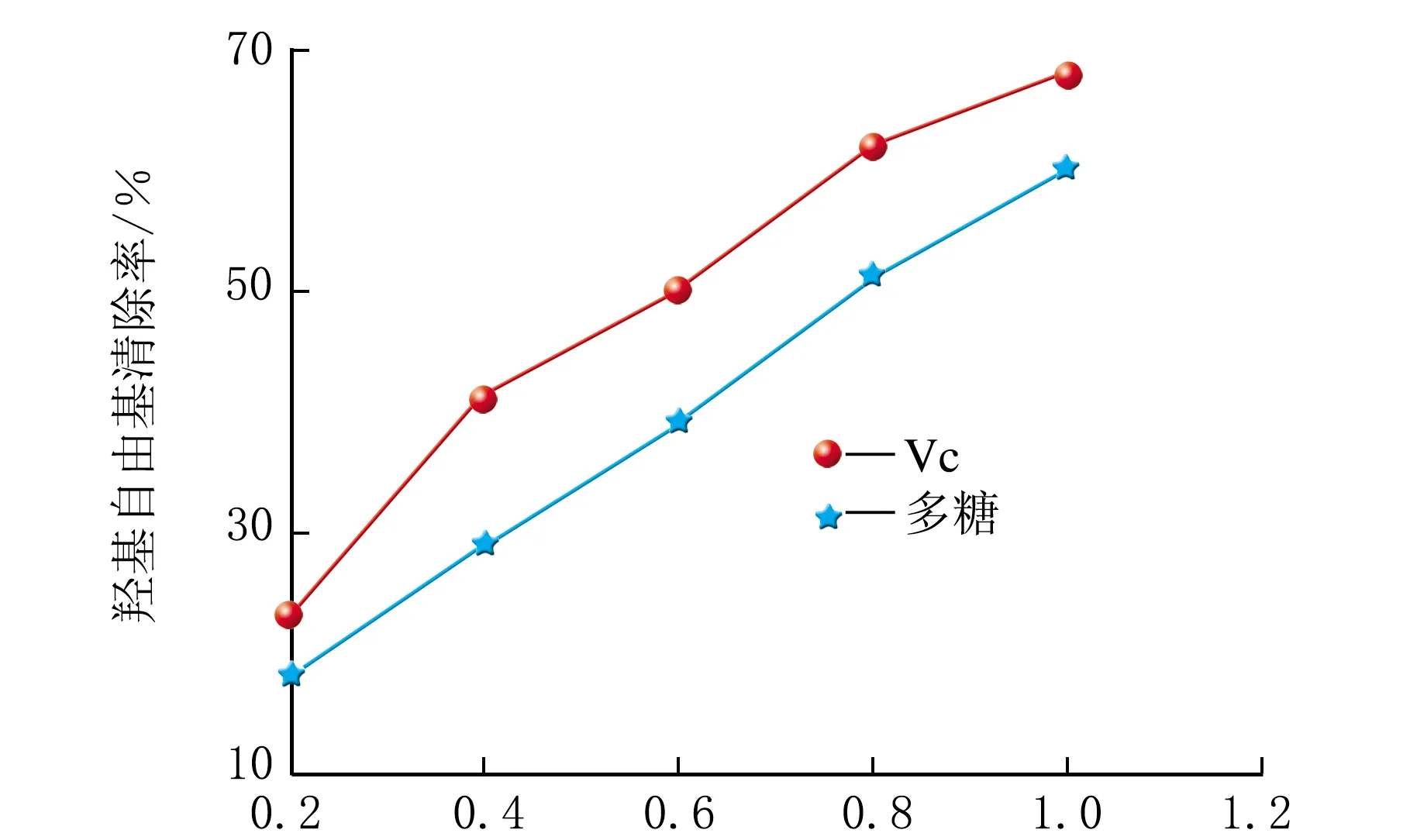
ρ/(mg·mL-1)
2.4.3 对超氧阴离子清除率的测定结果
ρ(小米多糖)及ρ(Vc)对超氧阴离子的清除作用见图8。
由图8可知,随着ρ(小米多糖)和ρ(Vc)的增加,对超氧阴离子的清除率也在增加。在超氧阴离子清除的实验中,Vc的清除率要远远大于小米多糖的清除率。小米多糖清除超氧阴离子的IC50值为0.42 mg/mL。
3 结 论
对陕北米脂小米中多糖进行了提取工艺研究,采用单因素法和响应面优化法相结合的方法对提取条件进行了优化,得到优化的提取工艺路线为提取温度50 ℃,提取时间4.3 h,搅拌速率36 r/min,液料比20∶1 mL/g,在该条件下陕北小米多糖的平均提取率为1.046 7%。陕北小米多糖的体外抗氧化性实验表明,小米对DPPH·、羟基自由基、超氧阴离子均具有一定的清除作用,其IC50值分别为0.095,0.78,0.42 mg/mL,说明其具有一定的抗氧化性,且小米多糖的抗氧化性能与其质量浓度有着一定的量效关系,质量浓度越高,抗氧化性越强。
