超声引导ESP阻滞、TAP阻滞在腹腔镜胆囊切除术术后镇痛中的应用对比观察
2020-07-22蔡少彦陈超张蕾魏旸郑良杰郭春明
蔡少彦,陈超,张蕾,魏旸,郑良杰,郭春明
汕头市中心医院,广东汕头515031
腹腔镜胆囊切除术(LC)是目前应用最广泛的腹腔镜手术之一,LC的围术期镇痛问题也备受关注。随着超声引导下区域神经阻滞的发展,越来越多的躯体周围神经阻滞技术被成功应用于围术期镇痛,其中超声引导下竖脊肌平面(Erector spinae plane,ESP)阻滞[1]及腹横肌平面(Transversus abdominis plane, TAP)阻滞[2]均被报道可用于上腹部手术镇痛,但国内尚无比较两者在LC术后镇痛效果的报道,为此我们比较了超声引导下ESP阻滞与TAP阻滞在腹腔镜胆囊切除术术后镇痛的有效性及安全性,现报告如下。
1 资料与方法
1.1 临床资料 选择2019年6月~2019年12月我院腹腔镜胆囊切除术择期患者90例。纳入标准:①年龄 26~92岁;②体质指数(BMI)20~30 kg/m2;③美国麻醉医师学会(ASA)分级Ⅰ~Ⅱ级;④心功能Ⅰ级、Ⅱ级(NYHA分级)。排除标准:①凝血功能障碍者;②对局麻药或者阿片类药物过敏者;③拒绝行ESP或者TAP阻滞患者;④慢性疼痛、精神病史者;⑤严重心脑血管疾病、肝肾功能不全者;F⑥慢性支气管炎、COPD 疾病病史者;⑦出现严重手术并发症导致住院时间延长者。90例患者按随机数字表法随机分入ESP组、TAP组和P组。ESP组中男14例、女16例,年龄(54.067±13.154)岁,BMI(23.577±3.417)kg/m2,ASA分级为Ⅰ级6例、Ⅱ级24例;TAP组中男14例、女16例,年龄(52.800±15.923)岁,BMI(23.496±2.648)kg/m2,ASA分级为Ⅰ级4例、Ⅱ级26例;P组中男10例、女20例,年龄(54.933±13.409)岁,BMI(23.821±2.724)kg/m2,ASA分级为Ⅰ级5例、Ⅱ级25例,三组性别、ASA分级、年龄、BMI等一般资料具有可比性。本研究经过汕头市中心医院伦理道德委员会准许,入组患者均签署知情同意书。
1.2 超声引导下神经阻滞方法 术前三组患者均建立静脉通路,常规监测血压(NBP)、心率(HR)、心电图(ECG)、血氧饱和度(SpO2) ,维持温度22~25 ℃。神经阻滞采用B-K Medical ApS 1202 彩色多普勒超声诊断扫描仪(B-K Medical ApS,丹麦)。静脉给予咪达唑仑0.02 mg/kg及舒芬太尼0.01 μg/kg镇静后,于麻醉诱导前30 min在麻醉准备间由专门的麻醉医师完成神经阻滞,麻醉诱导和维持过程相同。
1.2.1 神经阻滞方法 ESP组参照文献[1]操作:患者坐位,通过体表触诊确定T7的棘突的位置。常规消毒,采用频率为15 MHz的高频线阵超声探头。探头正中矢状位扫描脊柱从 C7 棘突水平开始向下数到水平,确认T7棘突的位置,由正中向两侧滑动可成像一个并列视图,从外往内依次为皮肤-皮下组织-斜方肌-竖脊肌;菱形大肌的下缘止于T5~6椎体水平,其在此层面的缺失进一步确认T7横突的定位;将超声探头旋转90,局部麻醉浸润浅表组织后,采用平面内技术,在超声引导下将22G 100 mm穿刺针(B.BRAUN公司,德国)以30°~40°朝尾部方向刺入竖脊肌筋膜深面,直到接触与T7横突,注射3~5 mL 0.9%氯化钠注射液,观察到竖脊肌漂浮无肿胀,采用“水分离技术”确定针尖在竖脊肌筋膜深面,注入0.3%罗哌卡因20 mL,超声探头向患者头侧及尾侧移动,确认注射药物在竖脊肌筋膜深部平面向头侧及尾侧扩散,可以看到竖脊肌与横突呈分离状。随后在对侧行相同方法的神经阻滞操作。20 min后采用冰块法检测阻滞平面。
TAP组中,采用肋下入路的TAP阻滞。患者仰卧位,将超声探头斜放在上腹壁,沿肋下边缘靠近腹中线剑突位置,可显示腹直肌及腹横肌的潜行筋膜层。探头继续向侧面移动,直到看见外、内斜肌的腱膜及腹横筋膜,然后探针进一步横向移动直到显示腹横肌。操作者把针头指向腹横筋膜并注射0.3%罗哌卡因20 mL,沿肋下线向腹直肌和经腹肌间注射。随后在对侧重复相同的步骤。阻滞平面的检测方法同前。
所有神经阻滞均是术前30 min由同一麻醉医生在进行。
P组不进行神经阻滞。
1.2.2 麻醉方法及术后镇痛方法 三组均接受全凭静脉麻醉,麻醉诱导采用丙泊酚血浆浓度靶控模式,初始靶控浓度为3 mg/L,同时静脉推注舒芬太尼0.2~0.3 μg/kg、阿曲库铵0.8 mg/kg。诱导插管后行机械通气控制呼吸,麻醉过程中根据术中麻醉深度及手术操作调节丙泊酚和瑞芬太尼的靶控输注浓度,丙泊酚靶控浓度维持在1~1.5 mg/L,瑞芬太尼浓度维持在8~12 μg/L。按需要间断追加阿曲库铵。腹腔镜胆囊切除术采用三孔法,其中脐孔和剑突下穿刺孔采用10mm孔径的Trocar(腹腔穿刺导入器),右侧肋缘下采用5 mm孔径的Trocar。
三组手术结束后在自主呼吸恢复满意后拔除气管导管,均于术毕清醒后立即使用PCIA(至术后24 h。送PACU观察至完全清醒,呼吸循环稳定后送回病房。使用CADD-LegacyPCA 6300型便携式电子输液泵,PCIA配方为舒芬太尼100μg+托烷司琼10 mg+生理盐水,稀释至100 mL,负荷剂量0.06 μg/kg,无背景剂量,自控单次剂量为0.02 μg/kg,锁定时间为15 min。若咳嗽时VAS评分>4分时,则予以氟比洛芬酯50 mg镇痛,每24 h氟比洛芬酯用量不超过100 mg。
1.4 观察指标及方法 记录三组手术时间以及术中丙泊酚和瑞芬太尼的用量。记录24 h内PCIA泵按压次数并计算出舒芬太尼的患者自控总剂量,及补救镇痛(氟比洛芬酯)剂量。记录三组患者术后1、2、6、12、24 h时静息和咳嗽时动态疼痛视觉模拟评分(VAS)。动态评分为嘱患者咳嗽一声后评价。记录术后6h患者的Ramsay镇静评分。观察三组术后24 h内不良反应发生情况,如恶心呕吐(PONV)、瘙痒、镇静过度(Ramsay评分≥5分)、呼吸抑制(SpO2<90%或RR<10次/分)、局部麻醉药中毒、过敏(皮肤出现风团、荨麻疹)、穿刺部位血肿、内脏损伤。观察并记录三组镇痛总体满意度评分。VAS评分及Ramsay镇静评分方法参考文献[3];总体镇痛满意度NRS评分(0分为最不满意,10分为最满意)

2 结果
ESP组、TAP组和P组手术时间分别为(1.280±0.436)、(1.289±0.530)、(1.332±0.504)h,术中丙泊酚总量分别为(453.667±40.535)、(438.600±61.236)、(447.000±56.063)mg,瑞芬太尼总量(1 263.300±279.945)、(1 203.300±325.319)、(1 291.700±266.847)μg,三组手术、术中丙泊酚及瑞芬太尼用量间比较均无统计学差异(P均>0.05)。三组术后1、2、6、12、24 h的静态VAS评分见表1,术后1、2、6、12、24 h时三组静态VAS评分差异均无统计学意义(P均>0.05)。三组术后1、2、6、12、24 h的动态VAS评分比较见表2。

表1 三组术后1、2、6、12、24 h时的静态VAS 评分
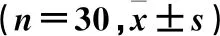
表2 三组术后1、2、6、12、24 h时的动态VAS评分比较
三组患者舒芬太尼自控剂量、补救镇痛剂量及镇痛满意度评分比较见表3。

表3 三组患者舒芬太尼自控剂量、补救镇痛剂量 及镇痛满意度评分比较
ESP组、TAP组和P组Ramsay评分分别为(2.07±0.365)、(1.97±0.183)、(2.17±0.379)分,三组间Ramsay评分比较无统计学意义(P均>0.05)。ESP组、TAP组和P组恶心呕吐例数分别为2、4、10例,与其他两组比较,P组恶心呕吐发生率高(P<0.05)三组均未见镇静过度、呼吸困难及皮肤瘙痒等不良反应。
3 讨论
腹腔镜胆囊切除术围术期疼痛的原因包括腹壁穿刺损伤、二氧化碳气腹刺激、腹膜牵拉等因素,术后常伴有较明显的急性疼痛[3],根据疼痛强度、疼痛持续时间及病理生理学机制可分为腹壁切口痛、内脏痛与肩背部疼痛等三类。这三类疼痛具有个体差异,因此LC术后镇痛目前多采用多模式镇痛,即联合多种镇痛方法或多种镇痛药物,其中局麻药神经阻滞联合其他镇痛药物的方案是当前的热点。超声引导下神经阻滞具有镇痛效果确切、对患者全身影响小和术后镇痛时间长等优点所以特别适合于那些微创日间、小儿和老年危重患者手术的围术期镇痛,对传统的术后镇痛方式起到更好的补充作用。
TAP是一种较为成熟的神经阻滞技术,通常阻断T6~L1神经分支,其感觉神经阻滞的范围可能因TAP阻滞入路的不同而有所区别[4]。目前有许多超声引导的入路正在使用,包括前斜肋下入路、腋前线入路和Petit后入路[5]。有研究指出,经典的腋前线入路可以减少下腹部手术术后疼痛评分和阿片类药物用量[6]。肋下入路TAP阻滞可以阻滞T6~T10节段的神经传导,特别适用于上腹部手术[7]。Basaran等[8]报道肋下TAP阻滞成功地减轻了术后疼痛,成功地减轻了术后疼痛,改善了患者腹腔镜胆囊切除术术后的呼吸功能,同时指出,前肋下入路导致造影剂在腹横面内的主要前向扩散,而相对较少的后向扩散。有研究表明,肋下入路TAP阻滞对整个前腹壁可起有效的镇痛作用,但对侧腹壁及后腹壁几乎没有镇痛效果,因此TAP阻滞用于腹腔镜胆囊切除术术后镇痛,由于侧腹壁及后腹壁的不适可能会降低术后镇痛的满意度。
ESP阻滞是将局麻药注到竖脊肌筋膜深面,从而阻断其深面走行的脊神经腹侧支及背侧支的传导一种区域神经阻滞方法[9]。尸体研究表明,ESP阻滞时局麻药可以通过硬膜外间隙,椎间孔和肋间扩散[10],局麻药扩散范围更广可能使阻滞的皮肤区域比TAP阻滞更大。同时,由于TAP阻滞对腹腔镜胆囊切除术术后躯体痛阻滞效果较好,而对内脏痛无效,导致部分患者镇痛不足,而ESP阻滞可阻滞内脏神经纤维和躯体神经纤维,这使其成为更适用于腹部手术的一种神经阻滞技术。ESP阻滞应用下胸段水平时,局麻药可向前渗透并进入胸椎旁间隙。因此,ESP阻滞有可能阻断向交感神经节传递信号的交通支纤维[11]。Tulgar等[12]评价了ESP阻滞作为腹腔镜胆囊切除术后多模态镇痛的一部分的有效性,在阻滞组中,作者用40 mL的0.375%布比卡因在T9水平上进行双侧ESP阻滞,对照组不进行干预,结果表明,ESP阻滞可显著降低术后疼痛评分和曲马多用量。其他研究表明ESP阻滞可应用于不同部位手术的围术期镇痛,如乳腺[13]、胸部[14]、脊柱[15]、膝关节手术[16]。
胸硬膜外镇痛、胸椎旁阻滞和腰方肌阻滞都是既能阻断躯体痛又能阻断内脏痛的镇痛方法。然而,这些方法困难而费时,且有严重并发症的潜在风险。与常规镇痛比较,胸段硬膜外镇痛与住院时间延长有关。超声引导下胸椎旁阻滞与医源性气胸相关[17]。因此,ESP阻滞定位简单,操作技术难度少而风险小,对呼吸循环影响小,是上述方法较好的替代技术[18]。
本研究中,术后1、2 h的ESP组动态VAS评分明显低于其余两组,术后6、12 h ESP组动态VAS评分低于P组,而ESP组的患者自控舒芬太尼用量较其他2组的明显减少;补救用氟比洛芬酯用量显著低于P组,镇痛满意度高于P组。ESP阻滞使腹腔镜胆囊切除术术后早期尤其是前两个小时的动态VAS评分减低,减少术后阿片类及其他镇痛药物的用量,提高患者的镇痛满意度。三组患者均未见镇静过度、呼吸困难及皮肤瘙痒等不良反应。恶心呕吐的发生率低于P组,可能与阿片类药物的使用量降低有关。
比较TAP阻滞及ESP阻滞,我们两组均采用0.3%罗哌卡因分别进行双侧神经阻滞,单侧用量均为20 mL,使各组间局麻药用量标准化。术后1、2 h的ESP组动态VAS评分显著低于TAP组,ESP组的舒芬太尼自控剂量显著低于TAP组。我们认为,造成这种差异的原因可能是ESP阻滞促进了局麻药在筋膜平面上的皮肤扩散大于TAP阻滞有关,具体的作用机制及范围还需等待进一步的实验数据支持,也是我们下一步的研究方向。
综上所述,腹腔镜胆囊切除术术前行超声引导ESP阻滞,能减轻患者围术期疼痛,减少患者围术期阿片类药物的用量,简单易行且安全有效,是腹腔镜胆囊切除术术后镇痛的理想选择。
