常温下煤与两个氧气分子吸附机理研究
2020-07-22王晓波邓存宝邓汉忠王雪峰郝朝瑜
王晓波,邓存宝,邓汉忠,王雪峰,郝朝瑜
(1.太原理工大学 安全与应急管理工程学院,太原 030024;2.辽宁工程技术大学 材料学院,辽宁 阜新 123000)
煤炭自燃不仅是煤矿安全生产的重大灾害之一,更对矿区周围的生态环境造成极大的破坏。煤炭自燃是一个复杂的物理、化学反应过程[1-3]。经过多年的发展历程,形成许多相关煤自燃的学说[4-7]。最早可追溯到17世纪,Dr.Plott提出煤炭自燃是其中的黄铁矿导致的,后来又有研究认为是细菌诱导或者酚基诱导的等。随着科学技术的发展,关于煤炭自燃机理的研究越来越深入,目前被大家广泛接受的煤炭自燃理论是煤氧复合作用学说。煤与氧相互作用发生氧化自燃反应的过程包括物理吸附、化学吸附和化学反应三个阶段,其中煤物理吸附氧气的阶段是引起煤与氧发生反应的开端[8-11]。
煤是一种由多种有机小分子和大分子混合组成的孔隙结构丰富、比表面积大的有机岩。煤表面能够自发吸附气体[12-14],释放大量吸附热为煤炭自燃提供能量。
本文以简化的芳香环作为煤的芳香环骨架,并适当添加侧链构建煤活性特征结构简化模型,用于分析煤吸附氧气的作用机理[15]。应用量子化学密度泛函理论和方法,深入探究煤活性特征结构吸附两个氧气分子的吸附机理和吸附过程,为进一步揭示煤自燃的本质提供基础理论[16]。
1 吸附几何构型
本研究中,煤活性特征结构模型是只保留苯环和侧链的简化结构,如图1所示。前期研究表明[17],虽然煤中的氨基侧链含量较少,但在煤的氧化过程中,氨基侧链先与氧发生化学反应放热,导致煤体温度升高,进而引起煤中其他类型的官能团氧化,并最终造成煤自燃。氧气分子可以在苯环或者在侧链吸附,吸附的位置不同导致煤炭自燃的程度不同。图2是由量子化学计算软件Gaussian03程序,采用密度泛函理论(DFT),基准采用B3LYP/6-311G计算得到煤活性特征结构吸附与2个氧气分子的吸附平衡几何构型。
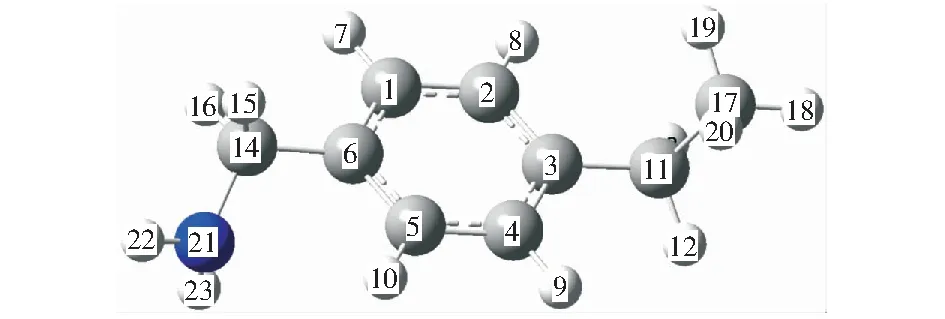
图1 煤活性特征结构模型Fig.1 Coal surface model

图2 活性特征结构与氧吸附平衡几何构型Fig.2 Adsorption equilibrium geometry of two oxygen molecules on coal surface
对比图1和图2,以及构型数据,表明煤活性特征结构与2个氧气分子存在明显的吸附作用。通过计算键长、键角可以描述氧分子在煤活性特征结构的位置。键长、键角见表1,表2.

表1 煤活性特征结构与氧吸附平衡几何构型化学键键长Table 1 Characteristic structure of coal activity and chemical bond length of oxygen adsorption equilibrium geometry

表2 煤活性特征结构与氧吸附平衡几何构型化学键键角Table 2 Bond angles of geometric equilibrium configuration of two oxygen molecules adsorbed on benzene ring
根据上表分析出,吸附在苯环上的氧分子键长增加了2.983 pm,吸附在侧链上的氧气分子键长增加了6.724 pm,键长增加则氧气分子活性增强,增加煤活性特征结构与氧气发生化学反应的可能性,且侧链上的氧气分子比苯环上的氧气分子更活跃。
2 平衡吸附位置及距离
由吸附平衡构型可看出,苯环C原子距O24原子的距离分别为:R(O24,C1)= 321.778 pm,R(O24,C2)=321.773 pm,R(O24,C3)=302.056 pm,R(O24,C4)=268.643 pm,R(O24,C5)=266.799 pm,R(O24,C6)= 299.951 pm.
O25原子距苯环C原子的距离分别为:R(O25,C1)=270.935 pm,R(O25,C2)=267.274 pm,R(O25,C3)=298.031 pm,R(O25,C4)=318.709 pm,R(O25,C5)=320.496 pm,R(O25,C6)=302.899 pm.
O原子距侧链C原子的距离分别为:R(O26,C14)=267.050 pm,R(O27,C14)= 273.076 pm.
O原子与含氨基侧链N原子的距离分别为:R(O26,N21)=274.312 pm,R(O27,N21)=209.266 pm.
从以上数据分析得到,煤活性特征结构苯环对氧气分子的吸附位置位于苯环的正上方。含氨基侧链对氧气的吸附位于C—N键的正上方,且氧原子与N原子的距离较近。
3 电荷布居数与振动频率
通过分析电荷集居数与振动频率,可以得到煤活性特征结构与氧气分子吸附前后各轨道电子布居数,见表3.

表3 煤活性特征结构与2个氧分子吸附前后各轨道电子布居数比较Table 3 Comparison of the number of electronic population of each orbit before and after adsorption of coal surface and two oxygen molecules
煤活性特征结构苯环上的C原子有电荷转移到氧气分子上,电荷增加少说明侧链吸附氧气之后会造成苯环对氧吸附的减弱。电子转移使氧气分子的O—O键强度减弱,键拉长拉大。
当氧气分子吸附在侧链上时,H16、H22、H23全部失去电子,在3S轨道上分别失去-0.063 92、-0.035 31、-0.038 85个电子,则氢原子的净电荷增加,增强了C—H键、N—H键。
吸附在含氨基侧链上的氧气分子的净电荷发生了较大的改变,O26、O27的4P轨道分别得到了0.203 43和0.168 11个电子,其净电荷分别达到了-0.210和-0.133.证明侧链对氧的吸附是一种比较强的相互作用,而且其得到的电子主要由C14和N21来提供,由于吸附在侧链的氧气分子的最高占据轨道得到了大量的电子,削弱了O—O键的作用,导致O—O键的键长拉长的作用比较明显。
煤活性特征结构吸附氧气前后的C—C键、O—O键和C—H键的红外伸缩振动频率,结果列于表4.

表4 煤活性特征结构与氧气分子吸附前后红外振动频率比较Table 4 Comparison of the characteristic structure of coal activity and infrared vibration frequency before and after oxygen adsorption
吸附前O—O键的振动频率为143 cm-1,吸附后苯环上的O—O键的振动频率为1 275 cm-1,侧链上的O—O键的振动频率为1 161 cm-1,吸附后振动频率均减少,同时说明氧原子之间的化学键减弱。C—H键与N—H键的振动频率变化较小,而且它们的频率都具有增大的趋势,说明在吸附态中它们的化学键得到了不同程度的加强;但是在吸附态中,C—C键的振动频率并没有增大,反而有不同程度的减小,减小的原因是由于苯环碳原子上的电子向氧气分子转移,导致了苯环C—C键的减弱。
4 吸附能
吸附能计算公式为:
ΔE=EM+EO2-Ecomplex.
(1)
式中:ΔE为煤活性特征结构与氧气分子吸附达到平衡态的吸附能;EM为吸附前煤活性特征结构的能量;EO2为吸附前氧气分子的能量;Ecomplex为煤活性特征结构吸附氧气分子的平衡几何构型的能量。
煤表面与氧气分子发生吸附放出能量,使煤体温度升高,在蓄热环境好的条件下,随着能量的积聚,使煤体的温度不断升高导致煤的氧化自燃发生。
吸附前的氧气分子的能量为-150.26 Hartee,煤表面的能量为-405.33 Hartee,两个氧分子与煤表面吸附后组成的吸附态的能量为-705.87 Hartee.由公式(1)计算得到氧气分子与煤活性特征结构的吸附能为94.41 kJ/mol,吸附能较大,因而,氧气分子易与煤活性特征结构发生吸附作用。
5 结论
1) 氧气分子与煤活性特征结构的吸附能为94.41 kJ/mol,煤活性特征结构易与氧分子产生吸附作用。
2) 吸附在苯环上的氧气分子键长增加了2.983 pm,吸附在侧链上的氧气分子键长增加了6.724 pm,键长增加则氧气分子活性增强,增强与煤活性特征结构发生化学反应的可能性,且侧链上的氧气分子比苯环上的氧气分子更活跃。
3) 煤活性特征结构苯环上的C原子有电荷转移到氧气分子上,电荷增量减少说明侧链吸附氧气之后会造成苯环对氧气吸附的减弱。电子转移使氧气分子的O—O键强度减弱,键拉长拉大。
4) 吸附在含氨基侧链上的氧气分子的净电荷发生了较大的改变,证明侧链对氧气的吸附是一种比较强的相互作用,而且其得到的电子主要由C14和N21来提供,由于吸附在侧链的氧气分子的最高占据轨道得到了大量的电子,削弱了O—O键的作用,导致O—O键的键长拉长的作用比较明显。
