单性木兰叶多酚的稳定性及抗氧化性研究
2020-07-21郑燕菲1许建本1黄秋萍1蔡杰慧1吴美霞1蓝亮美
郑燕菲1,许建本1,黄秋萍1,蔡杰慧1,吴美霞1,蓝亮美
(1.广西民族师范学院化学化工学院,广西崇左 532200;2.柳州城市职业学院机电与汽车工程系,广西柳州 545036)
单性木兰(MagnoliakwangsiensisFiglar & Noot.)也称广西木兰,为木兰科单性木兰属,成片分布仅在广西木论自然保护区[1-2],目前广西已进行大片的单性木兰人工种植。单性木兰结果率低,种子发芽率低,资源稀缺,是我国珍稀濒危植物[3-4],于1999年被列为国家一级保护植物[5]。
目前,对单性木兰的研究主要集中在分类学[6]、形态学[7-8]、生态学[9-10]、遗传学[11]等方面,近年对其化学成分的研究也开始有报道。单性木兰的挥发油含有多种名贵香料的成分[12-15];单性木兰果实中含有多种脂肪酸,可开发作为天然保健食品[15];单性木兰叶中多糖含量可观,多糖组分对人肺癌细胞A549和胃癌细胞SGC7901有较好的抑制能力[16];单性木兰叶中多酚具有良好的抗氧化活性[17]。以上文献研究均指出单性木兰富含多种有效成分,能开发成天然的保健药品以及功能食品。植物中多酚具有天然无毒和良好的生物活性,已成为了医药领域及食品工业的研究重点之一。单性木兰叶多酚从总抗氧化性、还原性、DPPH·的清除作用、羟基自由基(·OH)的清除作用以及抑制脂质过氧化作用五个体系中均表现出良好的抗氧化活性[18],可开发成为天然的抗氧化剂和具有保健功能的食品添加剂,但对单性木兰叶中多酚的稳定性,以及从清除亚硝基自由基(·NO)、水杨酸法清除·OH作用该两个体系的抗氧化性的研究鲜见报道。
本文以单性木兰叶多酚粗提物及纯化物为研究对象,针对不同加工、储存条件下多酚物质的变化,测定其在不同光照、温度、糖类、防腐剂、氧化还原剂条件下的稳定性,从清除·NO、水杨酸法清除·OH两个体系考察其抗氧化活性,以期为单性木兰多酚在工业、医药及食品等行业的产品开发和利用提供理论数据。
1 材料与方法
1.1 材料与仪器
新鲜单性木兰叶 摘自广西南宁武鸣区;单宁酸 标准品(99%纯度),阿拉丁;无水碳酸钠、蔗糖、葡萄糖、无水亚硫酸钠 分析纯,成都市科隆化学品有限公司;福林酚 分析纯,上海宝曼生物科技有限公司;苯甲酸钠 分析纯,天津市光复精细化工研究所;30%过氧化氢 分析纯,广东光华科技股份有限公司。
翱艺AOE紫外可见分光光度计 翱艺仪器有限公司;SQP型电子分析天平 赛多利斯科学仪器(北京)有限公司;WP700(21)型微波炉 佛山市顺德区格兰仕微波炉电器有限公司;RE-52A型旋转蒸发仪 上海亚荣生化仪器。
1.2 实验方法
1.2.1 多酚样品制备 单性木兰叶多酚粗提物及纯化物按文献[17-18]进行制备。新鲜单性木兰叶粉末用石油醚进行脱脂、除色处理,加入液固比21∶1 mL/g的70%丙酮水溶液,在温度65 ℃、提取时间16 min的微波提取条件下进行提取,2400 r/min离心 10 min、浓缩、55 ℃鼓风干燥至恒重,制得单性木兰叶多酚粗提物,其质量含量为11.69%。将浓缩后的单性木兰叶多酚粗提液依次用石油醚、乙酸乙酯进行多次萃取,乙酸乙酯层减压浓缩、55 ℃鼓风干燥至恒重,得单性木兰叶多酚纯化物,其质量含量为32.11%。
1.2.2 多酚含量的测定
1.2.2.1 标准曲线的制作 配制质量浓度为0.5 μg/mL的单宁酸标准液,分别移取0.1、1.1、2.1、3.1、4.1 mL标准液于25 mL棕色容量瓶中,分别加入1.3 mL福林酚溶液,摇匀静置6 min,再分别加入5 mL饱和碳酸钠溶液,摇匀后静置6 min,定容至25 mL后摇匀静置30 min,于760 nm处测量吸光度[19-20],绘制标准曲线。
1.2.2.2 样液多酚含量测定 准确移取一定体积的多酚样液,用标准曲线制作的显色法测定其在760 nm处的吸光值,计算单性木兰叶多酚的含量[18]。
1.2.3 多酚稳定性的测定
1.2.3.1 光照对单性木兰叶多酚稳定性的影响 取25 mL 0.0142 μg/mL的单性木兰叶多酚粗提物、纯化物溶液于25 mL容量瓶中,分别在避光、未避光(室内自然光)条件下静置,每隔1 h取样1次[21],共取样5次,显色后于760 nm处测吸光度,实验平行3次,取平均值。
保留率计算公式[22]如下:
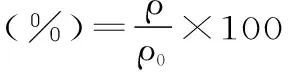
式中:ρ为处理后的单性木兰叶多酚的含量,μg/mL;ρ0为处理前的单性木兰叶多酚的含量,μg/mL。
1.2.3.2 温度对单性木兰叶多酚稳定性的影响 取25 mL 0.0142 μg/mL的单性木兰叶多酚粗提物、纯化物溶液于25 mL容量瓶中,分别在30、50、70、90、100 ℃的条件下避光静置,每隔1 h取样1次[23],共取样5次,显色后于760 nm处测吸光度,实验平行3次,计算保留率。
1.2.3.3 糖类对单性木兰叶多酚稳定性的影响 取5 mL 0.0142 μg/mL的单性木兰叶多酚粗提物、纯化物溶液于25 mL容量瓶中,分别用浓度为10、20、30、40、50 g/mL的葡萄糖溶液或蔗糖溶液定容至刻度线[24],摇匀后在30 ℃条件下避光静置8 h,显色后于760 nm处测吸光度,实验平行3次,计算保留率。
1.2.3.4 苯甲酸钠对单性木兰叶多酚稳定性的影响 取5 mL 0.0142 μg/mL的单性木兰叶多酚粗提物、纯化物溶液于25 mL容量瓶中,分别用浓度为0、0.01、0.05、0.10、0.15 g/mL的苯甲酸钠溶液定容至刻度线[22],摇匀后于30 ℃条件下避光静置8 h,显色后于760 nm处测吸光度,实验平行3次,计算保留率。
1.2.3.5 氧化还原剂对单性木兰叶多酚稳定性的影响 取5 mL 0.0142 μg/mL单性木兰叶多酚粗提物、纯化物溶液于25 mL容量瓶中,分别用浓度为0、0.50、1.00、1.50、2.00 g/mL的过氧化氢溶液、亚硫酸钠溶液[25],摇匀后于30 ℃条件下避光静置5 h,显色后于760 nm处测吸光度,实验平行3次,计算保留率。
1.2.4 多酚抗氧化性的测定
1.2.4.1 单性木兰叶多酚对·NO的影响 分别移取1.0、2.0、3.0、4.0、5.0 mL的0.1 μg/L单性木兰叶多酚粗提物、纯化物溶液于10 mL棕色容量瓶中,各加入2.0 mL的 10 μg/mL亚硝酸钠溶液,避光静置10 min,加入2.0 mL的 4 g/L对氨基苯磺酸溶液,摇匀反应5 min,再加入1.0 mL的 2 g/L盐酸萘乙二胺,定容至10 mL,摇匀,15 min后于紫外分光光度计测定,读取波长为540 nm处的吸光度A1,其中不加亚硝酸钠溶液时的吸光度为A2。
在上述实验中加入亚硝酸钠溶液前用蒸馏水代替多酚溶液作空白,测定吸光度A0[26]。实验平行3次,取平均值。单性木兰叶多酚对·NO的清除率按下式计算:
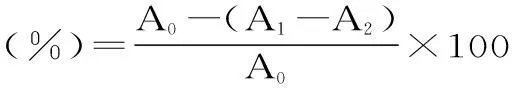
式中:A0为未加入样品溶液的吸光度,A1为加入样品溶液后的吸光度,A2为未加入亚硝酸钠时的吸光度。
1.2.4.2 单性木兰叶多酚对·OH的影响 参照文献[27]的方法并略作修改,分别移取1.0、2.0、3.0、4.0、5.0 mL的0.1 μg/L单性木兰叶多酚粗提物、纯化物溶液于10 mL棕色容量瓶中,依次加入2.0 mL 的6 mmol/L硫酸亚铁溶液、2.0 mL 的6 mmol/L过氧化氢溶液,摇匀避光静置10 min,再加入2.0 mL的 6 mmol/L水杨酸乙醇溶液,定容至10 mL,混匀,静置30 min后分别测定在510 nm处的吸光度Ai,其中不加水杨酸溶液时的吸光度为Aj。
在上述实验中用蒸馏水代替多酚溶液作空白,测定吸光度A0。实验平行3次,取平均值。单性木兰叶多酚对·OH的清除率按下式计算:
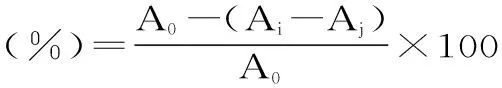
式中:A0为未加入样品溶液的吸光度,Ai为加入样品溶液后的吸光度,Aj为未加入水杨酸时的吸光度。
1.3 数据处理
所有实验均进行3次重复,试验数据处理和分析采用Origin 9.1软件。
2 结果与分析
2.1 单宁酸标准曲线的绘制
以单宁酸标准液质量浓度(x)为横坐标、吸光度(y)为纵坐标,绘制标准曲线,如图1所示。得到的单宁酸标准曲线的线性回归方程为y=3.284x+0.0461,R2=0.9996,说明单宁酸浓度在0.0020~0.0820 μg/mL范围内于波长760 nm处吸光值与浓度的线性关系良好。

图1 单宁酸标准曲线Fig.1 Standard curve of tannins
2.2 多酚的稳定性研究
2.2.1 光照对单性木兰叶多酚稳定性的影响 不同光照对单性木兰叶多酚样品稳定性的影响结果如图2所示。
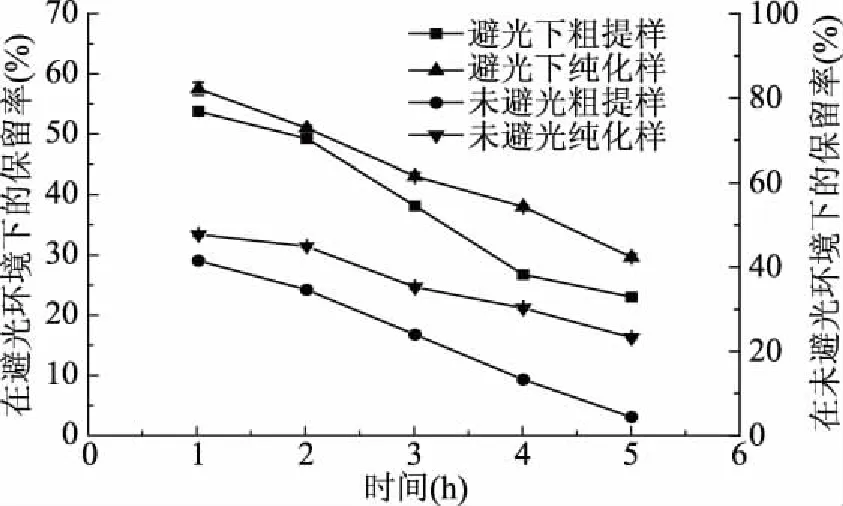
图2 光照对单性木兰叶多酚稳定性的影响Fig.2 Effect of light intensity on the stability of polyphenols from M. kwangsiensis leaves
由图2可知,不同光照条件下,单性木兰叶多酚粗提物和纯化物的保留率随着时间的增加均呈下降趋势,且纯化物的保留率高于粗提物的保留率。单性木兰叶多酚粗提物和纯化物在避光1 h时保留率分别达53.75%、57.50%,在未避光相同条件下单性木兰叶多酚样品的保留率较避光条件的保留率低,分别为41.48%、47.69%。在避光5 h时,单性木兰叶多酚粗提物和纯化物保留率分别达23.00%、29.60%,在未避光相同条件下保留率较避光条件的保留率低,分别为4.36%、23.21%。这是因为未避光条件下,多酚物质中的不饱和键会在光的条件下加速降解[22]。因此,单性木兰多叶酚在长时间生产使用过程中应选择避光处理与保存。
2.2.2 温度对单性木兰叶多酚稳定性的影响 不同温度对单性木兰叶多酚稳定性的影响结果如图3、图4所示。

图3 温度对单性木兰叶多酚粗提物稳定性的影响Fig.3 Effects of temperatures on the stability of crude polyphenols from M. kwangsiensis leaves
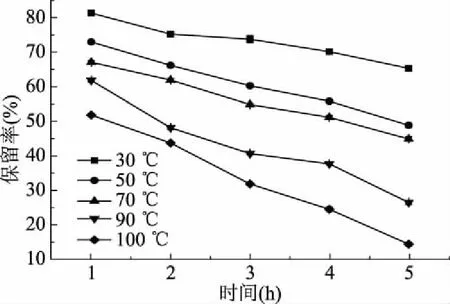
图4 温度对单性木兰叶多酚纯化物稳定性的影响Fig.4 Effects of temperatures on the stability of the purified polyphenols from M. kwangsiensis leaves
由图3~图4可知,随着实验温度的增加,单性木兰叶多酚粗提物和纯化物的保留率均呈下降趋势,纯化物的保留率均高于粗提物的保留率。单性木兰叶多酚粗提物和纯化物在30 ℃、1 h的保留率分别达54.30%、81.58%;100 ℃下静置5 h时,单性木兰叶多酚粗提物和纯化物的稳定性最差,保留率在10%左右,这是因为植物多酚在长时间高温环境下,会受热发生反应生成其他物质[23]。单性木兰叶多酚需要长时间贮存时应该置于低温的环境中,避免因热造成结构的改变。
2.2.3 糖类对单性木兰叶多酚稳定性的影响 不同浓度的不同糖类物质对单性木兰叶多酚稳定性的影响结果如图5所示。
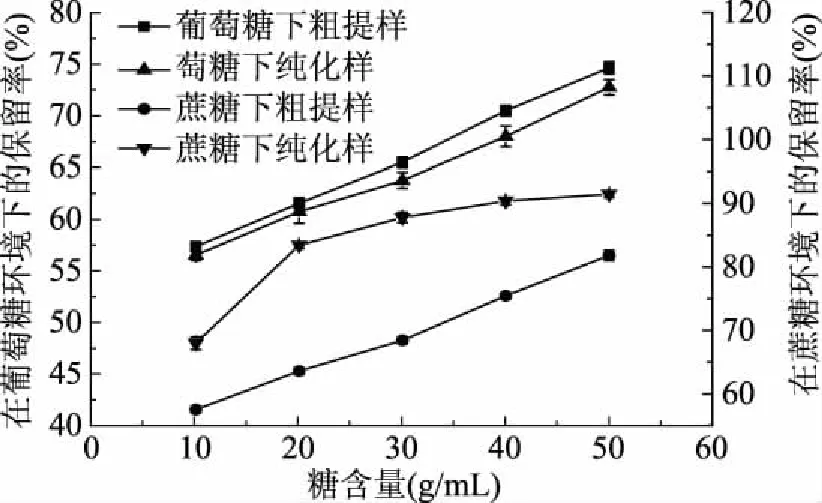
图5 糖类对单性木兰叶多酚稳定性的影响Fig.5 Effects of different sugars on the stability of polyphenols from M. kwangsiensis leaves
由图5可知,单性木兰叶多酚粗提物和纯化物的保留率均随葡萄糖浓度和蔗糖浓度的增加而增加,即糖类对多酚的稳定性有一定的增强作用。这是由于随着糖类浓度的增加,溶液中水分活度逐渐降低,从而抑制了多酚的降解[22]。在各相同糖浓度下,葡萄糖环境中的保留率低于在蔗糖环境中的保留率。这是因为葡萄糖有着活泼的化学性质,其可使得多酚物质结构发生变化。所以在单性木兰叶多酚作为食品和药品时的生产及加工中,选择共用的糖类物质应为蔗糖,利于多酚的稳定。
2.2.4 苯甲酸钠对单性木兰叶多酚稳定性的影响 不同浓度的苯甲酸钠对单性木兰叶多酚稳定性的影响情况如图6所示。
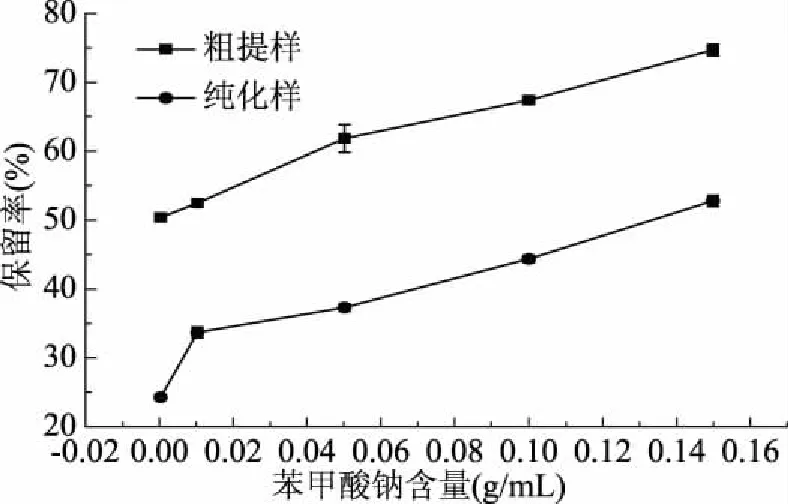
图6 苯甲酸钠对单性木兰叶多酚稳定性的影响Fig.6 Effect of sodium benzoate on the stability of polyphenols from M. kwangsiensis leaves
由图6可知,随着苯甲酸钠质量浓度的增加,单性木兰叶多酚粗提物和纯化物的保留率逐渐增大,粗提物的保留率高于纯化物的保留率。对单性木兰叶多酚样品的保留率(y)和苯甲酸钠质量浓度(x)进行线性拟合,结果如表1,由表中R2可看出,单性木兰叶多酚粗提物和纯化物的保留率和苯甲酸钠质量浓度间存在良好的线性关系。单性木兰叶多酚的稳定性与防腐剂苯甲酸钠浓度呈正相关,防腐剂可减少多酚的降解。

表1 苯甲酸钠中保留率与质量浓度的相关性Table 1 Relations between retention rate(y)and mass concentration(x)of sodium benzoate
2.2.5 氧化还原剂对单性木兰叶多酚稳定性的影响 不同的氧化还原剂对单性木兰叶多酚稳定性的影响结果如图7所示。
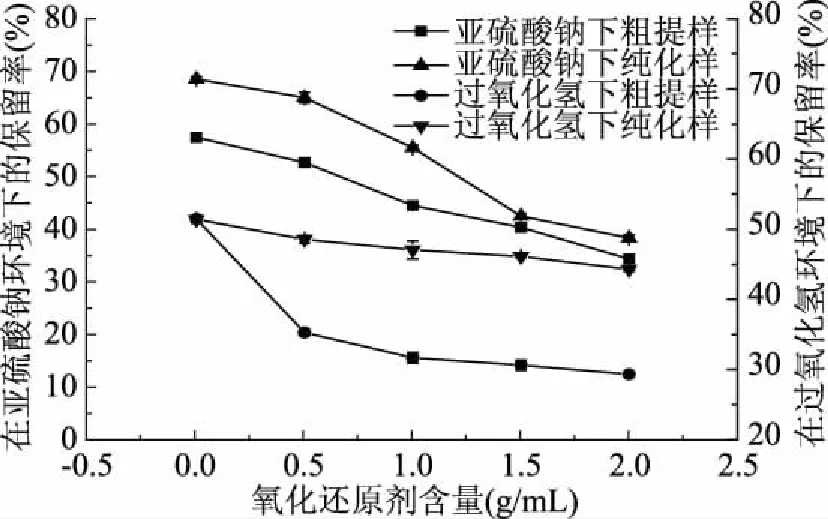
图7 氧化还原剂对单性木兰叶多酚稳定性的影响Fig.7 Effects of oxidative reductant on the stability of polyphenols from M. kwangsiensis leaves
由图7可知,随着氧化剂过氧化氢和还原剂亚硫酸钠浓度的增加,单性木兰叶多酚粗提物和纯化物的保留率逐渐下降,粗提物的保留率比纯化物的保留率低,这说明氧化剂过氧化氢和还原剂亚硫酸钠对单性木兰叶多酚均具有破坏性。在各相同浓度时,氧化剂过氧化氢对单性木兰叶多酚的破坏性强于还原剂亚硫酸钠的破坏性,这是植物多酚易被氧化所引起。
2.3 多酚的抗氧化性研究
2.3.1 单性木兰叶多酚对·NO的清除作用 单性木兰叶多酚对·NO的清除作用结果如图8所示。

图8 单性木兰叶多酚清除·NO的作用Fig.8 Effect of M. kwangsiensisleaves polyphenols on removing·NO
由图8可以看出,在浓度范围0.01~0.05 μg/L内,单性木兰叶多酚样品对·NO具有清除作用,且对·NO的清除率随着样品浓度的增加而增加。当样品浓度小于0.03 μg/L时,单性木兰叶多酚粗提样对·NO的清除率强于纯化样;当样品浓度大于0.03 μg/L时,单性木兰叶多酚纯化样对·NO的清除率强于粗提样,其原因可能是较低浓度下,粗样中的杂质对·NO的清除作用影响较小,随着浓度的增加杂质增多,杂质对·NO的清除作用影响明显。在所测浓度范围内,对清除率(y)和质量浓度(x)进行线性拟合,结果如表2所示,由R2可知,粗提样和纯化样对·NO的清除率与样液浓度存在较好的线性关系。

表2 清除·NO作用中清除率与浓度的相关性Table 2 Relations between scavenging rate(y)and mass concentration(x)of removing ·NO
2.3.2 单性木兰叶多酚对·OH的清除作用 单性木兰叶多酚对·OH的清除作用结果如图9所示。
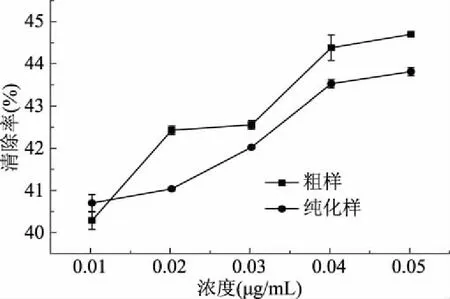
图9 单性木兰叶多酚清除·OH的作用Fig.9 Effect of M. kwangsiensis leaves polyphenols on removing ·OH
由图9可知,在浓度范围0.01~0.05 μg/L内,单性木兰叶多酚样品对·OH的清除作用随着样品浓度的增加呈上升趋势,与样品浓度呈正相关关系。当样品浓度大于0. 02 μg/L时,单性木兰叶多酚粗提样对·OH的清除率明显强于纯化样。所测浓度范围内,对清除率(y)和质量浓度(x)进行线性拟合,结果如表3所示,由R2可知,粗提样和纯化样对·OH的清除率与样液浓度存在较好的线性关系。

表3 清除·OH作用中清除率与浓度的相关性Table 3 Relations between scavenging rate(y)and mass concentration(x)of removing ·OH
3 结论
本试验对单性木兰叶中多酚的稳定性和抗氧化性进行了考察,结果显示:多酚在避光条件下较未避光下稳定,长时间贮存时应该置于低温的环境中,且在蔗糖环境较稳定;添加防腐剂苯甲酸钠有利于单性木兰叶多酚的稳定,且其稳定性与苯甲酸钠的质量浓度呈良好的线性关系;氧化剂过氧化氢和还原剂亚硫酸钠对单性木兰叶多酚均具有破坏性,且过氧化氢对其破坏性更强。在浓度范围0.01~0.05 μg/L内,多酚对·NO和·OH具有较好的清除作用,其清除作用随样品浓度的增大而增强,且清除作用的量效关系具有较好的线性关系。
本文尚未能对单性木兰叶中多酚粗提物和纯化物两者各条件下稳定性存在差异进行说明,此后应就该问题进行探究。结果可为单性木兰在食品、药品和保健品等方面的应用提供重要依据,为单性木兰其他的天然成分林产品的开发和利用奠定一定的基础。
