CREPT在肾癌组织中的表达及其与预后的关系
2020-07-21曹庆飞叶雄俊陈伟男赵海岳王银银黄晓波常智杰
刘 军 曹庆飞 叶雄俊* 陈伟男 赵海岳 佟 明 王银银 黄晓波 常智杰
(1. 北京大学人民医院泌尿与碎石中心,北京 100034;2. 锦州医科大学附属第一医院泌尿外科,辽宁锦州 121001;3. 清华大学医学院膜生物国家重点实验室,北京 100084)
肾细胞癌(renal cell carcinoma,RCC)是一种源自近端肾小管上皮细胞的肾肿瘤,其中75%~80%是透明细胞RCC(clear cell renal cell carcinoma,ccRCC)[1]。近年来,肾癌发病率呈逐步上升趋势,据统计[2-3],全球每年约有34万~40万名患者被诊断为肾癌,另有大约13万~17万名患者因罹患肾癌死亡。手术切除是早期肾癌的有效治疗方法,然而,超过30%的肾癌患者在根治性肾切除术后发生复发或者转移[4],并且此类患者5年生存率很差[5]。肿瘤分子标志物可以评估肾癌复发的可能,因此,发现与肾癌进展相关的分子标志物对于改善治疗策略和判断预后具有重要意义。
肿瘤细胞周期相关蛋白(cell-cycle-related and expression-elevated protein in tumor,CREPT)是酵母Rtt103基因的人类同源类似物,在人类多种癌症中呈高表达状态[6]。CREPT通过促进细胞从G1向S期转变,从而调控细胞生长并导致肿瘤发生[6-7]。迄今为止,CREPT在肾癌发生、发展中的作用还未见诸报道。本文拟研究CREPT在肾癌及癌旁组织中的表达水平,探讨CREPT表达与临床病理特征及预后之间的关系。
1 对象与方法
1.1 研究对象
选择2014年至2016年间在北京大学人民医院接受了根治性肾切除术的90例患者为研究对象,所有患者均经组织学证实为肾癌,手术前后均未接受过任何的辅助治疗。其中男性57例,女性33例,年龄21~81岁(中位年龄58岁)。肿瘤的直径为2.0~18.0(平均4.49)cm。本研究采用TNM分期系统对肾癌患者进行分期,其中58例为Ⅰ期,7例为Ⅱ期,15例为Ⅲ期,10例为Ⅳ期。通过Fuhrman四级量表评估肿瘤的等级,41名患者为Ⅰ级,24名患者为Ⅱ级,14名患者为Ⅲ级,11名患者为Ⅳ级。90例患者中,透明细胞癌76例,乳头细胞癌7例,嫌色细胞癌4例,其他组织学类型3例。
1.2 组织学检查
将获得的标本固定在10%(体积分数)甲醛中,常规处理进行石蜡包埋,将蜡块切成4 μm的组织切片,用苏木精和伊红染色后,由病理专家阅片诊断。
1.3 免疫组化及评估
首先将组织切片脱石蜡后再水合,然后在10 mmol/L 柠檬酸盐缓冲液中加热切片2.5 min进行抗原修复。用0.3%(质量分数)过氧化氢清除内源性过氧化物酶后(10 min),再用磷酸盐缓冲盐水(PBS)洗涤3次,然后加入3E10(小鼠抗CREPT单克隆抗体)(由清华大学常智杰教授提供),在4℃冰箱过夜。1∶100用PBS洗涤3次后,将样品与小鼠二抗(1∶200,北京中杉金桥生物技术有限公司)在室温下孵育30 min。最后,用二氨基联苯胺(DAB)染色,并用Meyer’s苏木精复染细胞核。PBS替换第一抗体获得阴性对照。
CREPT的染色结果由经验丰富的病理专家以半定量方法评估,该病理医师对患者的临床病理分期和分级并不知情。病理参数采用阳性肿瘤细胞百分比(0%=0,1%~10%=1,11%~50%=2,51%~80%=3,81%~100%=4)和染色强度(阴性=0,弱=1,中等=2,强=3)进行评估。两个参数相乘,得出的免疫反应性评分(immunoreactivity score, IRS)在0到12之间[8]。根据评分将CREPT分为低表达(IRS 0-6)和高表达(IRS 6-12)两组。
1.4 随访
所有患者术后每六个月进行一次随访,直至死亡或复发。截至2018年12月,随访时间为8~53个月(中位时间23.5个月)。
1.5 统计学方法
使用SPSS 19.0进行统计分析,计数资料计算百分比,组间构成比较采用卡方检验。通过Kaplan-Meier生存分析评估CREPT表达与生存率的关系,组间生存率比较使用Log-rank检验,多因素分析采用Cox回归模型。以P<0.05为差异有统计学意义。
2 结果
2.1 CREPT在肾癌及癌旁组织中的表达水平
将90例肾癌患者的癌及癌旁组织进行免疫组化染色并进行分析,发现CREPT表达定位于肾癌细胞的胞核内。用半定量的方法对比90例患者癌组织与癌旁组织中CREPT表达水平,发现46.7%的患者癌组织中CREPT表达为高水平(图1A),而在癌旁组织中,所有患者CREPT表达均为低水平(图1B),差异有统计学意义(P<0.05),详见表1。

图1 CREPT在肾癌组织与癌旁组织中的表达差异Fig.1 CREPT express level in renal cell carcinoma and adjacent tissues(DAB staining, 200×)A: CREPT is highly expressed in renal cell carcinoma; B: CREPT is lowly expressed in adjacent tissues; CREPT: cell-cycle-related and expression-elevated protein in tumor.
2.2 CREPT表达与肾癌患者临床病理特征的关系
将肾癌组织中CREPT表达水平分为高表达组和低表达组,其中高表达组42例,低表达组48例。TNM分期高(Ⅲ/Ⅳ期)和Fuhrman分级高(G3/G4)的患者,CREPT的表达水平较高,组间比较差异有统计学意义(P<0.05)。CREPT的表达水平与性别、年龄、肿瘤大小和组织学类型无关(P>0.05),详见表2。

表1 90例肾癌组织与癌旁组织中CREPT表达情况
2.3 CREPT表达与肾癌患者预后的关系
截至2018年12月,85例患者完成随访,失访5例。其中高表达组38例, 11例复发或转移,7例因肿瘤复发死亡。低表达组共有47例,3例复发或转移,仅1例死于复发。Kaplan-Meier分析显示,CREPT高表达组患者的总生存时间(图2A,χ2=5.319,P=0.021)和无瘤生存时间(图2B,χ2=5.958,P=0.015)低于CREPT低表达组,差异有统计学意义(P<0.05)。多因素COX回归分析显示,患者总生存时间及无瘤生存时间与CREPT的表达水平有关(P<0.05),详见表3、4。
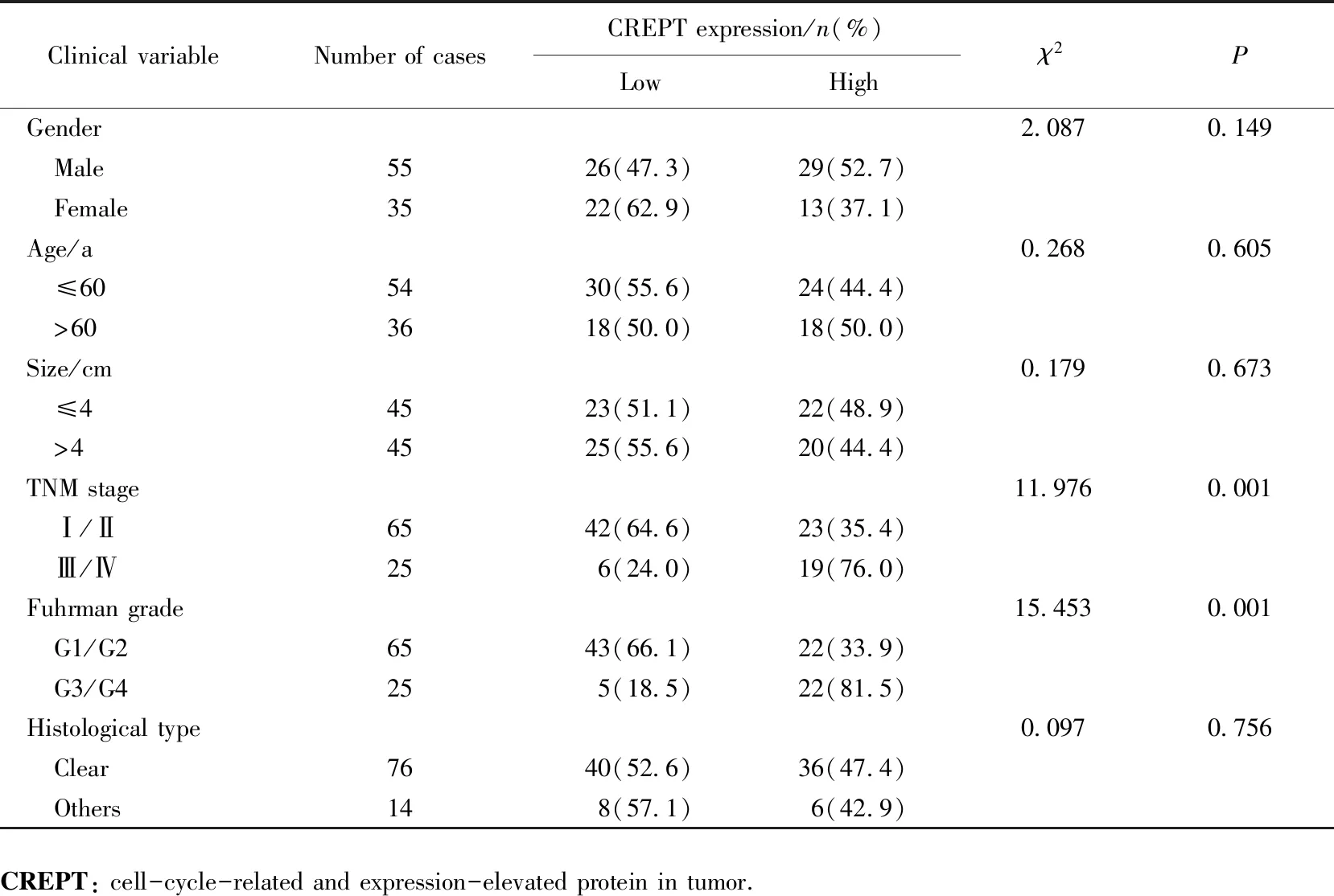
表2 肾癌组织中CREPT表达与临床病理特征的关系
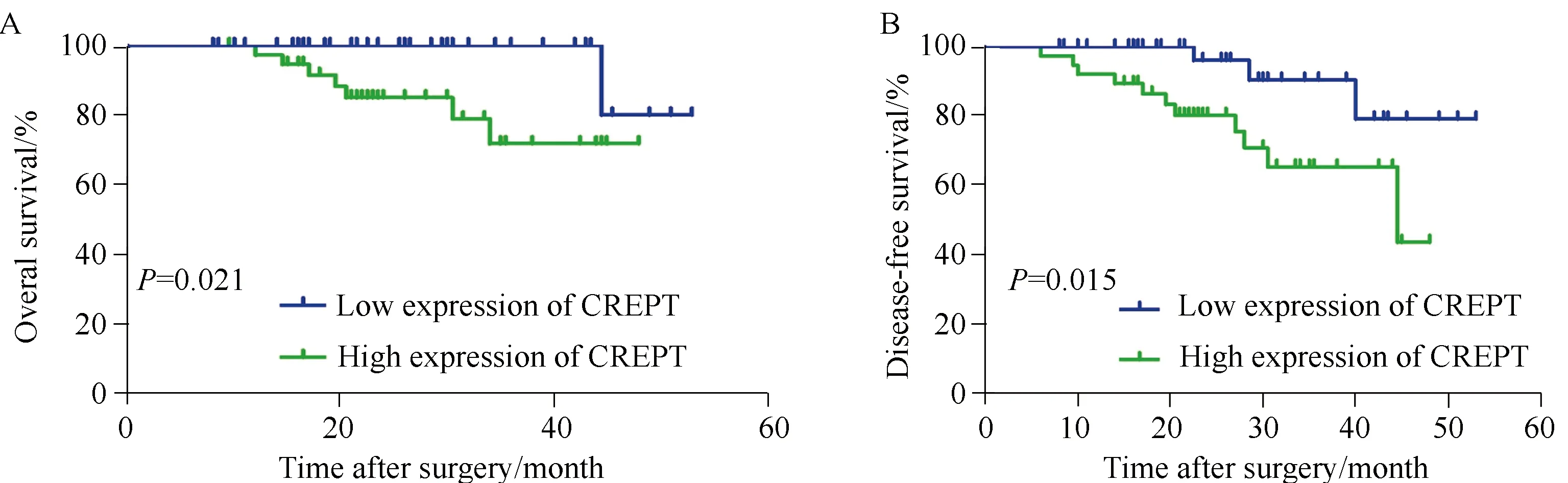
图2 CREPT表达与患者生存时间之间的关系Fig.2 The relationship between CREPT expression and the survival of RCC patientsA: Correlation between CREPT expression and overall survival in RCC by Kaplan-Meier analysis; B: Correlation between CREPT expression and disease-free survival in RCC by Kaplan-Meier analysis; CREPT: cell-cycle-related and expression-elevated protein in tumor; RCC: renal cell carcinoma.

表3 多因素COX回归分析患者总体生存时间影响因素
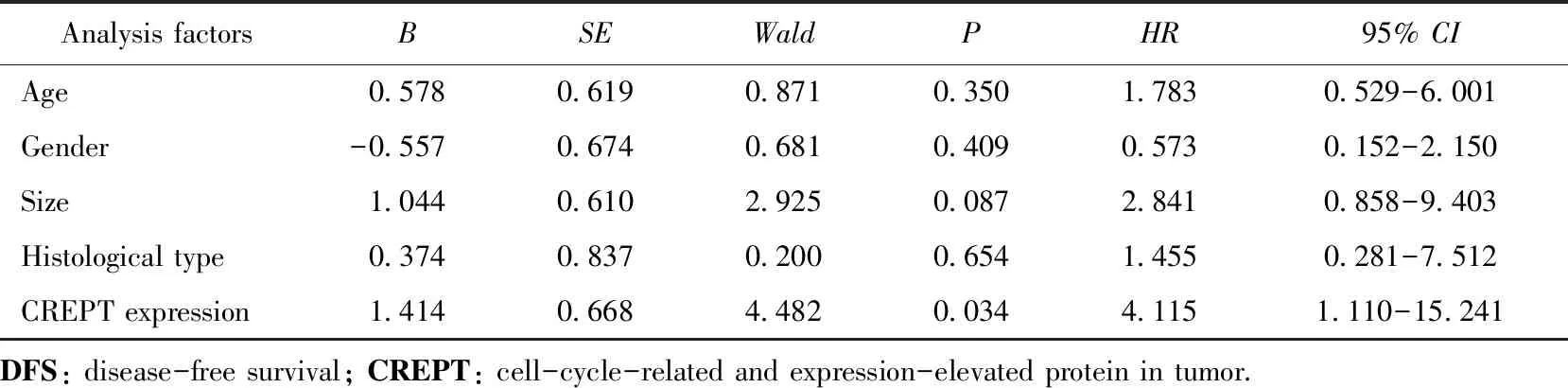
表4 多因素COX回归分析患者无瘤生存时间影响因素
3 讨论
近年来随着诊断技术的提高,早期肾癌的临床治疗效果得以显著改善,一旦肾癌出现复发和远处转移,患者的远期生存率将明显受到影响[5]。因此,寻找与肾癌进展相关的分子标志物对于改善治疗策略和判断预后具有重要意义。
目前普遍认为细胞周期的紊乱几乎与所有人类肿瘤密切相关[9-10]。既往研究[11]证实,细胞周期蛋白Cyclin D1在肾癌的发生和发展中起到关键作用。许多转录调节因子的异常表达可促进Cyclin D1过表达,最终导致肿瘤发生[12]。
CREPT基因是含有RPR关键结构域的酵母RTT103基因的人类同源基因,该基因定位于人第20号染色体长臂1区,编码相对分子质量约37 000的蛋白质,由清华大学医学院常智杰实验室克隆鉴定[6]。研究[6, 13]显示,该基因能够和转录中的关键酶——RNA聚合酶Ⅱ(RNAPⅡ) 在细胞周期蛋白CyclinD1 基因的启动子上结合,并且使CyclinD1 基因形成环状结构,这种环状结构的形成进一步可能会促进基因转录。越来越多的证据[6,14-16]显示,CREPT与一些肿瘤的发生及进展密切相关。CREPT作为Cyclin D1的调节因子,已被发现在肺癌、肝癌、乳腺癌、前列腺癌、胃癌、宫颈癌和子宫内膜癌等多种肿瘤组织中高表达,并且其表达水平与胃癌患者的生存时间密切相关[6]。CREPT在结肠癌、非小细胞肺癌及平滑肌肉瘤等肿瘤中均呈高表达趋势,并且对肿瘤的恶性生物学行为具有促进作用[14-16]。但是,迄今为止,肾癌组织中CREPT的表达情况尚不得而知,其表达水平是否与肾癌的临床病理特征和预后判断相关也亟待阐明。
本组资料结果显示,46.7%(42/90)的患者癌组织中CREPT表达为高水平,而其他53.3%的患者CREPT表达为中低水平,究其原因,一方面可能因为肾癌的发生是一个多因素、多环节参与的过程,另一方面可能因为石蜡切片时间久远,可以采用新鲜标本进一步扩大入组病例来完成。
单因素分析表明,CREPT的表达水平与肾癌的TNM分期和Fuhrman分级有关,与肿瘤大小和组织学类型无关。肾癌组织中CREPT的表达水平越高,则患者临床分期越晚,Fuhrman分级越高。本组90例患者中,≤4 cm肿瘤45例,>4 cm肿瘤45例;透明细胞癌76例,其他组织学类型14例。本组资料中,CREPT的表达与肿瘤大小和病理类型无关。
在随访期间,CREPT高表达组(38例)中有11例患者复发或转移,7例因肿瘤复发死亡。低表达组(47例)中,3例患者复发或转移,仅1例死于复发。多因素COX回归分析显示,患者总生存时间与无瘤生存时间与CREPT的表达相关(P<0.05)。Kaplan-Meier分析显示,高表达组患者的总生存时间和无瘤生存时间显著低于低表达组(P<0.05)。由此说明,CREPT高表达与肾癌的恶性病理特征相关,在本组病例中可以作为预后判断的指标,这些结果都提示CREPT对于肾癌的恶性生物学行为有显著促进作用。
CREPT促进肿瘤发生发展的具体机制尚未完全阐明。已有研究[6]结果证实,CREPT能促进细胞周期G1/S转换和Cyclin D1的表达。常智杰等[6]通过细胞学实验发现,过量表达CREPT促进细胞生长,克隆形成增多,肿瘤生长加快和细胞周期G1/S转换加速。染色质免疫共沉淀实验[6]显示,CREPT结合在Cyclin D1的启动子和poly A前面的区域。进一步的3C实验[6,13]证明CREPT调控Cyclin D1的转录是通过形成染色质环,即:当RNA聚合酶Ⅱ(RNAPⅡ)到达Cyclin D1的启动子区,CREPT和RNAPⅡ相互作用,促进Cyclin D1的转录;当RNAPⅡ到达Cyclin D1的poly A前面的区域,CREPT和RNAPⅡ相互作用,阻止 RNAPⅡ继续前进,通过染色质环让 RNAPⅡ又回到Cyclin D1的启动子区,从而加速Cyclin D1的转录[6,13]。研究[6]还显示, CREPT对Wnt/β-catenin 信号通路起促进作用,过表达 CREPT可以促进Wnt/β-catenin信号通路激活,而敲低CREPT则抑制该通路激活。进一步研究[17]显示,CREPT可以与β-catenin和TCF4相互作用,并且促进β-catenin/TCF4转录复合体的形成及在靶基因启动子区的结合,从而增强Wnt/β-catenin信号通路下游靶基因的转录。但是,在肾癌发生、发展过程中,CREPT具体通过哪种分子机制发挥作用,这两种分子机制之间是否存在信息交换或者相互促进,哪种机制在促进肾癌的恶性生物学行为中起主导作用,将是本课题下一步重点研究方向。
总之,本研究首次报道了CREPT在肾癌组织中呈过表达现象,并且与患者的病理分期、分级和预后密切相关。因此,CREPT有望作为评估肾癌患者临床预后的分子标志物。
