64 例改良式同侧胰肾联合移植围术期护理 临床效果评价分析
2020-07-21邓绚莹张伟婷李嘉莉金敏张婉祎广州医科大学附属第二医院器官移植中心广东广州510260
邓绚莹,张伟婷,李嘉莉,金敏,张婉祎(广州医科大学附属第二医院器官移植中心,广东 广州 510260)
糖尿病是全球性疾病,约40% ~ 50% 1 型糖尿病和20%的2 型糖尿病患者最终会发生肾功能衰竭等严重并发症[1]。预计到 2030 年,世界范围内的糖尿病肾病患者将超过 1 亿[2]。胰肾联合移植(simultaneous pancreas and kidney transplantation,SPK)是治疗糖尿病合并肾功能不全的首选方案,是目前多器官联合移植中已实施数量最多,也是最为成熟的一种[3]。美国糖尿病协会发表声明提出:对于计划进行肾移植终末期肾病合并糖尿病的患者而言,胰腺移植是胰岛素治疗的理想替代疗法。研究表明,接受SPK 的患者术后能有效摆脱胰岛素依赖,其存活率高于仅接受了肾移植的糖尿病患者[4]。然而,由于SPK 的手术难度大、且外科并发症发生率较高,其护理具有较大的难度。广州医科大学附属第二医院器官移植中心已成功完成改良式同侧胰肾联合移植64 例,经过精心的治疗与护理,大部分患者顺利康复出院,现报告 如下。
1 临床资料
1.1 一 般 资 料:2016 年9 月— 2018 年12 月 在我中心接受胰肾联合移植的患者共64 例,其中, 男性52 例,女性12 例,年龄(48.8±9)岁,平均 体 重 指 数(body mass index,BMI) 值 为22.8; 1 型 糖 尿 病 肾 病9 例,2 型 糖 尿 病 肾 病55 例, 术前规律血透患者54 例,未透析10 例。术前 空腹C 肽(7.4±2.72) ng/ml,空腹胰岛素(13.7± 5.58) mmol/L,糖 化 血 红 蛋 白(6.6±1.64) mmol/L,血清肌酐(849.5±304.7) μg/L。供体平均年龄(31.2±9)岁,男性56 例,女性8 例。
1.2 手术方式:胰肾联合移植手术方式一直在演变发展,目前,较多移植中心采用的方式是将胰腺和肾脏放置于两侧髂窝。本中心采用的是供肾供胰置于同一侧髂窝的手术方式[5],并将手术方式进行了改良,将供胰的门静脉与受体下腔静脉端侧吻合,避免游离受体门静脉。这种改良式同侧胰肾联合移植的新术式,为患者再次移植保留了一侧髂血管;减少一次在受体动脉血管的吻合;降低传统手术方式对胰腺的高灌注,且移植物均位于右下腹,减少了致命性全腹膜炎的发生率,操作相对简单,缩短手术时间。手术方式如图1 所示。
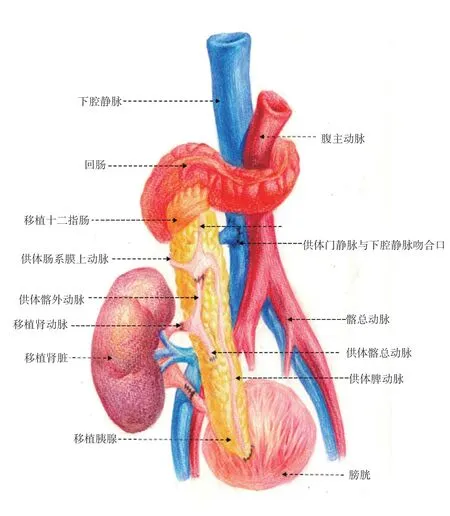
图1 改良式同侧胰肾联合手术示意图
1.3 术后处理:术后胰腺开始正常分泌胰岛素,血糖水平基本可以恢复到正常水平,正常情况下不需要通过外源胰岛素控制血糖。预防性应用广谱抗菌药物,3 ~5 d;血肌酐水平恢复正常和接近正常后,静脉注射更昔洛韦250 mg/d,10 ~14 d,预防 CMV 感染。肾周引流管术后 48 ~72 h 拔除,胰周引流管术后 4 ~5 d 后,视引流量酌情拔除。术后视凝血功能监测情况进行抗凝治疗。生长抑素4 ml/h 泵入抑制胰液分泌,1 周后改皮下注射。术后第1 天开始进行全胃肠外营养支持,第 7 天拔除胃管,逐渐恢复经口进食。术后 14 d 拔除导尿管。术后第3 ~ 4 天即可开始下床活动。
1.4 统计学分析:数据用SPSS20.0 软件分析,连续性资料采用均数±标准差(±s)的方式表达,人、胰、肾存活率情况采用Kaplan-Meier 生存分析法进行统计。所有的统计方法的检验水准α =0.05。
1.5 伦理学:本研究符合医学伦理学标准,得到医院伦理委员会审批(审批号:2020-hg-ks-06)。
2 结 果
随访至今,64 例患者取得较好的临床疗效, 术 后1、3、6、12、24 个 月 的 血 肌 酐 为(119.85±51.39) μmol/L、(114.38±43.78)μmol/L、(115.42±44.62) μmol/L、(110 .96±28.94) μmol/L、 (112.48±34.57) μmol/L, 空 腹 血 糖 为(5.63± 1.38) mmol/L、(4.80±0.45) mmol/L、(4.95±0.66) mmol/L、 (4.80±0.56) mmol/L、(4.82±0.53) mmol/L。人、胰腺、肾脏1 年及2 年累计存活率分别为94.4%、92.9%、92.9%和94.4%、92.9%、92.9%。术后并发症发生情况如表1 ,以内科并发症为主;术后出现1 例移植肾功能延迟恢复,4 周后恢复正常;1 例移植肾失功,其余受者移植肾功能恢复良好。97%患者的血糖术后2 ~ 3 d 内可降至正常水平,摆脱胰岛素依赖。移植胰腺切除2 例,其中1 例患者因胰十二指肠漏切除胰腺,严重腹腔感染合并脓毒症死亡;1 例因移植胰血栓形成切除胰腺,其余患者随访至今移植胰功能均恢复良好。死亡3 例,其中2 例死亡原因为重症肺炎,1 例为肠漏并发腹腔感染致脓毒症。
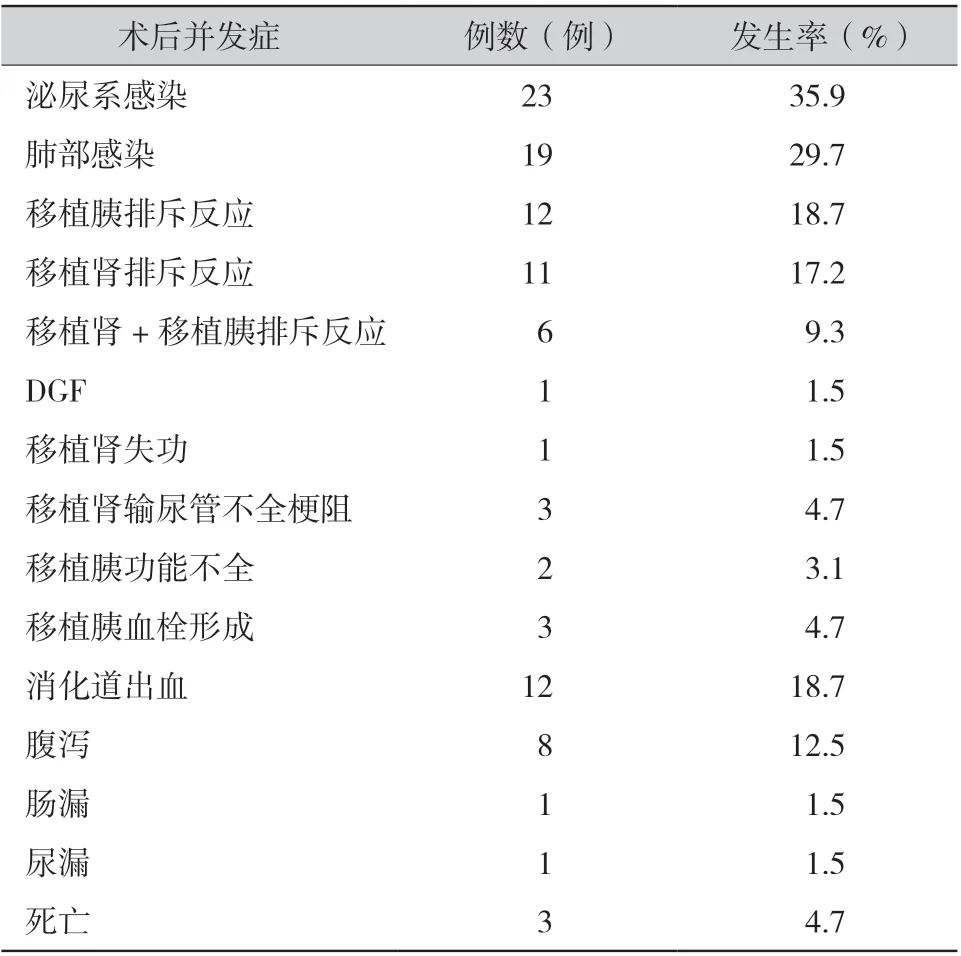
表1 64 例改良式同侧胰肾联合移植并发症发生情况
3 讨 论
3.1 术前肠道准备:胰腺移植的外分泌系统采用肠内引流的方式,需要将供体十二指肠与受体回肠进行吻合,因此,移植前的肠道准备非常关键。肠道准备在受体接到手术通知时开始启动,术前1 d低纤维半流饮食,术前一晚开始行肠道准备,禁食,比沙可啶肠溶片10 mg 口服,聚乙二醇电解质两包兑2 000 ml 温水,每10 min 服用250 ml,2 h 内服完,观察患者排便情况,直至排出清水样便。受者在肠道准备前停止胰岛素注射和口服降糖药,并监测血糖,警惕低血糖发生。对于心功能不全的患者,一次性口服大量溶液易增加心脏容量负荷,可分次口服,每次1 000 ml。
3.2 术后护理
3.2.1 血糖管理:血糖是胰肾联合移植术后的重要监测指标,是评估胰腺功能是否恢复的重要观察指标之一。由于手术应激及大剂量激素的应用,少数患者术后血糖可能会出现应激性升高,但大部分患者术后血糖均能恢复到正常水平。术后当天至第1 天q1h 监测血糖,稳定情况下术后第2 天开始改为2 ~ 3 h 监测一次,术后第4 天开始4 h 一次,至患者恢复经口进食后改为三餐前和三餐后2 h 监测。术后仅有2 例患者因血糖偏高再次使用胰岛素,但剂量远低于术前水平,其余患者术后1 ~ 2 d 血糖恢复正常值,摆脱胰岛素依赖。另外,应警惕血糖的异常情况,血糖异常可以作为移植胰排斥反应或移植胰腺炎、移植胰血栓等并发症的早期临床 表现。
3.2.2 营养管理:尽管欧洲胃肠外营养协会提出,术后早期肠内营养是围术期管理的重要组成部分,然而,关于胰肾联合移植术后早期肠内营养的应用证据有限[6],且肠内引流的手术方式不建议过早进行肠内营养,会加重肠道负担,促使胰液过多分泌,造成胰十二指肠吻合口漏、胰十二指肠排斥反应、出血等严重并发症。充分的营养支持能促进机体恢复和伤口愈合,因此,应与营养科合作共同制定胰肾联合移植营养方案:术后第1 天开始用脂肪乳氨基酸葡萄糖注射液(卡文)加脂溶性维生素进行肠外营养支持,术后第7 天拔除胃管后恢复经口进食。胃管拔除后第 1 ~2 天开始进半量流质饮食,用安 素营养粉剂(TP)提供高质量的肠内营养支持; 全量流质 2 ~3 d,继续服用安素分作为补充营养支持;再过渡到半量半流质饮食 2 d,全量半流质 2 d,最后逐渐过渡到普通饮食,避免进食过硬的食物,饮食原则为高维生素、低糖、低脂、优质蛋白饮食,禁食油腻、高脂肪、高糖食物,避免加重胰腺负担。在患者恢复经口进食期间,应注意观察腹部体征和胃肠道反应,监测血尿淀粉酶、血清脂肪酶和血糖指标。
3.2.3 液体管理:液体管理是胰肾联合移植术后护理的重点和难点,术后出入量的合理控制,保证血流动力学最佳化,可减少移植肾功能延迟恢复的发生[7]。术后准确记录每小时出入量,量出为入,目标导向液体治疗,根据患者术前透析类型、年龄、体重、心功能、全身有无水肿、尿量、血压、中心静脉压、术中液体出入量制定个体化液体方案, 每个班次按要求完成目标液体量。64 例受者仅 1 例发生移植肾功能延迟恢复,1 例因移植胰切除术后并发移植肾急性排斥反应致移植肾失功,恢复 透析。
3.2.4 皮肤护理:本中心采取了比膀胱引流更符合解剖结构特点的肠道引流,降低了泌尿系统并发症,但由于肠道引流将胰腺分泌的胰液直接引流到回肠,大部分患者早期容易发生腹泻。加之器官移植受者的免疫抑制状态,对环境卫生和个体卫生要求较高。因此,本中心全面推行氯己定无盆擦浴,一项Meta 分析表明[8],使用氯己定擦浴可以减少皮肤表面革兰阳性菌和阴性菌的滋生,有助于降低多重耐药菌定植和静脉导管相关性血流感染。留置尿管期间会阴抹洗(2 次/d),口腔护理(2 次/d),碳酸氢钠和生理盐水交替漱口,鼓励患者病情稳定后床旁刷牙,早晚各1 次。
3.2.5 管道护理:胰肾联合移植术后常规留置胃管胃肠减压、中心静脉置管、胰头后方引流管、膀胱直肠陷凹引流管、肾周引流管及尿管。术后应做好管道标识,和手术医生双人核对,避免管道标识错误;高举平台法妥善固定,防止脱管,管道避免扭曲受压、堵塞,定时挤压引流管。引流液是术后并发症的重要观察窗,严密观察引流管的量、颜色和性状,每班计量,班班交接,引流管突然引出大量血性液应警惕活动性出血。保持有效引流,保持各引流管的通畅,及时倾倒引流液,避免逆行感染,必要时留取引流液做细菌培养。我们采用供受体输尿管端端的吻合方式,术中常规留置双“J”支架管,防止输尿管梗阻,术后留置双腔导尿管,使用精密集尿器防止逆行感染,保证每小时尿量的精确统计,保持尿管通畅,尿管常规术后14 d 拔除。
3.2.6 排斥反应的观察和护理:胰肾联合移植术后的急性排斥反应依然是导致移植物功能不全或者丢失的重要原因[9]。胰腺移植排斥反应的临床表型各异,缺乏特异性,且因穿刺活检风险较大, 而难以依靠病理活检明确诊断。其表现缺乏特异性或表现隐匿,患者常没有自觉症状,其早期诊断往往较为困难,而同一供者的胰肾移植,血肌酐可作为排斥反应的标记物,因为排斥反应通常涉及两个器官,而且通常是移植肾早于移植胰腺发生排斥反应。临床表现:不明原因的移植肾或(和)移植胰区胀痛、尿量减少、伴体温上升、血压升高、尿浑浊或呈血性,结合血肌酐、血糖和血尿淀粉酶的动态变化、影像学检查等辅助诊断。排斥反应可以是单一器官,也可以是两个器官同时发生,其中有 2 例发生供胰十二指肠排斥反应。对64 例受者的观察护理发现,移植胰腺排斥反应的临床表现各不相同,可以是几个症状并存,也可以是只存在某一种症状。其中,有1 例患者仅表现为血糖升高,有1 例患者仅表现为血尿淀粉酶升高,一般通过小剂量甲泼尼龙冲击治疗后均可逆转,有2 例患者接受免疫诱导治疗后逆转。
3.3 并发症的观察和护理
3.3.1 肺部感染:术后大剂量免疫抑制剂所致机体免疫机制受损,机体处于低免疫状态,加之糖尿病本身的易感性,胰肾联合移植术后的感染发生率更高。肺部感染19 例,发生率为29.7%,其中 2 例因重症肺炎治疗无效,死亡。预防肺部感染在护理上应做到:早期呼吸功能锻炼,督促患者进行呼吸功能锻炼,术后有效咳嗽、排痰,鼓励患者早期下床活动,预防坠积性肺炎;保持口腔清洁:术后常规用生理盐水和碳酸氢钠交替漱口, 早晚各刷牙一次;病房保证合适温湿度,有效预防霉菌生长,通风一天2 次,每次30 min,空气净化一天2 次,每次1 h;加强病房管理,限制人员 探视。
3.3.2 泌尿系统感染:尿路感染23 例,发生率高达35.9%。尿路感染的高发除了免疫抑制和糖尿病受者本身的易感性外,还跟导尿管留置时间有关。手术方式决定了尿管留置时长,过早拔除会发生尿漏、吻合口漏等严重外科并发症。尿路感染不仅引起畏寒、发热等不适症状,还延长了患者的平均住院天数,增加其他并发症发生的风险,护理人员应正确掌握尿管的护理要点:保持装置的密闭性:密闭的尿液引流系统能有效预防尿路感染的发生[10],避免频繁或常规更换尿管和引流袋,应基于临床指征进行更换;保持会阴部清洁卫生,用生理盐水清洗尿道口、会阴区、导管表面,不建议常规使用抗菌溶液、乳霜或软膏清洁尿道口、会阴区、导管表面[11];妥善固定导尿管,引流袋内液面应低于膀胱水平,但引流袋排尿端不应接触地面或尿液收集器;及时倾倒尿液防止逆流;在病情允许的情况下,鼓励患者适当饮水,维持尿量 50 ~ 100 ml/h。
3.3.3 腹泻和消化道出血:肠内引流术式将胰腺分泌的胰液直接引流至肠道,由于胰液刺激易诱发腹泻,加之术后应用低分子肝素预防血栓形成, 消化道出血的发生率也较高,消化道出血12 例,发生率为18.6%,经处理病情均得到有效控制和逆转。消化道出血临床表现为便血,一旦发生应立即停用所有抗凝药,予止血、禁食、生长抑素抑制胰腺分泌,必要时输注血浆和红细胞。这些患者均出现了不同程度的腹泻,腹泻是失禁性皮炎发生的危险因素,早期因前瞻性护理不到位,发生失禁性皮 炎2 例。在《国内外失禁相关性皮炎护理实践专家共识》的指导下,凡是每日大便次数超过3 次以上者,均预防性使用3M 洁肤液和3M 液体敷料,有效避免失禁性皮炎的发生[12]。
3.3.4 移植胰胰腺炎:移植胰胰腺炎是术后最常见的并发症之一,主要与手术损伤、缺血/再灌注损伤、肠液或尿液反流、排斥反应、感染、进食不当等因素有关。临床表现为移植部位腹壁区疼痛、 腹胀、压痛、血、尿淀粉酶显著升高。术后合理饮食的健康教育尤为重要,通过合理饮食健康教育手册和主题健康教育讲座,提高受者术后合理饮食的依从性。1 例患者因移植胰排斥反应诱发胰腺炎,临床表现为血尿淀粉酶和血糖进行性升高,经过抗排斥反应、禁食、生长抑素治疗后治愈。
3.3.5 胰漏和肠漏:供胰修剪时胰腺实质的损伤、植入胰胰腺炎、排斥反应、血供障碍导致的胰腺组织或十二指肠残端坏死、移植胰周围感染、输出道狭窄或梗阻均可引起胰漏,主要临床表现为移植部位腹壁区疼痛、腹胀、压痛,血尿淀粉酶显著升高。肠漏往往出现腹痛、恶心呕吐、发热、白细胞计数升高、腹膜炎和脓毒血症。肠漏一般需要剖腹探查,早期肠漏常见于吻合口,可以修补或者重新吻合,如果合并腹膜炎、脓毒血症或者移植胰坏死则需要切除移植胰。1 例患者术后1 周发生肠漏并发腹腔感染和脓毒症,死亡。
3.3.6 移植胰血栓形成 :胰腺是低血流灌注器官,移植术后容易发生血栓,移植胰血栓形成是术后早期移植胰丧失的主要原因之一,术后需常规使用抗凝药预防血栓形成,术后凝血功能的监测和临床护理的观察尤为重要。移植胰血栓形成3 例,发生率为4.7%,2 例经抗凝治疗后逆转,1 例并发胰门静脉及肠系膜上动脉血栓,抗凝溶栓治疗无效,切除胰腺。
研究表明,尽管SPK 是目前最为成熟的多器官联合移植手术,但由于其手术方式较为复杂,术后 并发症发生率较高[13]。这对护理团队的专业技能提出了更高的要求,对术后患者病情的观察和临床判断需要更加细致、全面和准确,护理的重点难点主要聚焦在术后并发症的观察和护理上,特别是改良式胰肾联合移植,由于手术方式的改变,需要 同步改进临床护理技术,主要体现在3 个方面: ① 内分泌回流采用体静脉回流方式实现,术后胰腺分泌的胰岛素直接释放入血,大部分患者术后血糖水平能稳定在正常水平,少部分患者可能会反复出现血糖偏低,甚至是低血糖。因此,术后血糖的监测和管理至关重要。② 外分泌引流选择了比膀胱引流更符合解剖结构特点的肠道引流,大大减少膀胱并发症,肠道引流将胰腺分泌的胰液直接引流到回肠,部分患者容易诱发腹泻,因此,皮肤护理是术后护理中的重要部分。有效清洁和预防性使用皮肤保护剂是预防失禁性皮炎的有效干预措施。 ③ 肠道引流术式要求持续胃肠减压7 d,减少胃液刺激和胰液分泌,预防胰漏和肠漏。长时间禁食、手术的复杂性加之胰腺器官功能的特殊性,导致对患者的营养管理尤为重要,科学的营养评估、个体化的营养方案和饮食指导是术后营养管理的关键环节。
