散发性SDH缺陷型胃肠道间质瘤26例临床及分子病理学特征
2020-07-20时姗姗叶胜兵夏秋媛周晓军
时姗姗,沈 勤,叶胜兵,吴 楠,王 璇,夏秋媛,李 锐,鲍 炜,周晓军
琥珀酸脱氢酶(succinate dehydrogenase, SDH)缺陷型胃肠道间质瘤(gastrointestinal stromal tumor, GIST)是近年发现的一类SDHB免疫阴性,具有特征性临床病理表现的异质性肿瘤,其临床病理学特征、免疫表型及分子遗传学改变均不同于Kit或PDGFRa突变型GIST[1]。目前对其临床病理学特征有了一定的认识,但这类肿瘤的分子发病机制尚未明确。本实验从366例原发性GIST中筛选出26例SDH缺陷型,首次用甲基化特异性PCR、直接测序法观察SDH基因突变以及启动子甲基化状态,并结合患者的临床病理资料,深入探讨SDH缺陷型GIST的临床病理学特征、免疫表型、分子遗传学改变以及潜在分子机制。
1 材料与方法
1.1 临床资料收集2005~2010年解放军东部战区总医院病理科存档的366例GIST,由两位高年资病理医师根据WHO(2012)消化系统肿瘤分类标准,并通过检测Kit及PDGFRa基因及SDHB免疫阴性筛选出26例SDHB缺陷型GIST,收集患者的临床病理资料。
1.2 方法
1.2.1免疫组化及结果判断 免疫组化染色采用EnVision法。一抗包括CD117(Polyclonal, Dako公司,稀释度1∶100)、DOG1(Polyclonal,福州迈新公司,稀释度1∶100)、SMA(1A4,ZETA公司,稀释度1∶300)、S-100(Polyclonal,Dako公司,稀释度1∶2 000)、Ki-67(MIB1,福州迈新公司,稀释度1∶300)和SDHB(21A11AE7,Abcam公司,稀释度1∶300)。高倍镜(400×)下选取10个有代表性的视野,计算免疫标记细胞的阳性率(阳性瘤细胞数/总瘤细胞数)×100%。细胞阳性率占0~5%为阴性(-);6%~10%为灶状阳性(+);11%~50%为中度阳性();51%~100%为弥漫强阳性()。
1.2.2直接测序法 根据基因库DNA序列设计引物(表1),分别扩增SDHB基因8个外显子、SDHC基因6个外显子及SDHD基因4个外显子,包含全部编码序列。所有引物均由上海桑尼生物公司合成。用DNA测序仪3730进行DNA双向测定序列,结果经ABI公司软件分析。
1.2.3DNA CpG岛甲基化检测 采用“MethPrimer”在线软件预测SDHA、SDHB基因启动子区CpG岛甲基化检测引物(表1),并用全基因组扩增(WGA)的DNA验证甲基化引物的特异性。以至少为100 bp,GC含量>50%,CpG出现频率>0.6为筛选标准。根据操作流程使用DNA亚硫酸氢盐的转化试剂盒(QIAGEN)。经处理后,DNA上非甲基化的胞嘧啶“C”转化为尿嘧啶“U”,而发生甲基化的“C”处理后不变。PCR所得产物经测序鉴定结果:未发生甲基化的DNA序列,测序C的位置被T取代;发生甲基化的CpG岛,测序出现“C”单峰或“C”和“T”的套峰。

表1 SDHx基因引物
2 结果
2.1 临床特征根据免疫表型SDHB阴性,Kit与PDGFRa基因检测为野生型的诊断标准,从366例原发性GIST中筛选出26例SDH缺陷型GIST,占全部病例的7.10%。26例中:男性13例,年龄35~67岁,平均51.38岁;女性13例,年龄18~71岁,平均50.00岁。高风险5例(19.23%),中风险5例(19.23%),低风险5例(19.23%),极低风险11例(42.31%)。发病部位:胃23例(88.46%),小肠2例(7.70%),其他1例(3.85%)。1例(3.85%)肿瘤直径≥10 cm,25例(96.15%)<10 cm。21例(80.77%)核分裂象<5个/50 HPF,1例核分裂象介于5~10个/50 HPF(3.85%),4例(15.38%)核分裂象≥10个/50 HPF(表2)。
2.2 病理特征及免疫表型根据组织学特点SDH缺陷型GIST分为3种亚型:梭形细胞型21例、上皮样细胞型4例及混合型1例(图1)。除SDHB阴性外,26例GIST没有显示出特异的免疫表型:CD117及DOG1均呈强阳性,SMA及S-100阴性或散在弱阳性,Ki-67增殖指数常常较低。
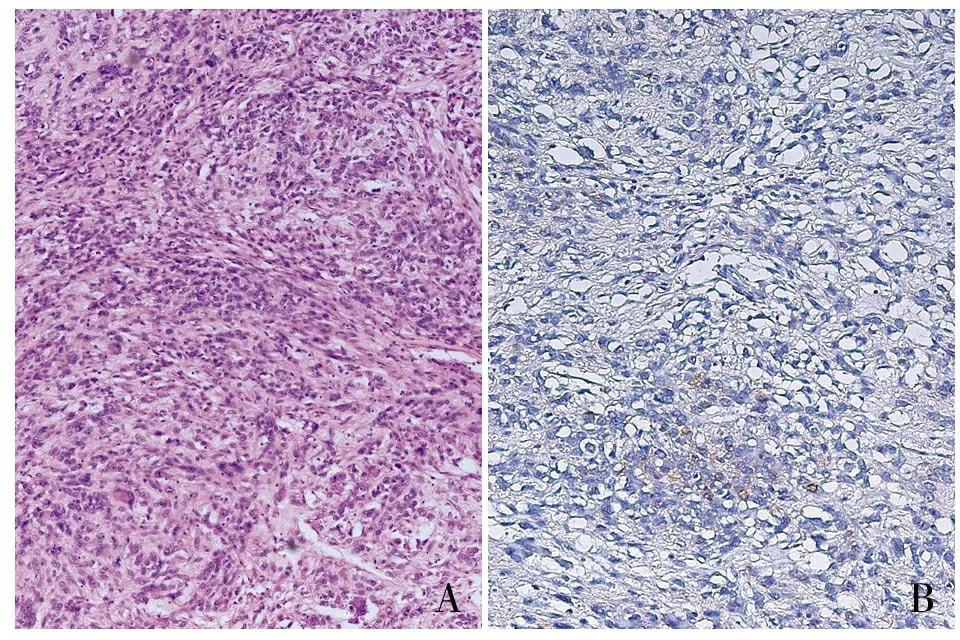
AB
2.3 基因检测结果基因突变及启动子甲基化状态检测结果显示(表2,图2),15例(57.69%)至少存在一项SDH基因异常,其中6例存在两项SDH基因异常。10例(38.46%)检测出基因氨基酸编码区域突变,3例发生双突变。共13个突变位点,SDHB基因突变3例(11.54%),SDHC基因突变3例(11.54%),SDHD基因突变7例(23.08%)。突变类型包括10例错义突变,3例同义突变。10例(38.46%)检测出基因启动子甲基化异常,其中SDHA基因甲基化8例(30.77%),SDHB基因甲基化3例(11.54%),1例SDHA、SDHB基因同时甲基化。

表2 26例SDH缺陷型胃肠道间质瘤的临床病理资料

图2 SDHx测序图及甲基化测序图:A.(例2)SDHD基因E1 1A>G错义突变(M1V);B.(例3)SDHD基因E1 39C>T同义突变(A13A);C.(例5)SDHB基因启动子甲基化;D.(例6)SDHA基因启动子甲基化
3 讨论
GIST是消化系统最常见的间叶性肿瘤,近年来发现了一类SDHB免疫阴性的亚型,被称为SDH缺陷型GIST[2],易出现在Carney三联征、Carney-Stratakis综合征中[3-5]。SDH缺陷型GIST具有独特的临床病理特征:多见于女性,易发生于胃,具有上皮样细胞形态,易发生淋巴结转移,也可为多灶性,Kit及PDGFRa基因野生型[1,6]。但这些特征并非绝对特异性[7],为进一步阐明SDH缺陷机制,采用甲基化特异性PCR、直接测序法检测26例SDH缺陷型GIST中SDH亚基基因突变状态及启动子甲基化水平,探讨该类型GIST潜在的分子机制。
本组366例原发性GIST,利用免疫表型及基因检测结果筛选SDH缺陷型26例,占全部病例的7.10%,与报道中SDH缺陷型GIST占成人散发性GIST的5%~7.5%基本相符[8]。患者性别无明显差异,但发病年龄年轻化[9]。26例中23例发生于胃,与Doyle等[3]报道的结果基本相符,但Carney-Strataki综合征或Carney三联征SDH缺陷型GIST发病部位仅限于胃[10]。组织学上,上皮样细胞形态比例较高[9]。除SDHB免疫阴性外,26例GIST没有显示出特异的免疫表型[11-12],Ki-67增殖指数常常较低,提示肿瘤预后较好。这些临床病理特征均提示这类肿瘤具有独特的发病机制及治疗方式[1,6]。
SDH位于线粒体内膜,属于线粒体呼吸链复合体Ⅱ的复合酶,具有4个亚基(A~D),均属于抑癌因子[13]。SDH在三羧酸循环中通过电子传递,催化琥珀酸氧化到延胡索酸[13],目前已证实这个反应在代谢中起着至关重要的作用,如电子传递、底物水平磷酸化、酮体利用、血红素代谢等。对其研究一直以来主要局限于线粒体呼吸介质和能源生产者,但近年开始关注其它方面的作用[14],如导致某些代谢性病的并发症,促进炎症的活化反应[15]、肿瘤的发生及进展等[16]。SDH复合物中任何一个亚蛋白的缺陷,特别是SDHB将破坏复合物结构稳定,影响其功能[6],从而造成琥珀酸的异常积累。作为线粒体呼吸链复合物Ⅱ的铁硫亚基,SDHB通常在胞质中呈颗粒状表达。SDHB免疫阴性是SDHB突变的嗜铬细胞瘤、副神经节瘤的诊断标志物[11,17],也是衡量复合物功能失活的重要指标[11,18]。
对于SDH缺陷型GIST的亚基突变的研究,Janeway等[19]发现4例SDHB和SDHC突变,而Miettinen等[8]则未检测到SDHx基因突变。在家族性SDH缺陷型GIST中约50%发生SDH亚基突变,其中A亚基占30%,因此推测存在其他形式造成功能缺陷可能性[20-21]。除基因突变,SDHB蛋白缺失可能还由于亚基的等位基因丢失、表观遗传修饰、基因启动子区的甲基化,或参与SDH复合物稳定性的其他蛋白缺陷导致功能的丧失[22-23]。目前有关SDH缺陷型GIST中启动子甲基化的研究较少,2015年报道1例存在SDHC基因异常甲基化[24]。本实验检测到10例(38.46%)亚基基因发生氨基酸编码区域突变,13个突变位点。其中10个错义突变,直接影响其氨基酸序列。甲基化特异性PCR法检测到10例(38.46%)基因启动子甲基化异常。26例样本中,15例(57.69%)至少存在一项SDH基因异常,提示基因启动子的甲基化,基因突变都是肿瘤抑制因子失活的重要机制。启动子甲基化可造成基因沉默,从而导致肿瘤形成及发展。6例样本中存在至少两项SDH基因异常,提示存在基因多种异常共同作用的可能性。
本实验存在一定局限性,由于SDHA基因结构非常复杂,内含子区域与编码区高度同源,因此只检测SDHB、SDHC、SDHD基因状态。其次FFPE样本的前期处理损伤,会对甲基化检测造成巨大的挑战,导致部分检测失败。这些有待在今后的工作中改进。
通过研究表明SDHB表达缺失可能由于多种机制引起,包括亚基基因突变、亚基基因启动子甲基化,或多种异常共同作用,提示SDH基因突变及启动子甲基化参与了肿瘤的形成。本实验有助于进一步研究SDH缺陷型GIST的发病机制,并为这部分患者潜在的治疗靶点提供了一定的理论依据。
