桑叶生物碱的活性炭脱色工艺优化及其α-葡萄糖苷酶抑制活性
2020-07-20曹发昊张洁花王艳萍
曹发昊,张洁花,王艳萍
(1.运城学院生命科学系,山西运城 044000; 2.山西省蚕业科学研究院,山西运城 044000)
桑叶是桑科植物桑树(MornsalbaL.)的叶子,是一类药食同源的植物资源。我国桑树资源丰富,桑叶富含多种营养成分和活性物质,具有天然无毒、药理作用广泛等优点,引起了国内外学者研究开发的关注[1-4]。生物碱是桑叶中一种重要的活性成分,其中哌啶类生物碱是其主要成分,特别是1-脱氧野尻霉素是桑叶的标志性生物碱,具有降血糖、抗氧化、降血脂等功效[5-8]。前期研究工作发现,桑叶生物碱提取过程中,色素等一些物质在溶剂或仪器的作用下会同时溶出,加深提取液的颜色,影响后续的含量检测分离和纯化工作,因此有必要对提取液进行脱色处理。目前,活性成分提取中常用的脱色方法有活性炭法、双氧水法和大孔树脂法。双氧水法是化学脱色方法,利用其氧化性破坏色素结构进行脱色,但同时活性成分也可能被破坏。大孔树脂脱色法成本相对较高,后续处理工艺较复杂。活性炭是一种常用的物理吸附剂,原料便宜,工艺易操作,脱色吸附效果较好,不会影响目标提取物的活性,广泛用于不同物质的脱色处理,但活性炭在除去色素的同时,可能会吸附一些活性成分,造成活性成分得率下降,这也是脱色工艺优化中要考虑的[9-10]。目前有关桑叶生物碱脱色的相关研究较少。
目前,临床用于治疗糖尿病的药物一大类就是作用于糖苷酶的抑制剂[11]。桑叶生物碱是多羟基含氮的生物碱,是一种重要的天然糖苷酶抑制剂,其分子结构类似葡萄糖,其中的氮元素能增强其取代二糖(或低聚糖)与糖苷酶结合,从而竞争性抑制糖苷酶活性[12]。采用4-硝基苯基-α-D-吡喃葡萄糖苷(PNPG)底物,在糖苷酶作用下可以水解为葡萄糖和对硝基苯酚,对硝基苯酚在400 nm左右有最大吸收峰,当有糖苷酶抑制剂时,就会减弱酶促反应,产物浓度下降,吸光度下降,在一定浓度范围其下降程度和抑制剂活性呈正比关系,基于该作用原理,可以评价桑叶生物碱对糖苷酶的抑制作用[13]。
本实验在前期桑叶生物碱提取研究工作的基础上,通过单因素和正交试验优化桑叶生物碱的活性炭脱色工艺,并对脱色后生物碱抑制α-葡萄糖苷酶活性进行研究,以期为桑叶生物碱的开发利用提供实验依据。
1 材料与方法
1.1 材料与仪器
鲁桑桑叶 2018年9月采集于山西省蚕业科学院蚕桑基地;4-羟基哌啶 武汉华翔科洁生物技术有限公司;颗粒活性炭 唐山华能活性炭有限公司;吐温-80、雷氏盐 上海研域化学试剂有限公司;4-硝基苯基-α-D-吡喃葡萄糖苷(PNPG)、α-葡萄糖苷酶(10万U/g) 上海宝曼生物科技有限公司;阿卡波糖 上海赢瑞生物医药科技有限公司。
VS22-600C数控超声清洗器 无锡沃信仪器制造有限公司;THZ-82水浴恒温振荡器 常州国华电器有限公司;UV-5200紫外可见分光光度计 上海元析仪器有限公司;HHS21-6恒温水浴锅 常州金坛精达仪器制造有限公司;BJ-800A中药粉碎机 江阴市海鑫药化机械制造有限公司;WD-2102A全自动酶标仪 上海茸研仪器有限公司;RE-5205旋转蒸发仪 上海亚荣生化仪器厂。
1.2 实验方法
1.2.1 桑叶生物碱的提取 阴干的桑叶粉碎过60目筛,将桑叶粉和酸性乙醇(30%乙醇-0.05 mol/L HCl)按照料液比1∶30 g/mL混合,加入吐温-80(4 mg/mL)置于水浴温度60 ℃、功率700 W超声器中处理30 min后过滤,保留滤液,滤渣按照前述步骤再次提取1次,合并滤液即得桑叶生物碱提取液。
1.2.2 生物碱含量测定
1.2.2.1 标准曲线制备 本研究选取4-羟基哌啶作为标准品,采用雷氏盐比色法建立测定生物碱的的标准曲线[14-15]。将4-羟基哌啶标准品2.0200 g溶于0.05 mol/L盐酸溶液中,得到0.04 mol/L标准品母液;分别准确移取2.00、3.00、4.00、5.00、6.00、7.00 mL不同体积标准品母液于10 mL容量瓶中,用0.05 mol/L盐酸溶液稀释定容得到浓度为0.008、0.012、0.016、0.020、0.024、0.028 mol/L待测标准溶液。取2 mL待测标准溶液,加入3 mL 2%雷氏盐溶液,混匀后冰浴1.5 h,抽滤得到沉淀,蒸馏水冲洗抽滤沉淀,然后用70%丙酮溶解定容至10 mL,于523 nm测定吸光度值A[16-17]。
1.2.2.2 桑叶生物碱含量测定 取2 mL桑叶生物碱提取液,按“1.2.2.1”所述方法测定样品的吸光度值,根据标准曲线计算提取液中生物碱含量。
1.2.3 桑叶生物碱提取液活性炭脱色工艺 通过预实验研究了活性炭和双氧水对桑叶生物碱提取液的脱色效果,发现桑叶生物碱提取液中加入10%双氧水,在60 ℃恒温水浴中45 min,其脱色率为41.50%,保留率为42.56%;而桑叶生物碱提取液经活性炭处理后,其脱色率和保留率可以达到70%以上,综合考虑,选用活性炭进行后续实验。
1.2.3.1 活性炭处理 活性炭浸泡于5%氢氧化钠溶液,煮沸20~30 min后过滤,去离子水冲洗至呈中性;然后浸泡于6 mol/L盐酸溶液中,煮沸20~30 min后过滤,去离子水冲洗至中性,120 ℃烘干备用。
1.2.3.2 桑叶生物碱提取液的活性炭脱色方法 移取生物碱提取液于锥形瓶中,加入一定量活性炭,置于速度180 r/min水浴恒温振荡器中,在一定温度下振荡处理适当时间后,抽滤2次,除去活性炭,保留滤液。
1.2.4 单因素实验 按照“1.2.3.2”所述方法,通过单因素实验考察四个因素(活性炭用量、脱色时间、水浴温度和脱色次数)对活性炭脱色效果的影响,测定脱色率和保留率,以Z值(脱色率和保留率加权归一化值)为考察指标。单因素试验条件为:固定水浴温度为50 ℃,脱色时间为20 min,脱色次数为1次,分别加入不同活性炭用量(2%、3%、4%、5%、6%)对提取液进行脱色;固定活性炭用量为4%,水浴温度为50 ℃,脱色次数为1次,分别按不同脱色时间(10、15、20、25、30 min)对提取液进行脱色;固定活性炭用量为4%,脱色时间为20 min,脱色次数为1次,分别在不同温度(30、40、50、60、70 ℃)对提取液进行脱色;固定活性炭用量为4%,脱色时间为20 min,水浴温度为50 ℃,分别对提取液进行不同次数(1、2、3、4、5次)的脱色。
1.2.5 正交试验 在单因素实验基础上,确定了四个因素的最佳取值范围,利用L9(34)正交表进一步优化活性炭的最佳脱色条件,每个因素和水平设计见表1,测定脱色率和保留率,以Z为考察指标。

表1 L9(34)正交试验设计Table 1 Design of L9(34)orthogonal experiment
1.2.6 脱色效果评价 分别取脱色前和脱色后的提取液于分光光度计波长523 nm处,测定其吸光度值,按照“1.2.2.2”所述方法测定相应的生物碱含量,利用下面两个公式计算脱色率和保留率。


以指标所测的最大值为参照将所得数据(脱色率和保留率)进行归一化为Z值,利用Z值评价活性炭的脱色效果[18]。利用综合加权评分法[19],考虑两个指标对脱色效果的贡献,赋予两个所测指标的权重系数均为0.5,将每个指标数据除以该指标的最大值再乘以100打分结果分别记为X1和X2,按照加权评分方法计算Z=0.5×(X1+X2)。
1.2.7α-葡萄糖苷酶活性测定 将脱色的和未脱色的桑叶提取液于旋转蒸发仪(转速180 r/min,水浴温度60 ℃)浓缩,得到浸膏,然后用0.1 mol/mL pH6.8磷酸盐缓冲液(PBS溶液)溶解得到待测样品溶液。在文献[20]方法基础上改进:在120 μL不同浓度(0.5、1.0、2.0、4.0、8.0 mg/mL)的样品溶液中分别加入50 μLα-葡萄糖苷酶溶液(0.5 U/mL),混合后37 ℃孵育10 min,然后加入50 μL反应底物PNPG溶液(5 mmol/L),37 ℃孵育30 min后,加入100 μL碳酸钠溶液(0.2 mol/L),反应停止后于405 nm测定吸光度A。阴性对照组不加样品溶液,空白对照组不加样品溶液和酶液,背景对照组不加酶液,阳性对照组用阿卡波糖替换样品溶液。每孔溶液体积一样,不足者用PBS溶液补充。计算抑制率和半数抑制浓度IC50。
抑制率(%)=[(A阴性对照组-A空白对照组)-(A样品实验组-A背景对照组)]/(A阴性对照组-A空白对照组)
1.3 数据处理
实验设三个平行处理,结果以平均值±标准偏差表示。WPS软件处理图和表,SPSS 20.0软件对数据进行方差显著性检验,P<0.05和P<0.01分别表示数据间差异显著和极其显著。Graphpad prism 7.0软件计算桑叶生物碱对α-葡萄糖苷酶半数抑制浓度IC50。
2 结果与分析
2.1 标准曲线的绘制
以吸光度为纵坐标,以4-羟基哌啶溶液浓度C(mol/L)为横坐标,所得测定生物碱浓度的标准曲线方程A=33.829C-0.0316(r=0.9996),在0.008~0.028 mol/L线性关系好。
2.2 桑叶生物碱提取液活性炭脱色单因素实验
2.2.1 活性炭用量的影响 桑叶生物碱提取液加入活性炭,在50 ℃脱色20 min、脱色1次,活性炭用量对脱色率和保留率的影响见图2。总体上随着活性炭用量的增加,脱色率逐渐变大,生物碱保留率逐渐减小。当活性炭用量小于4%时,脱色率增幅趋势较大,这可能是由于活性炭对不同物质吸附性不一样,提取液中色素含量可能高于生物碱,色素吸附作用较强;当活性炭用量大于4%,脱色率增幅趋势平缓,保留率持续下降,可能由于活性炭对色素的吸附和解吸达到平衡,生物碱的吸附作用增强[21-22]。利用Z值评价活性炭用量的脱色效果见图3。活性炭用量2%~4%内Z值逐渐变大,4%~6%内Z值逐渐减小,选取3%~5%用于正交试验。

图2 活性炭用量对脱色率和保留率的影响Fig.2 Effect of activated carbon dosage on decolorization rate and retention rate

图3 活性炭用量对Z值的影响Fig.3 Effect of activated carbon dosage on Z value
2.2.2 脱色时间的影响 桑叶生物碱提取液加入4%活性炭,在50 ℃脱色1次,脱色时间对脱色率和保留率的影响见图4。总体上随着时间增加,脱色率逐渐变大,保留率逐渐减小。当脱色时间小于20 min时,脱色率增大幅度较大;当脱色时间大于20 min后,脱色率变化较平缓,而保留率继续减小,活性炭主要通过物理吸附发挥作用,存在吸附和解析的动态平衡,在20 min之前,活性炭对色素的竞争性吸附作用强于生物碱,故脱色率增加幅度较大,20 min之后,活性炭对色素吸附逐渐处于动态平衡,而对生物碱的吸附尚未达到平衡,转向吸附生物碱的作用逐渐增强[23-24]。利用Z值评价脱色时间的脱色效果见图5。总体上随着脱色时间延长,Z值先增加后减小,其中脱色时间20 min的Z值较大,选取15、20、25 min用于正交试验。

图4 脱色时间对脱色率和保留率的影响Fig.4 Effect of decolorization time on decolorization rate and retention rate
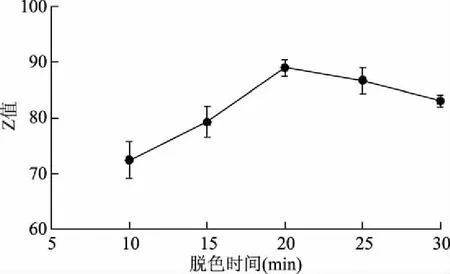
图5 脱色时间对Z值的影响Fig.5 Effect of decolorization time on Z value
2.2.3 水浴温度的影响 桑叶生物碱提取液加入4%活性炭,脱色20 min,脱色1次,水浴温度对脱色率和保留率的影响见图6。总体上随着温度升高,脱色率先变大后减小,保留率持续下降,其中30~50 ℃内脱色率逐渐增加,50~70 ℃内脱色率逐渐下降,可能由于温度越高,溶液粘度下降,分子运动加快,有利于活性炭吸附,但是温度太高,就会造成活性炭的解吸作用大于吸附作用,另外高温可能影响生物碱的稳定性,使保留率下降[25]。利用Z值评价水浴温度的脱色效果见图7。总体上随着水浴温度升高,Z值先变大后减小,其中50 ℃的Z值最大,选取40、50、60 ℃用于正交试验。

图6 水浴温度对脱色率和保留率的影响Fig.6 Effect of water bath temperature on decolorization rate and retention rate

图7 水浴温度对Z值的影响Fig.7 Effect of water bath temperature on Z value
2.2.4 脱色次数的影响 桑叶生物碱提取液加入4%活性炭,在50 ℃脱色20 min,脱色次数对脱色率和保留率的影响见图8。随着脱色次数增加,脱色率增加幅度不大,但保留率持续减小。活性炭对色素和生物碱的吸附可能存在竞争性,随着脱色次数增加,活性炭对色素的吸附先逐渐达到饱和,而后逐渐增强了对生物碱的吸附作用,导致保留率下降,另外,由于活性炭颗粒较小,超过3次处理后,发现部分微小活性炭颗粒进入提取液中,反而引起溶液颜色变暗,会影响脱色效果[26]。脱色1次的Z值大于脱色2次和3次的,但是三者间没有显著性差异(P>0.05),选取1、2、3次用于正交试验。
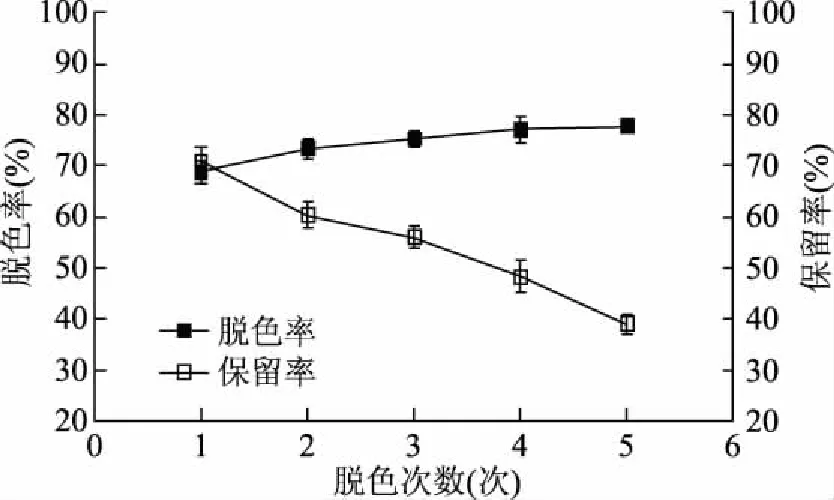
图8 脱色次数对脱色率和保留率的影响Fig.8 Effect of decolorization frequency on decolorization rate and retention rate

图9 脱色次数对Z值的影响Fig.9 Effect of decolorization frequency on Z value
2.3 桑叶生物碱提取液活性炭脱色正交试验
以Z值为评价指标,利用L9(34)正交试验优化活性炭脱色结果见表2。通过对比各因素R值,确定四个因素对脱色效果的影响顺序依次是:脱色次数>活性炭用量>脱色时间>水浴温度,优化出活性炭最佳脱色条件的组合为A2B3C3D2,即桑叶生物碱提取液用4%活性炭在60 ℃脱色25 min,脱色2次。通过3组平行试验验证,所得脱色率为79.80%±5.08%,保留率为78.52%±4.75%,验证试验所得Z值为100,实验结果高于正交试验的其他组合,表明A2B3C3D2可以作为活性炭脱色的最佳工艺条件,桑叶提取液在此条件下脱色后,其生物碱含量由28.02%提高到47.39%。

表2 活性炭脱色正交试验结果Table 2 Orthogonal experiment results of activated carbon decolorization
2.4 脱色处理对桑叶生物碱α-葡萄糖苷酶抑制活性的影响
桑叶生物碱提取液经优化脱色条件处理后,对α-葡萄糖苷酶活性的抑制作用见图10。在0.5~8.0 mg/mL内,脱色前、后的生物碱对α-葡萄糖苷酶活性的抑制率随着浓度的增加而变大,且呈剂量依赖性,两者的最大抑制率分别为51.37%±4.58%和63.06%±5.38%,其中浓度2.0~8.0 mg/mL脱色后生物碱的抑制率显著高于相同浓度脱色前生物碱(P<0.05);通过处理浓度和抑制率的关系,阿卡波糖、脱色前、后的生物碱对α-葡萄糖苷酶半数抑制浓度IC50分别为1.72、7.75和4.27 mg/mL,表明脱色后生物碱对α-葡萄糖苷酶活性的抑制作用强于脱色前。

图10 脱色前、后的桑叶生物碱 对α-葡萄糖苷酶活性的抑制率Fig.10 The inhibition rate of decolorized and non-decolorized alkaloids from mulberry leaf on the α-glucosidase activity注:相同浓度条件下抑制率比较,不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极其显著(P<0.01)。
3 讨论和结论
刘率男等[27]研究了生物碱含量53.4%的桑叶生物碱体外对α-葡萄糖苷酶活性的抑制作用。本研究桑叶生物碱提取液用4%活性炭在60 ℃脱色25 min,脱色2次,其生物碱含量由脱色前的28.02%提高到脱色后的47.39%,并且脱色后生物碱对α-葡萄糖苷酶半数抑制浓度IC50(4.27 mg/mL)小于脱色前的(7.75 mg/mL),后续工作有必要进一步对桑叶生物碱进行加工处理,并研究其单体化学成分组成。
本研究采用超声波加表面活性剂法提取桑叶生物碱,通过在提取液中加入4%活性炭在60 ℃脱色25 min,脱色2次取得较好的脱色效果,其脱色率和保留率分别为79.80%和78.52%,其Z值可达100;浓度2.0~8.0 mg/mL脱色后桑叶生物碱的抑制率显著高于相同浓度脱色前生物碱(P<0.05),脱色前、后桑叶生物碱的最大抑制率分别为51.37%和63.06%,脱色前、后生物碱对α-葡萄糖苷酶的IC50分别为7.75和4.27 mg/mL,脱色可以提高桑叶生物碱对α-葡萄糖苷酶活性的抑制作用,为桑叶生物碱提取和纯化提供了理论支持。
