诱导发酵桦褐孔菌三萜类化合物合成及其抗氧化功能的研究
2020-07-20杨宏博韩增华李志如韩建春
杨宏博,韩增华,杨 红,李志如,韩建春,4,*
(1.东北农业大学食品科学学院,黑龙江哈尔滨 150030; 2.黑龙江省科学院微生物研究所,黑龙江哈尔滨 150010; 3.黑龙江省科学院高技术研究院,黑龙江哈尔滨 150090; 4.黑龙江省绿色食品研究院,黑龙江哈尔滨 150000)
桦褐孔菌学名(Fascoporiaoblique(Pers.Fr.)Chaga)或(Inonotusobliquus(Fr.)Pilat)是一种十分珍稀且药用价值很高的白腐真菌。其内包含如蛋白质、多糖、黄酮、三萜、甾醇等多种活性物质[1]。三萜类化合物是其中很重要的一种。主要以羊毛脂烷型三萜化合物为主,由于它的高药用价值,被普遍应用在抗肿瘤、抗炎、抗突变、抗HIV等方面[2]。目前获得桦褐孔菌三萜主要有三种方法,第一从天然桦褐孔菌中直接提取,但由于天然桦褐孔菌生长迟缓,三萜含量低,所以导致价格昂贵[3];第二种是采用人工栽培技术,可以实现桦褐孔菌的培育,但其在技术层面上尚不完整,产量也偏低[4];三种为液体发酵技术,此方法可以缩短生产周期、提高菌丝生长速度,保证三萜含量稳定、不受外界环境影响等优点[5]。但据文献报道,三萜是次级代谢产物,含量较低。通过对碳氮源种类、无机盐,生长因子,接种量、初始 pH、培养温度、发酵时间和摇床转速进行了优化,以及筛选菌株和优化不同提取条件进行了研究[5-7],目前许多实验已经证实外源诱导因子在植物和生物合成化合物方面有显著影响[8]。
外源诱导因子的加入可以提高代谢途径中基因的表达量与酶的活性,能改善次级代谢产物合成量,具有较强的特异性[9]。目前,不少学者研究证实单纯的优化培养条件和提取工艺提高次级代谢产物的做法效果远远弱于加入诱导剂[10]。目前普遍应用的外源诱导因子有5种,分别为:茉莉酸甲酯(MeJA),是一种茉莉酮酸酯,同时也是一种与损伤相关的信号因子,加入到植物和真菌培养环境中,会诱导植物的化学防御,促进真菌对营养物质的吸收以及调节某些相关基因的表达[10-11]。用MeJA处理的栽培灵芝显示灵芝酸增加1.2倍[12]。水杨酸(Salicylic acid,SA),是分布在植物体的有机酸,可以提升植物的抗逆性和特定的抗逆基因表达,来提高次级代谢产物的产量。王启等[13]证实了SA可以影响有关三萜类化合物表达的基因,对三萜合成过程中部分关键酶表达程度有所提高,从而提高三萜产量。脂肪酸对细胞膜通透性有一定影响,在培养开始时加入2%的薏苡仁油,与对照相比,生物量和三萜类化合物含量分别增加了3.34倍和2.76倍[14]。金属离子是桦褐孔菌生长必需物质,它是潜在诱导剂,并且可用于持续生产有价值的次生代谢产物[15-16]。有研究表明植物水提取物可以促进三萜化合物的积累[17]。Wang等[18]证实来自白桦树皮的水提物(0.01 g/L)可以显著提高类固醇产量,白桦树皮的水提取物(0.01和0.1 g/L)可以同时进行刺激菌丝生长和类固醇含量。
目前对桦褐孔菌三萜方面的研究在提取、分离方向上较多,对如何提高三萜含量以及活性分析上鲜有报道。因此本实验选择 MeJA、SA、亚油酸、Fe2+、桦树皮水提物为诱导因子,研究其对桦褐孔菌诱导的可行性,并确定最佳诱导方案。
1 材料与方法
1.1 材料与仪器
桦褐孔菌 黑龙江省微生物研究所提供;茉莉酸甲酯(methyl jasmonate,MeJA)、水杨酸(Salicylic acid,SA)、白桦脂醇、DPPH、香草醛 Sigma公司;亚油酸 拉丁试剂有限公司;Fe2(SO4)3、无水乙醇、盐酸 天津市汇杭化工科技有限公司。
SW-CMD超净工作台 苏州苏洁净化设备公司;ZPQ-400智能气候培养箱 哈尔滨市东明医疗仪器厂;CR-21N高速低温离心机 日立工机株式会社;UV757CRT紫外可见分光光度计 上海仪电分析仪器有限公司制造;DK-8D电热恒温水槽 上海森信实验仪器有限责任公司;RE-52旋转蒸发器 上海亚荣生化仪器厂;SL-16超声波水浴锅 江苏盛蓝仪器制造有限公司;0.2 μm滤膜 美国密理博有限公司。
1.2 实验方法
1.2.1 菌株活化及培养 将取出原始菌种在灭菌台上钩取1~2小块置于准备好的斜面培养基上27 ℃下培养时间为12 d左右,待菌丝布满试管斜面,使用自制接种针接种1.5 mm×1.5 mm大小的固态菌种,接种量为10%左右,接种在含有葡萄糖30 g/L,蛋白胨4 g/L,MgSO40.5 g/L,KH2PO41.5 g/L,CaCl20.1 g/L,VB120 mg/L液体培养基中[19],于26 ℃和150 r/min条件下振荡培养8 d[20]。
1.2.2 菌丝体干重的测定 接种培养8 d后,用纱布过滤发酵液,用蒸馏水冲洗菌丝球数次后放于70 ℃的烘箱中,每隔2 h后取出称重直至重量不变,此时为菌丝干重。
1.2.3 三萜类化合物的提取和测定
1.2.3.1 三萜类化合物的提取 将干燥的菌丝体用粉碎机处理,过100目筛,用10 mL异丙醇溶解0.1 g菌粉,低温条件下超声破壁5 min,间歇3 s后,温度为50 ℃水浴24 h后,离心,取上层清液,补足至10 mL,制备成桦褐孔菌菌丝中三萜类化合物粗提液,在-10 ℃下保存[21]。
1.2.3.2 三萜类化合物的测定 采用香草醛-冰醋酸比色法测定三萜类物质[21],用白桦脂醇的质量为X轴,吸光值为Y轴,制作标准曲线,得回归方程Y=0.0015X+0.0077。
准确吸取0.2 mL上述三萜类化合物粗提液,按上述1.2.3.2的方法测定,通过标准曲线得出三萜类化合物质量。
1.2.4 桦褐孔菌菌丝体中总三萜量 桦褐孔菌菌丝体中总三萜量即一批发酵培养液中所获得的所有桦褐孔菌菌丝体中三萜类化合物的总量,计算公式如下:
总三萜(mg/L)=菌丝体干重(g/L)×三萜含量(mg/g)
1.2.5 诱导剂的添加量及添加时间的筛选
1.2.5.1 MeJA诱导三萜合成的研究 以0.2%(w/w)乙醇作为助溶剂配制浓度为10、50 和 100 μmol/L的MeJA溶液,经孔径为0.2 μm 的滤膜过滤,在发酵第0、3、6 d将配置好的MeJA溶液加入桦褐孔菌菌丝体发酵液中,添加量为2 μL/mL,同时以空白和仅加2%乙醇的培养液为对照,在1.2.1条件下培养,发酵结束后测定桦褐孔菌干重及总三萜量。
1.2.5.2 SA诱导三萜合成的研究 配制2 mg/mL SA溶液,0.2 μm滤膜过滤。分别在发酵第0、3、6 d加入不同体积的2 mg/mL SA溶液,使SA终浓度为50、100、150 mg/L,并以加入无菌水的培养液作为对照组。在1.2.1条件下培养,发酵结束后测定桦褐孔菌干重及总三萜量。
1.2.5.3 亚油酸诱导三萜生物合成的研究 分别在发酵第0、3、6 d加入不同含量亚油酸,使亚油酸在发酵液中浓度达到0.5、1.0、1.5和2.0 g/L,在1.2.1条件下培养,发酵结束后测定桦褐孔菌干重及总三萜量。
1.2.5.4 桦树皮水提物诱导三萜生物合成的研究 取100 g桦树皮与1 L水一起煮沸0.5 h后,经滤纸过滤浓缩,烘干1 h,得水提物干粉,并进行高温杀菌。在发酵第0、3、6 d向发酵液中添加水提物干粉,使其在发酵液中达到 0.01、0.1、1、5 g/L,在1.2.1条件下培养,发酵结束后测定桦褐孔菌干重及总三萜量。
1.2.5.5 金属离子 Fe2+诱导三萜合成的研究 配制浓度为9 μmol/L硫酸亚铁溶液后用去离子水稀释适当倍数,在121 ℃灭菌0.5 h后在发酵第0、3、6 d加入发酵液中,使发酵液中Fe2+浓度为1、3、6、9 μmol/L;在1.2.1条件下培养,发酵结束后测定桦褐孔菌干重及总三萜量。
1.2.6 抗氧化活性的测定 将不同诱导剂诱导培养后的桦褐孔菌菌丝体经1.2.3所述方法进行提取,经过旋转蒸发仪在45 ℃条件下浓缩之后用锡箔纸包住,将样品在4 ℃的低温冰箱中储存并避光。
1.2.6.1 总还原能力的测定 参照Iris等[22]的方法,吸取不同浓度的样品溶液1.0 mL,加入浓度为0.2 mol/L体积为2.5 mL的PBS缓冲溶液随后再加入体积为2.5 mL 1%的铁氰化钾溶液。将其放在50 ℃水浴中0.5 h,取出后加2.5 mL 10%的三氯乙酸,无浑浊时加2.5 mL蒸馏水,再加入0.5 mL 0.1%的三氯化铁。反应10 min后在波长为700 nm时测吸光值为A1,空白以去离子水代替样液为A0。以VC作为阳性对照,测定总还原能力。
总还原能力=A1-A0
1.2.6.2 DPPH· 清除能力的测定 参照Ozgen等[23]的方法,吸取2.0 mL样品溶液,加入浓度1×10-4mol/L DPPH溶液2 mL后室温避光反应0.5 h后在517 nm测其吸光值Ai,无水乙醇代替样液为A0,样液与无水乙醇混合液吸光值为Aj。
1.2.6.3 OH·清除能力的测定 参照文献[24],吸取1.0 mL样液加入等体积的浓度为10 mmol/L硫酸亚铁溶液,再加入2.0 mL浓度为10 mmol/L双氧水溶液混匀后静置10 min后加入10 mmol/L水杨酸溶液1.0 mL后,37 ℃水浴0.5 h,冷却后以4000 r/min离心5 min,在510 nm处测定其吸光度为Ai,去离子水代替样液为A0,无水乙醇代替水杨酸为Aj。
1.3 数据处理
所有实验重复n次(n≥3)表示数据方法为平均值±标准差,所有数据采用spass 20.0进行显著性分析,P<0.05,以Origin 9.0制图。
2 结果与分析
2.1 诱导剂筛选结果
2.1.1 MeJA诱导桦褐孔菌三萜化合物生物合成的研究 MeJA是来源与植物体内信号因子,作为外源添加剂可以改变代谢产物合成量,因此本试验研究了MeJA溶液对桦褐孔菌菌丝体量及三萜类化合物合成的影响,试验结果如图1所示。

图1 MeJA对桦褐孔菌菌丝体量及三萜量的影响Fig.1 Effects of MeJA on the amount of mycelia and triterpenoid content of Inonotus obliquus
从图1结果可以看出,MeJA添加浓度与时间均对桦褐孔菌菌丝体的生长及三萜类化合物的合成具有显著影响。相同浓度下,在发酵初期加入茉莉酸甲酯菌丝含量显著(P<0.05)低于发酵后期加入诱导剂,此结果与粗毛纤孔菌在发酵后期加入茉莉酸甲酯利于三萜化合物合成一致[26]。对于发酵时间的确定,在第6 d加入诱导剂显著高于(P<0.05)其他组。在同一时间下,诱导剂溶液对菌丝量与三萜含量影响随浓度的增加表现为先促进后抑制,在50 μmol/L出现峰值。从图1可以看出,只加助溶剂会促进菌丝生长,不会增加三萜含量。在发酵期间添加MeJA时,浓度对于菌丝含量的影响呈现在0~50 μmol/L范围菌丝含量和三萜化合物随浓度增加而增加,当浓度在50~100 μmol/L时茉莉酸甲酯的加入会抑制菌丝的生长。但随着浓度增加三萜含量呈现增加趋势(P<0.05)。在第6 d加入50 μmol/L茉莉酸甲酯可得到菌丝体的量为10.05±0.01 g/L,菌丝体中三萜含量107.72±1.07 mg/g,三萜总量为1082.19 mg/L,与不加入诱导剂的对照组相比三萜总量增加了119.96%。有研究显示,MeJA可以改善鲨烯合成酶、鲨烯环氧酶、β-香树脂合成酶等酶的基因表达活力,同时影响酶的活性。而这些酶都在合成三萜起至关重要的作用[27]。为此后续会对MeJA在哪一时间段对哪种酶基因表达量的提高进行深入研究。三萜作为桦褐孔菌次级代谢产物的一种,MeJA的加入可能会刺激桦褐孔菌的自我保护机制,从而后期加入效果会更好一些。
2.1.2 SA诱导桦褐孔菌三萜化合物生物合成的研究 作为存在于植物体内的酸类的一种SA,它参与植物生长过程的重要活动,同时参与植物抗病害工作。SA对桦褐孔菌的诱导结果如图2所示。

图2 SA对桦褐孔菌菌丝体量及三萜量的影响Fig.2 Effects of SA on the amount of mycelia and triterpenoid content of Inonotus obliquus
从图2得出,同一时间下菌丝体量三萜含量,总三萜量三者与浓度关系表现为随浓度增加其先增加后降低,浓度为100 mg/L时达到最大。同一浓度下,发酵早期加入SA会抑制菌丝体生长但可以促进三萜的合成。SA可改善苯丙氨酸裂解酶、H2O2酶等抗氧化酶的活力,提高基因表达量,从而实现三萜的增产同时也会在一定程度上影响菌丝含量[28]。所以从图2中可以看出空白组的菌丝含量显著高于其他组(P<0.05)。但三萜含量显著低于其他组(P<0.05)。通过数据综合分析得,SA诱导的最佳条件为浓度为100 mg/L,添加时间为第0 d,此时总三萜量为916.91 mg/L,与对照组相比提高了84.63%。
2.1.3 亚油酸诱导桦褐孔菌三萜化合物生物合成的研究 亚油酸是多碳长链脂肪酸,含有2个碳碳双键,无毒性,可以作为外源诱导因子,而且来源广泛。本研究初次尝试运用亚油酸对桦褐孔菌进行诱导。
根据图3可知,随亚油酸浓度的增加,抑制了菌丝生长,三萜化合物含量先增加后降低。当浓度为1.5 g/L时三萜化合物含量达到最高。随发酵添加亚油酸时间的增加,菌丝含量与三萜含量显著高于(P<0.05)其他组,得出发酵早期加入亚油酸不利于菌丝的生长与三萜化合物的积累。过高浓度的亚油酸菌丝含量降低,可能是由于亚油酸在覆盖在发酵液表面,降低了O2含量,从而抑制桦褐孔菌生长[29]。实验表明,对菌丝体生长有害的条件可能对三萜类化合物的形成产生积极影响,这与先前使用亚油酸增强Inonotusobliquus多酚和黄酮类化合物产生的研究一致[9]。综上,效果最好条件为在第6 d添加1.5 g/L亚油酸进行诱导发酵,此时总三萜量为775.58 mg/L,与对照组相比提高了56.28%。
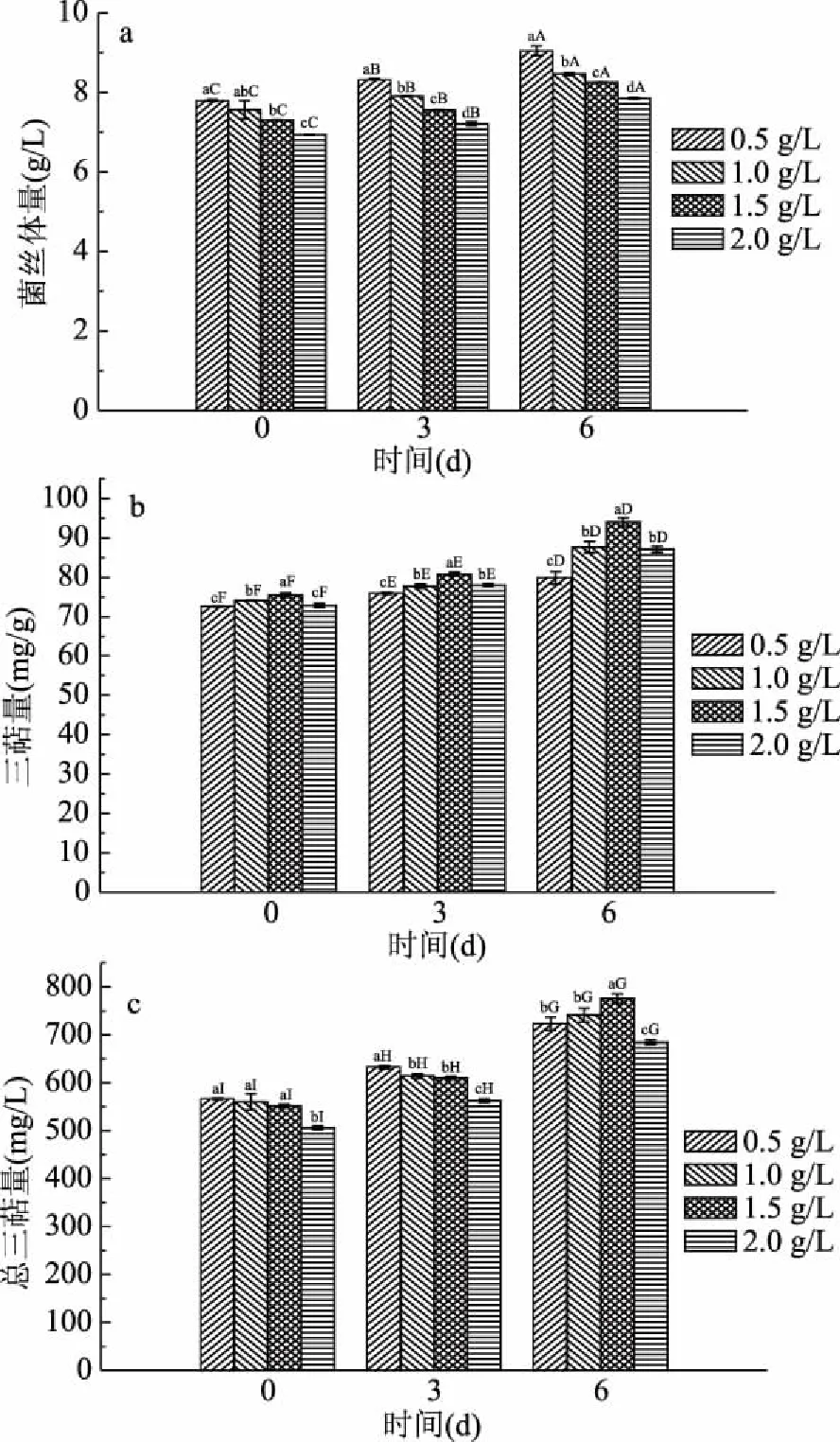
图3 亚油酸对桦褐孔菌菌丝体量及三萜量的影响Fig.3 Effects of linoleic acid on the amount of mycelia and triterpenoid content of Inonotus obliquus
2.1.4 桦树皮水提物诱导三萜化合物合成 真菌的生长所需要营养物质几乎都从寄主体内获得,所以将寄主桦树皮水提物作为诱导因子加入培养液中,观察对桦褐孔菌生长的影响,结果如图4所示。

图4 桦树皮水提物对桦褐孔菌菌丝体量及三萜量的影响Fig.4 Effects of water extract from birch bark on the amount of mycelia and triterpenoid content of Inonotus obliquus
由图4可知,加入桦树皮水提物对桦褐孔菌菌丝生长有显著影响(P<0.05),随浓度增加呈现先增加后下降的趋势,在0~1 g/L范围内菌丝含量与三萜化合物的含量增加,当浓度超过1 g/L后菌丝生长三萜化合物合成受到抑制。在发酵初期加入桦树皮水提物效果明显好于在发酵后期。当浓度为1 g/L时第0 d添加菌丝含量达到最大值10.38 g/L,三萜化合物总量比第6 d提高了16.98%。经过试验结果表明,在发酵第0 d加入1 g/L桦树皮水提物得到三萜化合物达到峰值,976.14 mg/L,与对照组相比提高了99.10%。由于目前对于桦树皮水提物中所含物质尚不明确,因此后续试验研究中进一步揭示哪种物质对发酵起作用。
2.1.5 金属离子Fe2+诱导三萜化合物合成的研究 铁离子对桦褐孔菌菌丝体量及三萜量的影响如图5所示。
由图5可知,Fe2+对桦褐孔菌三萜类化合物的合成没有显著影响作用(P>0.05)。但会增加菌丝体产量,随着Fe2+浓度的增加,对菌丝体生长呈先促进后抑制,当Fe2+添加浓度为0~6 μmol/L范围时表现为(P<0.05),超过6 μmol/L时表现为抑制,当浓度为9 μmol/L时最低。说明Fe2+促进桦褐孔菌生长需要浓度要求[16]。而且发酵后期加入Fe2+效果弱于早期。所以,早期添加浓度为 6 μmol/L的Fe2+可使菌丝体量达到最大值,进而达到三萜增产的目的,菌丝含量达到10.44 mg/L,较对照组提高了2.04%。
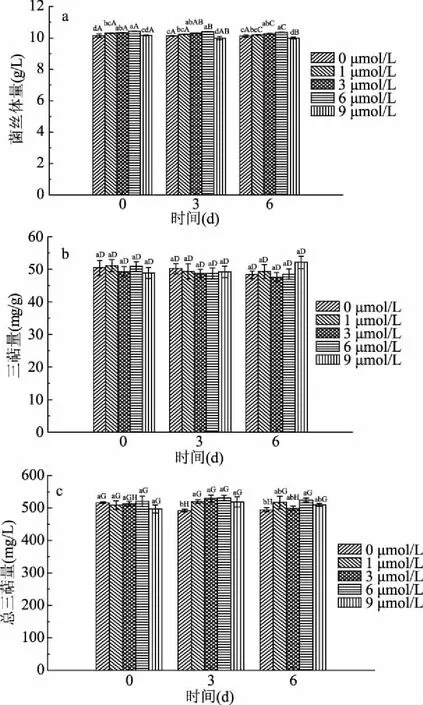
图5 Fe2+对桦褐孔菌菌丝体量及三萜量的影响Fig.5 Effect of Fe2+ on the amount of mycelium and triterpene in Birch
2.2 抗氧化活性分析
已有学者证实三萜类化合物是潜在抗氧化剂[29],为测定桦褐孔菌三萜类化合物的抗氧化能力,对经过不同诱导剂诱导后的桦褐孔菌进行了测定,本试验测定了总还原力及多种自由基清除能力,并以VC为对照,试验结果如图6所示。
从图6中数据结果中得出,桦褐孔菌产生的三萜化合物在体外抗氧化实验中表现良好,浓度与抗氧化能力成正相关,此外,诱导因子的加入能够有效提高抗氧化能力,但不同诱导因子对抗氧化能力的提升有一定差距。图6(a)结果表明,经SA诱导后的效果较好,在浓度3 mg/mL其值为1.003,比未诱导桦褐孔菌三萜类化合物提高了76.02%。图6(b)结果表明,当浓度达到2.5 mg/mL经诱导后的桦褐孔菌三萜类化合物对DPPH·清除率变化较小,但都显著高于未诱导。经茉莉酸甲酯诱导后随浓度增加清除率提高但不显著(P>0.05)。图6(c)结果表明,经诱导后的桦褐孔菌三萜化合物对于OH·清除效果明显低于VC。经SA诱导的桦褐孔菌三萜化合物效果最好,比未诱导的提高了35.06%。

图6 不同诱导剂对桦褐孔菌三萜类化合物的抗氧化能力影响Fig.6 Effects of different inducers on antioxidant capacity of triterpenes from Inonotus obliquus

3 结论
本研究结果表明,MeJA、SA、亚油酸、桦树皮汁水提物和Fe2+5种诱导剂均能提高桦褐孔菌菌丝体中三萜含量,但方式略有不同。添加时间为第6 d添加浓度50 μmol/L的MeJA溶液诱导效果最为明显,得到1082.19 mg三萜类化合物,与对照组相比提高119.96%。抗氧化能力试验中,本试验所选用的外源诱导因子都能增强桦褐孔菌三萜类化合物的抗氧化能力,其中MeJA表现突出,在其之后的为SA和桦树皮水提物。诱导剂能提高抗氧化能力可能是由于增加了某些抗氧化官能团的含量,但详细原因需要更深入的探究。本试验为实现桦褐孔菌三萜类化合物的增产以及开发新的抗氧化剂资源提供科学理论基础。
