阿托伐他汀对急性心肌梗死大鼠Ang-1及其受体Tie2 mRNA表达的影响
2020-07-20陈仕毅付玉平冯晓晶刘少奎
陈仕毅,付玉平,冯晓晶,刘少奎
(1.大连大学附属中山医院循环科,辽宁 大连 116001;2.中国医科大学附属第一医院骨科,沈阳 110001;3.北部战区总医院和平院区骨科,沈阳 110042)
血管新生在急性心肌梗死(acute myocardial infarction,AMI)发病及治疗过程中起关键性作用。在众多的促血管生成、发展及成熟因素中,最重要的是促血管生成素(angiopoietin,Ang)及其受体(Ang/Tie2)系统。Ang-1为内皮细胞特异生长因子,与Tie2受体结合,在血管新生、调控血管的完整性、维持其稳定性过程中发挥作用[1]。研究[2]发现,阿托伐他汀保护心血管的功能与其调脂作用无关,其是否对微血管新生具有潜在的药物作用机制研究相对较少。本研究通过建立大鼠AMI模型,观察阿托伐他汀药物治疗对AMI大鼠心肌组织Ang-1及其受体Tie2mRNA表达水平的影响,探讨阿托伐他汀药物在AMI血管生成过程中的作用及机制。
1 材料与方法
1.1 实验动物分组及模型建立
1.1.1 动物分组:6~8周龄雄性SD大鼠80只,体质量200~250 g,购自大连医科大学实验动物中心。在室温20~25 ℃的动物房中饲养3 d后,将大鼠随机分3组:正常(CG)组20只、单纯心肌梗死(AG)组30只、心肌梗死联合阿托伐他汀(AAG)组30只。
1.1.2 建立AMI模型:使用氯胺酮与速眠新药物麻醉AG与AAG组大鼠;将大鼠仰卧固定于操作台上,使用大鼠灌胃直针(65 mm)进行气管插管,深约40~50 mm,动物呼吸机设置参数为频率60次/min,潮气量30 mL,呼吸比率1 ∶1;于胸骨左缘心脏搏动最强点上一肋间(即第4、5肋间)做一斜行长约1 cm切口,打开胸腔并钝性分离开心包,于左心耳下方冠状动脉(以下简称冠脉)走行处,距离肺动脉根部3 mm结扎,深度 ≥ 1 mm,结扎后可见左心室心肌苍白变薄,观察大鼠生命体征变化,关闭胸腔并保持胸腔负压状态,冲洗消毒后缝合;AG组在术后3 d开始给予阿托伐他汀[10 mg/(kg·d)]灌胃,AG组及CG组以同等剂量生理盐水灌胃,最终获得CG组20只,AG组24只,AAG组25只,在灌胃后0 d、14 d 和28 d,分别取梗死部位心肌组织。
1.2 主要试剂及仪器
阿托伐他汀钙(美国辉瑞制药有限公司),PCR扩增试剂盒(上海生工生物工程有限公司),DNA Marker(上海生工生物工程有限公司),UNIQ-10柱式总RNA抽提试剂盒(上海生工生物工程有限公司),M-MuLV第一链cDNA合成试剂盒(上海生工生物工程有限公司),引物合成(上海生工生物工程有限公司),高速微型离心机(DGW99)型(深圳市点晶科学仪器有限公司),紫外分光光度计(上海美析仪器有限公司),DY-300型低压电泳仪(汕头市医用设备厂有限公司),电热恒温水浴箱(上海跃进医疗器械厂),动物呼吸机ALC-V8(上海奥尔科特生物科技有限公司)。
1.3 实时PCR检测Ang-1及其受体Tie2 mRNA的表达
分别于灌胃14 d和28 d处死大鼠,取AG组及CG组及AAG组大鼠的心肌组织,依据RT-PCR试剂说明书,按步骤分别检测Ang-1及其受体Tie2mRNA的表达量。
1.3.1 提取RNA:称取不少于30 mg的心肌组织,将研磨后的心肌组织置于离心管中加入RLT Solution震荡混匀,离心并吸取上清液加入无水乙醇后混匀,使用吸附柱及DEPC-treated ddH2O获得RNA溶液。
1.3.2 RNA纯度的测定:使用DEPC处理水将提取的RNA稀释,使用紫外分光光度计测定A260值及A280值。用DEPC-Treated ddH2O作为空白对照。
1.3.3 RNA反转录:将提取的RNA加入Oligo(dT)及RNase-free ddH20后混匀并离心,65 ℃温浴5 min,冰浴30 s,离心。分别加入反应物Reaction Buffer 4 μL、RNase Inhibitor 1 μL、dNTP Mix 2 μL、M-MuLV RT 1 μL,混匀后离心。在PCR仪上进行cDNA合成(42℃),终止反应(70 ℃)。
1.3.4 实时PCR:cDNA产物加入上游Primer、下游Primer、Taq DNA Polymerase等试剂,通过变性、退火、延伸等步骤进行扩增,Tie2、Ang-1、β-actin退火温度分别为57 ℃、55 ℃、58 ℃。
1.3.5 PCR产物检测:PCR产物用1%琼脂糖凝胶溶液进行电泳,在紫外观测仪上观察电泳结果,采用凝胶成像系统拍照并分析条带。
1.4 病理学检查
2周处死大鼠,取左心室冠状面梗死区中部切片,置于4 %的多聚甲醛溶液中固定10 h石蜡包埋待用。制5 μm厚切片,随机取3张切片进行观察,切片HE染色(苏木精和伊红染色法)。
1.5 统计学分析
2 结果
2.1 AMI模型大鼠心肌细胞的病理改变
光镜下,正常大鼠心肌细胞排列有序紧密,无明显炎症细胞浸润;冠脉结扎术后大鼠心肌细胞排列紊乱、稀疏,有中性粒细胞浸润,见图1。
2.2 阿托伐他汀影响AMI大鼠Ang-1及其受体Tie2 mRNA的表达
阿托伐他汀作用AMI大鼠14 d时,AAG组及AG组Tie2mRNA的表达高于CG组,AAG组明显高于AG组,差异有统计学意义(P< 0.05)(见图2,表1、2);Ang-1mRNA在AAG组、AG组及CG组的表达,组间比较差异无统计学意义(P> 0.05,见图2,表1、2)。
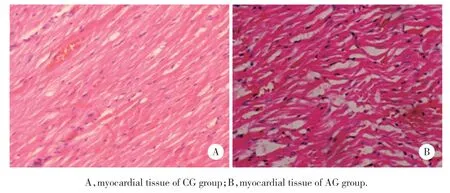
图1 AMI模型大鼠心肌细胞的病理变化 HE染色×400Fig.1 Pathological changes in myocardial cells of AMI rats HE staining×400
图2 阿托伐他汀对AMI大鼠Ang-1及Tie2 mRNA的表达影响(药物作用14 d)Fig.2 Effect of atorvastatin on mRNA expression of Ang-1 and Tie2 in AMI rats(14 d after drug action)
表1 阿托伐他汀对AMI大鼠Tie2 mRNA表达的影响()Tab.1 Effect of atorvastatin on Tie2 mRNA expression in AMI rats()
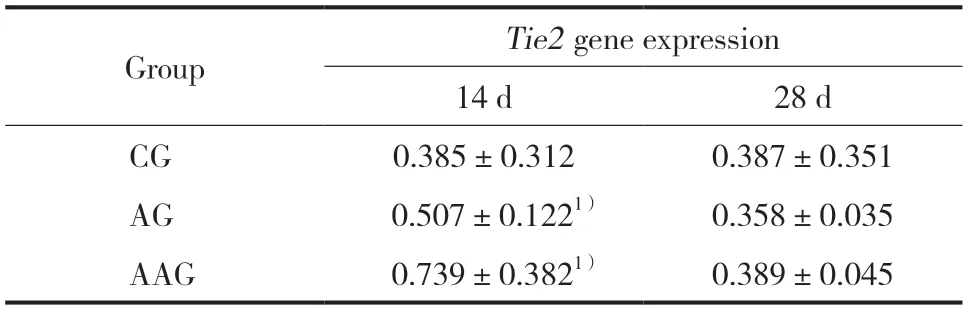
表1 阿托伐他汀对AMI大鼠Tie2 mRNA表达的影响()Tab.1 Effect of atorvastatin on Tie2 mRNA expression in AMI rats()
1)P < 0.05 compared with the CG group.
阿托伐他汀作用AMI大鼠28 d时,Tie2mRNA的表达在AAG组及AG组、CG组中,组间表达无明显差异(P> 0.05);Ang-1mRNA的表达在AAG组及AG组及CG组,组间表达无统计学差异。见图3,表1、2。
3 讨论
在缺血性冠脉疾病中,形成冠状动脉侧支循环主要有3种途径,即主干血管的延伸生长,毛细血管网络的形成和侧支动脉的产生[3]。他汀类药物目前被广泛应用于防治心脑血管疾病。研究[4]发现他汀类药物除降脂作用外,还可以促进缺血组织中的血管再生成。通过增加冠状动脉的侧支循环来治疗AMI,但其具体机制尚不明确。
表2 阿托伐他汀对AMI大鼠Ang-1基因表达的影响()Tab.2 Effect of atorvastatin on Ang-1 gene expression in AMI rats()
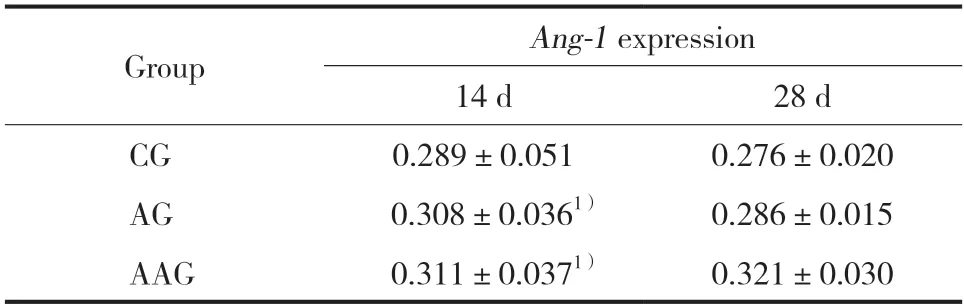
表2 阿托伐他汀对AMI大鼠Ang-1基因表达的影响()Tab.2 Effect of atorvastatin on Ang-1 gene expression in AMI rats()
1)P < 0.05 compared with the CG group.

图3 阿托伐他汀对AMI大鼠Ang-1及Tie2的基因表达影响(药物作用28 d)Fig.3 Effect of atorvastatin on gene expression of Ang-1 and Tie2 in AMI rats(28 d after drug action)
Ang/Tie2系统是调控血管新生的途径[5-8],其中Ang-1/Tie2途径是维持血管完整性的重要因子,同时在新生血管形成、发展及成熟的过程中起重要作用[9]。JONES等[10]认为Ang-1与Tie2受体结合,能够促进Tie2受体磷酸化,维持血管完整性并调节血管功能。YIN 等[11]研究证实Ang-1通过PI3信号传导通路激活Tie2,改善心肌老化。KIM[12]提出Ang-1通过抑制高脂血症诱发的冠状动脉内皮细胞的凋亡,维持内皮细胞稳定性。陈仕林等[13]的研究证明,用Ang-1基因干预治疗的AMI心肌周围毛细血管密度显著高于正常对照组。VASA等[14]的研究发现他汀类药物能促进内皮祖细胞动员、迁移以及分化,促进梗死区域血管再生。有研究[15-17]发现,他汀类药物可通过PI3K/Akt信号传导途径促进血管新生。
本研究基于他汀类药物在血管新生方面的作用,研究其在AMI血管新生过程的作用及其机制。结果显示,14 d时Tie2 mRNA表达,AMI组与正常组相比,差异有统计学意义,AAG组与AG组Tie2mRNA差异有统计学意义,说明在AMI区域Tie2的表达升高,且Tie2在AAG组中表达明显升高。14 d及28 d时Ang-1的表达正常组与AG组相比,AAG组与AG组相比,差异均无统计学意义。研究[18]发现,建立AMI模型后,在非梗死区心肌组织中Tie2mRNA表达没有变化,而在梗死区心肌组织中表达明显升高,Ang-1mRNA的表达水平在梗死区与非梗死区均无变化,本研究结果与其一致。研究中发现正常组与AG组Ang-1mRNA表达没有差异,但AG组均数均比正常组大,说明Ang-1mRNA表达还是相对上调的,分析原因可能是与研究选取时间及样本量有关。在14 d时AAG组Tie2mRNA表达较AG组升高,在28 d时Tie2的表达与正常组无差异,说明阿托伐他汀可能只具有在早期通过上调Tie2mRNA促进血管再生作用。Tie2mRNA表达是上调能够激活了内源性血管生成机制,Ang-1在内皮细胞表达促进血管新生、成熟和稳定[19],但与本研究结果Tie2mRNA表达升高,Ang-1mRNA的表达无变化矛盾。进一步推测可能是阿托伐他汀药物通过上调Tie2mRNA表达促进血管新生。
综上所述,本研究基于他汀类药物在血管新生方面的作用,研究其在AMI血管新生过程的作用及机制。Ang-1及Tie2的表达水平与AMI血管新生间呈一定的相关性。由此推测,阿托伐他汀钙可能通过上调Tie2mRNA表达共同促进血管新生,Ang-1是他汀类药物促血管新生的重要介导因素,这可能为阿托伐他汀在促进新生血管,治疗缺血性心脏病的临床应用提供了理论依据。
