慢性肾脏病与肠道菌群相关性的研究进展
2020-07-18张舒飞朱琳周萍
张舒飞 朱琳 周萍
哈尔滨医科大学附属第二医院儿科(哈尔滨150086)
慢性肾脏病(chronic kidney disease,CKD)在世界范围内的疾病负担逐渐加重,据流行病学研究表明,全球估计CKD 患病率为13.4%(11.7%~15.1%),需要肾脏替代治疗的终末期肾病患者估计为490.2 至708.3 万人[1]。当CKD 进展到后期时,传统的治疗方式为血液透析,肾脏移植等替代治疗方法,但由于受到肾源等因素的限制,临床急需实用性更强的治疗方法。同时,基于科技的进步和基因组学的飞速发展,人类对于微生物的研究和理解比以往更加透彻。最初,人们的目光局限在肠道菌群对胃肠道功能的影响,但随着研究的进一步深入,人们逐渐证实了肠道菌群失调与心脏、肝脏、脑等器官的功能障碍和糖尿病、肿瘤等疾病的发生、发展之间存在密切联系[2-5]。近年,大量研究表明,肠道菌群失调与CKD 之间存在关联,因此,深入研究CKD 与肠道菌群相互作用的机制,寻找干预肠道菌群的方法,对延缓CKD 的病情进展具有重要意义。本文旨在总结目前肠道菌群与CKD 之间的关系以及肠道菌群作为治疗手段的相关进展,以期为CKD 的研究和治疗提供参考。
1 CKD 与肠道菌群概述
1.1 CKDCKD 是各种原因引起的肾脏结构或功能异常≥3 个月,包括出现肾脏损伤标志或有肾移植病史,伴或不伴肾小球滤过率下降或不明原因的肾小球滤过率下降(<60 mL/min)≥3 个月规定为CKD,且当CKD 进展到末期时,称之为终末期肾脏病[6]。在对2017年的全球肾脏病的疾病负担分析中发现,2017年全球共记录全阶段CKD 患者697.5 万人,并有120 万人死于CKD[7]。
1.2 肠道菌群在健康人群的消化道中,生存着大量的细菌,这些细菌在回肠中的密度达到106~108/mL,而在结肠中的密度高达1012/mL 以上[8],在这些肠道菌中,超过90%的细菌可以归入拟杆菌门和硬壁菌门,既有着像双歧杆菌这样对身体有益的“益生菌”,也存在着大量对身体有害的“腐生菌”[9]。这样一来,肠道细菌的数量远远超过了人体细胞数总量,如此庞大的生态系统,在各种因素的调节下保持着相对平衡。肠道菌群虽然无法用肉眼观察到,但其如同肝脏、肾脏一样,在机体的新陈代谢等生命活动中起到了不可或缺的作用。肠道菌群失衡不止会导致消化系统疾病,并且会借助血液淋巴系统等途径对全身各个系统或器官产生不利影响。
2 CKD 相关的肠道变化
2.1 CKD 患者肠道菌群生存环境的变化在健康状态下,肌酐、尿素等代谢废物是由肾脏排出的[10]。CKD 患者肾脏功能下降,肾小球滤过率降低,循环中代谢废物的浓度增高,导致慢性内毒素血症,一部分代谢废物破坏肠道黏膜上皮屏障,破坏上皮细胞间的紧密连接,导致肠道菌群和内毒素进入肠腔和血液循环[11-12]。尿素酶菌等肠道菌将尿素转化为NH4OH,从而使肠腔内的pH值增高,改变了肠道细菌的生存环境[13]。与此同时还有尿酸,三甲胺-N-氧化物(trimethylamine-N-oxide,TMAO)等产物生成,损伤肠上皮屏障[14]。有研究[15-16]表明,TMAO 是心血管疾病的独立危险因素,这导致了CKD患者患并发症危险性增加,降低了CKD 患者的生存质量,导致了恶性循环。因此,CKD不仅使血液中累积的毒素进入肠道,并且造成肠源性毒素产生增加,二者共同参与CKD患者病情的进展。
近年来开展了许多关于短链脂肪酸(shortchain fatty acids,SCFAs)的研究,生理情况下在上消化道不能被分解的碳水化合物和蛋白,在盲肠和结肠中被肠道菌群分解,从而产生SCFAs。SCFAs主要参与机体脂肪生成,维生素的合成,胆固醇代谢等过程,并参与食欲调节[16-18]。WANG 等[19]的研究结果也显示,健康对照组的丁酸盐含量几乎是CKD 组的3 倍,SCFAs 也显著高于CKD 组。就是这样一种对消化道乃至整个机体都有益的产物,由于CKD 患者的肠道环境发生改变,不利于产SCFAs 细菌的生存[20]而减少。SCFAs 具有调节结肠Treg 细胞生长,阻止肠道炎症反应,修复肠上皮屏障的功能[21],当SCFAs 的减少导致肠上皮的自我保护能力和修复功能均遭到破坏。该试验为临床干预工作提供了新思路:为CKD 患者补充SCFAs,从而使肠上皮屏障的自我修复功能得以恢复。因此,肠道菌群生存环境是由于上述毒素的累积和有益成分的减少两方面原因共同作用,使血液中有害物质堆积并且产生大量肠道毒素,导致肠上皮屏障被破坏后无法修复,更多的毒素进入肠腔,同时也有更多的细菌和毒素入血,使得肠道菌群严重失调并造成肾脏功能的进一步恶化。
2.2 CKD 患者肠道菌群的变化由于上述肠道菌群的生存环境发生改变,CKD 患者,特别是当疾病进展到CKD 5 期时,肠道菌群大多会发生紊乱。吕晨箫等[22]通过粪便检测来研究终末期肾脏病患者的肠道优势菌群,结果表明:在属的水平上,双歧杆菌属、链球菌属、瘤胃球菌属、柯林斯氏菌属的丰富度明显高于对照组,其组成与健康对照组有明显的差异。
这项研究还发现:健康对照组的优势菌群主要为拟杆菌门,透析治疗组的优势菌群主要为厚壁菌门,而非透析治疗组的优势菌群主要为放线菌门。通过对比3组的结果,可以发现当CKD进展到终末期肾脏病阶段时,肠道优势菌群已发生明显更替,并且透析治疗也会对肠道优势菌群的更替产生影响。因此,终末期肾脏病患者的肠道菌群变化显著,这种变化会加速恶性循环,导致不良结局,虽然此阶段采取的透析治疗措施会对肠道菌群的结构产生一定的影响,但是否会对终末期肾脏病患者的预后有所改善还需要进一步的研究。
如图1所示[23],CKD 所致正常肠道菌群的失衡,产生了以下后果:(1)通过破坏结肠上皮紧密连接和降低上皮存活率来损害肠上皮屏障。肠上皮屏障完整性丧失,使得细菌和脂多糖移位;(2)免疫反应失调和炎症反应。脂多糖可以通过活化Toll 样受体4(TLR4)依赖性和核因子-κB 途径激活自然杀伤细胞。致病菌刺激树突状细胞激活Th17/Th1 T 细胞,增加细胞炎性因子的产生;(3)肠道中的碳水化合物、胆汁酸和蛋白质被肠道致病细菌发酵产生硫酸吲哚酚,TMAO 等有害物质。益生菌特别是双歧杆菌的减少引起SCFAs的减少。
3 肠道菌群失调对CKD 的影响
3.1 肠源性毒素对CKD 的作用大量研究已探明3 种主要肠源性尿毒症毒素的作用机制:(1)硫酸吲哚酚通过上调转化生长因子-β 的表达,激活肾素-血管紧张素-醛固酮系统,并通过氧化应激等机制促进肾组织的纤维化;(2)硫酸对甲酚主要通过诱导自由基的产生和炎症细胞的浸润,导致肾组织的进一步纤维化,并通过激活肾素-血管紧张素-醛固酮系统,进一步使肾功能恶化[24];(3)TMAO 通过引起全身炎症反应等机制损害肾功能[14]。这3 种肠源性毒素通过不同通路上调炎症因子的表达,从而通过激活肾素-血管紧张素-醛固酮系统或促进氧化应激的机制加重CKD 病人的肾脏损害。
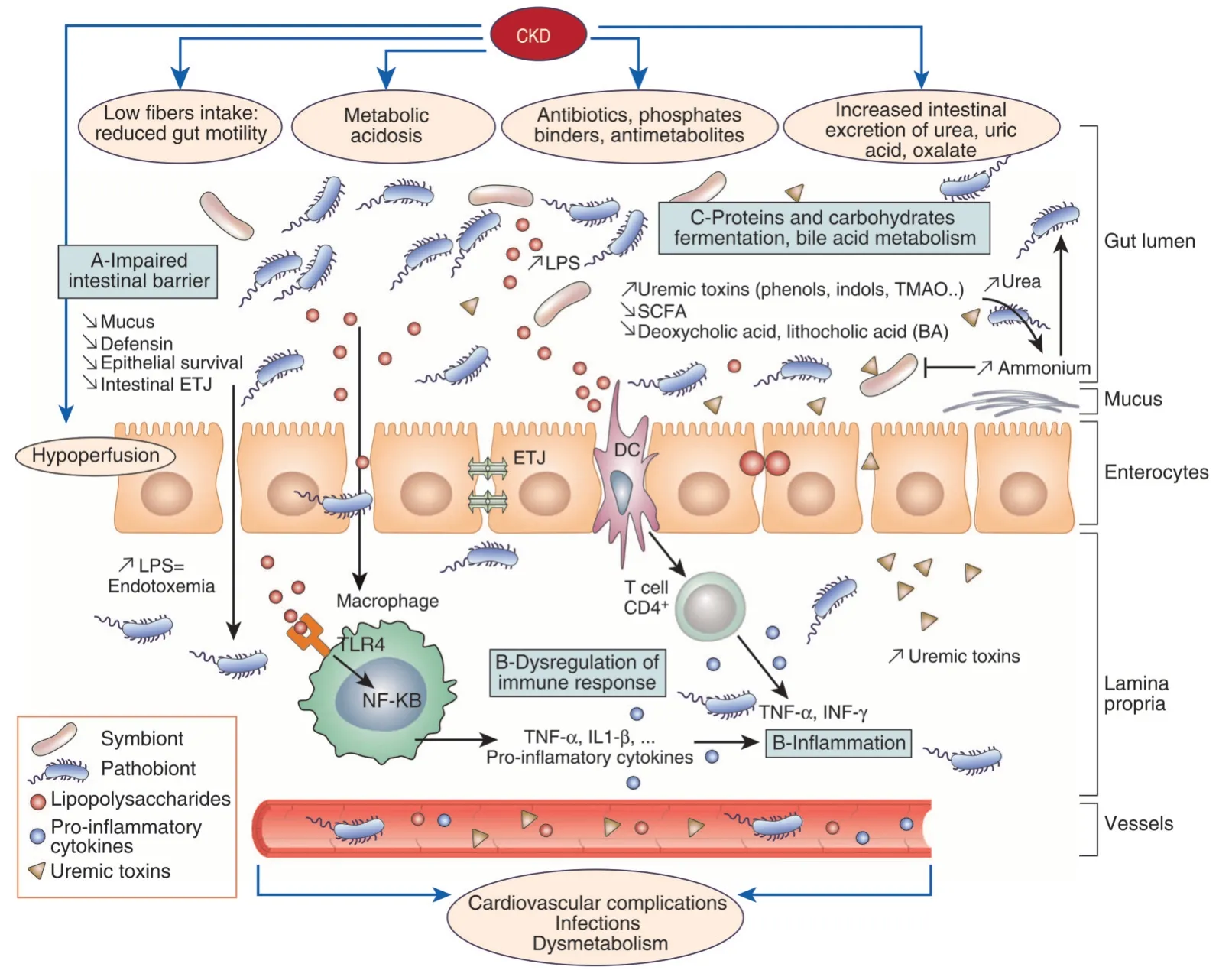
图1 肠道菌群失调与CKDFig.1 Intestinal flora imbalance and chronic kidney disease
除上述3 种有害物质外,POESEN 等[25]还发现高血清苯乙酰谷氨酰胺水平组与低血清苯乙酰谷氨酰胺水平组之间的死亡患者数量存在明显的差异,这使其成为另一种有可能影响CKD 预后的危险因子。虽然其作用机制尚不明确,但肠源性尿毒症毒素主要通过两种方式导致肾功能的进一步恶化:(1)入血后直接损伤肾脏细胞;(2)入血后诱发氧化应激损伤肾脏细胞,故可以将上述两种机制作为研究方向。
含尿素酶的肠道菌使尿素转化为NH4OH,从而损伤肠上皮屏障,这种损伤导致炎症细胞的募集,正反馈调节炎症因子的大量释放和紧密连接细胞的内吞作用,使得肠上皮屏障被进一步破坏[26]。不完整的肠上皮屏障功能不仅被细菌直接黏附损害,而且遭受毒素的侵蚀,加之SCFAs 的减少,修复能力减弱,肠上皮屏障处于一个长期进行性破坏的恶性循环中。
3.2 肠道革兰阴性杆菌大量增殖对CKD 的作用肠道的革兰阴性杆菌大量增殖,产生大量的内毒素,并通过肠上皮屏障进入血液后,依赖TLR4激活下游的各种级联炎症反应[27]。不仅如此,还认为肠道菌产生的内毒素易位不仅是炎症反应的重要促成因素,同时也是CKD 的独立死亡因子。但也有研究表明,长期的TLR 活化,容易在全身炎症反应的同时产生一种免疫耐受,且肠道菌群的脂多糖等成分具有免疫沉默的特性,这会使单个细胞经历从激活到耐受的阶段性变化,若反映在全身水平,则成为炎症反应与免疫缺陷的共存状态[28]。故可推测:两者之间存在一个平衡点,当机体的免疫耐受与炎症反应达到这个平衡点后,机体可能会表现出一种反映炎症水平的各项指标正常的假象,此时更需要提高警惕,指标的恢复可能是到达平衡点而不是病情的好转。
原发或继发于CKD 的肠道菌群失调通过三方面影响着CKD 的发展和预后:(1)肠道的环境不适宜益生菌的生长,反而更加适合其他有害菌群的增殖,使得大量益生菌死亡,正常优势菌群被替代,有害菌群产生的大量毒素入血后对肾脏功能产生不良影响。(2)产生大量内毒素,募集炎症因子,导致全身炎症反应,进一步利用免疫反应损害肾脏功能。(3)肠道细菌的黏附作用和大量毒素使得肠上皮屏障功能受损,通透性增加,从而有更多的有害因子可以通过肠上皮屏障,增强另外两个因素对肾脏的损害作用。CKD 造成结肠菌群的明显失调,并且大大影响肠黏膜上皮屏障的结构和功能,而这些又是造成CKD 不良预后的重要因素。
4 肠道微生态的干预
4.1 益生菌益生菌是指在宿主胃肠环境定植或植入并发挥有益健康作用的活微生物,具有免疫调节作用,包括调节肠上皮细胞的NF-κB,丝裂原活化蛋白激酶,CRP,IL-6,IL-8,TNF-α、IL-1β 和干扰素。通过对免疫因子和信号通路的调整,降低全身炎症反应和对肾脏的损伤,延缓CKD 进展到终末期肾脏病的时间。不仅如此,大量的基础研究发现了几种益生菌增强肠上皮屏障功能的机制:(1)上调紧密连接蛋白的表达;(2)增强跨上皮的电阻;(3)使黏液分泌增多;(4)上调丁酸盐水平;(5)调节微生物群[29-30]。益生菌在调节免疫的同时增强肠上皮的屏障作用,减少有害物质入血,从而减少炎症细胞的募集,改善机体内环境和CKD的预后。
如今,人们的膳食结构愈加偏向高脂饮食,但高脂饮食可以通过提高肠道有害菌群的水平,造成肠道菌群的紊乱,加剧肠道炎症。其中,大肠杆菌明显降低了小鼠粪便中SCFAs 的水平,而益生菌又显著改善了这一现象,不仅如此,益生菌还可以提高小鼠粪便中SCFAs 的含量,有效改善了肠道菌群结构[31]。SUN 等[32]也发现益生菌的补充显著降低了反流性食管炎患者的腹泻综合征评分并且有效抑制了肠道菌群的过度增殖。大量的研究已证实益生菌对肠道菌群的确切有益作用,因此可以提倡益生菌在肠道菌群失调患者中的常规应用,从而改善患者的肠道情况。
4.2 益生元益生元是指能够选择性地刺激宿主肠道内一种或几种有益菌的活性或生长繁殖,而又不能被宿主消化和吸收的一种无活性的食物成分[33]。近期一项关于高直链玉米抗性淀粉的研究发现,补充高直链玉米抗性淀粉可以提高SCFAs量,并减少血清尿素、IL-6、TNF-α 和丙二醛的水平[34]。该物质通过提高肠上皮屏障的自我修复和保护功能,减少炎症因子的募集、减弱全身炎症反应,从而改善CKD 预后。有研究[35]发现,由于CKD 患者常规采取限制蛋白饮食,单纯的饮食调节对于CKD 病情的改善作用不大,但在配合菊粉的摄入时,肠道双歧杆菌的量显著增加,提高了血清SCFAs 的水平。因此,由于益生元可以明确改善肠道环境,调节肠道菌群且尚无副作用病例报告,临床医生或许可以在治疗中尝试联合使用几种益生元制品,根据患者肠道菌群的结构和不同益生元的作用,找到适合患者的配伍,有针对性地刺激有益菌群的增殖。
4.3 合生元近年来,益生菌与益生元的研究成为热点,将两者合用,称之为“合生元”,二者合用在理论上可以减少有害成分的产生,增加SCFAs产生,提高肠道自我修复能力,从而在根本上平衡肠道微生态,有利于CKD 的治疗和预防。并且有研究发现合生元的补充能明显增高肠道双歧杆菌的量,同时减少其他有害菌属的丰度[36]。并且由于胃肠道不良反应少,患者依从性较好,治疗效果可能优于其他药物。
4.4 维生素在ZHOU 等[37]关于维生素D 水平高低与结直肠癌发展关系的研究中,分别进行结直肠癌小鼠模型试验和临床样本的研究,结果表明结直肠癌患者的血清维生素D水平明显低于对照组。小鼠模型的研究不仅印证了这一结果,并且在补充适量的维生素D 后小鼠的整体情况均有所改善。因此,维生素D也可能对肠道菌群的稳态有调节作用,特别是在调节肠道益生菌和稳定肠上皮屏障方面。
5 挑战与展望
现如今,CKD 的疾病负担日益增加,对于CKD和肠道微生态的研究越来越深入,二者相互影响,互为因果的机制也日益清晰。但各类肠道菌群的功能并不十分明了,因此需要更多的研究来揭示肠道菌群的组成和其作用机制。目前对于肠道微生态的干预措施还不够规范,需要更多大样本、大数据的临床随机对照试验支持,为微生态制剂干预治疗CKD 展开更广阔的前景。
