紫菀石斛组培快繁技术研究
2020-07-18李桂琳李泽生周侯光
姜 艳,高 燕,李桂琳,李泽生,周侯光,罗 凯
(云南省德宏热带农业科学研究所,云南瑞丽678600)
紫菀石斛(Dendrobium transparens)是一种喜阴凉的多年生兰科石斛属(Dendrobium)草本植物,原产于缅甸、印度海拔1 500 m 的山中,花色素丽,玲珑可爱,花姿优雅,株型优美,具有很高的观赏价值。杨晓娜等[1]研究结果表明,紫菀石斛具有相当高的营养价值。近年来随着生活水平的不断提高,人们对紫菀石斛的需求量不断增大,野生紫菀石斛资源产出量远远跟不上需求,人工栽培紫菀石斛便应运而生。目前紫菀石斛种苗繁殖主要是靠收集野生资源进行分株繁殖,增殖系数低,原材料浪费大;加之过度采挖,紫菀石斛野生资源日益枯竭。随着紫菀石斛生产种植规模的扩大,分株繁殖已不能满足市场对种苗的需求。近十多年来,随着植物组培技术的发展以及生产需要,很多植物常利用组培快繁种苗,文心兰、蝴蝶兰、铁皮石斛、鼓槌石斛等兰科植物已经实现规模化生产[2-5]。为了探索紫菀石斛组培育苗的最佳途径,笔者于2017-2018 年对从缅甸引进的紫菀石斛野生蒴果种子开展无菌播种、原球茎诱导、增殖分化、壮苗生根、假植育苗和移栽技术试验研究,现将结果报道如下。
1 材料和方法
1.1 试验材料
供试紫菀石斛从缅甸引进,栽培于云南省德宏热带农业科学研究所石斛资源圃。选择无病害、生长健壮植株上所结的发育正常、饱满成熟、未开裂的蒴果为外植体。
1.2 方法
1.2.1 无菌播种
蒴果用0.1%洗洁精或洗衣粉洗净,纯净水冲洗2~3 次,置于超净工作台上,用75%的酒精消毒60 s,10%次氯酸钠溶液消毒15~20 min,无菌水清洗5~6 次,用无菌滤纸吸干表面水分,酒精灯烘烤外植体表面至干燥。切开蒴果,将种子均匀播种在5 种不同萌发培养基:A1)1/2 MS+蔗糖25 g/L+琼脂5.0 g/L,A2)1/2 MS+蔗糖25 g/L+琼脂5.0 g/L+马铃薯泥5 g/L,A3)1/2 MS+蔗糖25 g/L+琼脂5.0 g/L+香蕉泥5%,A4)1/2 MS+蔗糖25 g/L+琼脂5.0 g/L +6-BA 0.1 mg/L,A5)1/2 MS+蔗糖25 g/L+琼脂5.0 g/L+NAA 0.1 mg/L,每个处理接种5 瓶,先暗培养5 d,再转入光照培养。培养基pH 为5.8,培养温度为22~25℃,光照强度为1 600~2 000 lx,光照时间8~10 h/d。培养50 d 后统计萌发率。
1.2.2 继代增殖分化培养
将种子萌发形成的小芽接种于继代增殖分化培养,以MS+蔗糖30 g/L+琼脂5.0 g/L+马铃薯泥50 g/L+香蕉泥30 g/L 为基本培养基,分别添加不同浓度的6-BA(0.1、0.2、0.4 mg/L)或NAA(0.1、0.2、0.4 mg/L),共6 种培养基(B1-B6 处理),每种培养基接种10 瓶,每瓶接种10 株。培养温度为(25±2)℃,光照强度为1 800~2 200 Lx,光照时间10~12 h/d。培养50 d 后统计增殖倍数及生长状况。
1.2.3 壮苗生根培养
将丛生芽分割成单芽,选取株高在3 cm 以上的单芽接种于不同壮苗生根培养基,以3/4 MS+蔗糖20 g/L+琼脂5.0 g/L+NAA 0.5 mg/L 为基本培养基,分别添加不同浓度的马铃薯泥和香蕉泥:C1)香蕉泥100 g/L,C2)香蕉泥70 g/L+马铃薯泥30 g/L,C3)马铃薯泥100 g/L,C4)香蕉泥50 g/L+马铃薯泥50 g/L,共4 种培养基(C1-C4 处理),每种培养基接种10 瓶,每瓶接种10 株。培养温度为(25±2)℃,光照强度为1 800~2 200 lx,光照时间10~12 h/d。培养50 d 后统计生根率及生长状况。
1.2.4 炼苗
选取生长一致、株高4~6 cm、根系3 cm 以上的瓶苗,分别置于荫蔽度70%~80%的塑料大棚苗床上炼苗5、10、20、30 d,共4 个处理(D1-D4),每个处理50 瓶。棚内通风透气,无漏雨,控制温湿度。按照统一流程移栽,观察不同炼苗时间的移栽成活率及生长状况。
1.2.5 移栽
将株高5 cm 以上、炼苗20 d 的生根苗取出,用清水洗干净根部的培养基,在50%多菌灵可湿性粉剂1 000 倍溶液中浸泡10 min,捞出放入透气的容器内,均匀摊开,晾干至根部发白,分别移栽至4 种不同的基质:E1)刨花,E2)树皮,E3)树皮屑/刨花体积比=1/1,E4)树皮屑/水苔体积比=2/1,3 株/丛,株行距5 cm×5 cm。荫蔽度70%~80%,湿度60%~70%,温度控制26~30℃。移栽60 d后统计成活率及生长状况。
2 结果与分析
2.1 不同培养基配方对紫菀石斛种胚萌发率的影响
无菌播种12~18 d 后,种子慢慢吸水膨大,由金黄色变成绿色,40 d 后从种胚诱导出大量的原球茎,50 d 后原球茎萌发出绿色芽尖(图1)。紫菀石斛种胚在不同的培养基中都能萌发,由表1可以看出,以A2 处理(1/2 MS +蔗糖25 g/L+琼脂5.0 g/L+马铃薯泥5 g/L 培养基)种子萌发率最高(95%),萌发时间最快(12 d),原球茎粗壮,呈绿色;A3 处理(1/2 MS+蔗糖25 g/L+琼脂5.0 g/L+香蕉泥5 g/L 培养基)种子萌发率较高(90%),萌发时间和萌发状况与A2 处理近似;A4 和A5 处理(1/2 MS+6-BA 0.1 mg/L 和1/2 MS+NAA 0.1 mg/L 培养基)种子萌发率较低,分别为87%、85%,萌发时间较长(15~16 d),原球茎较细弱,浅绿色;A1 处理(1/2 MS 培养基)种子萌发率最低(80%),原球茎细弱,黄绿色。

表1 不同培养基配方对紫菀石斛种胚萌发及原球茎诱导的影响
2.2 不同激素浓度对紫菀石斛继代增殖分化的影响
将种胚萌发分化的幼芽接种于添加不同激素浓度的培养基中,15 d 后幼苗开始分化出小芽,小芽不断分蘖长出丛生芽。结果(表2)显示,6种增殖分化培养基中,以B2 处理(MS+蔗糖30 g/L+琼脂5.0 g/L+马铃薯泥50 g/L+香蕉泥20 g/L+6-BA 0.2 mg/L 培养基)增殖分化效果最好,增殖倍数最高,为10.2 倍,分化的小苗整齐均匀,在培养基上长出密集的小苗,叶片大、深绿色、生长粗壮;当6-BA 浓度为0.4 mg/L 时,增殖倍数呈下降趋势,分化的小苗叶片细长,再分化能力变弱;B5 处理(MS+蔗糖30 g/L+琼脂5.0 g/L+马铃薯泥50 g/L+香蕉泥20 g/L+NAA 0.2 mg/L 培养基)增殖分化效果好,增殖倍数最高(9.8 倍),当NAA 浓度为0.4 mg/L 时,小苗根系发达,但叶片细小,生长缓慢,增殖倍数下降。

表2 不同激素浓度对紫菀石斛继代增殖分化的影响
2.3 不同添加物对紫菀石斛壮苗生根的影响
将继代增殖培养长至3 cm 以上的幼苗接种于不同添加物浓度的培养基中进行壮苗生根培养的结果见表3 和图2。从中可以看出,4 种生根培养基中,以C2 处理(3/4 MS+蔗糖20 g/L+琼脂5.0 g/L+NAA 0.5 mg/L+马铃薯泥30 g/L+香蕉泥70 g/L 培养基)诱导生根效果最好,平均株高6.7 cm,平均根数5.5 条,平均根长5.2 cm,生根苗粗壮,叶片舒展,根系多而粗壮;其次为C1 添加香蕉泥100 g/L 培养基诱导生根较好,平均株高5.8 cm,平均根数5.3 条,平均根长4.9 cm,生根苗健壮,叶片深绿色;添加马铃薯泥100 g/L 的C3 培养基诱导生根较差,平均株高4.9 cm,平均根数3.4 条,平均根长3.1 cm,生根苗细弱,叶片短小,根系少而细弱。说明香蕉泥和马铃薯泥浓度合理组配对紫菀石斛生根有显著的促进作用,且对幼苗的生长有一定促进作用。
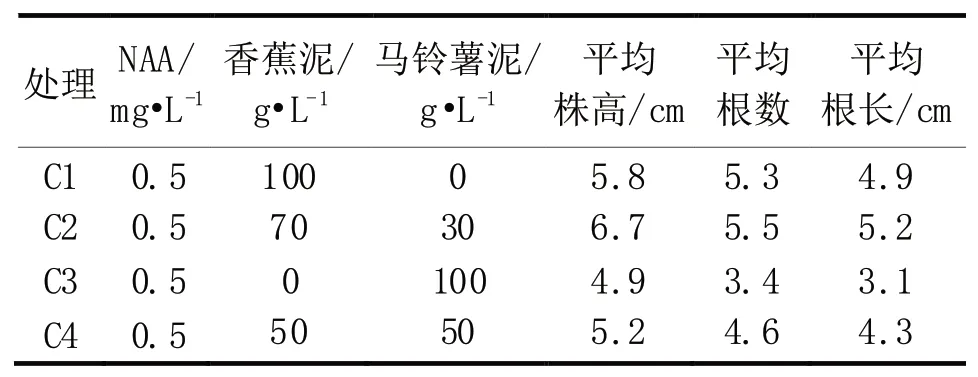
表3 不同添加物对紫菀石斛壮苗生根的影响
2.4 不同炼苗天数对紫菀石斛移栽成活的影响
从表4 可以看出,瓶苗的污染率随着炼苗天数的增加而增加,而成活率呈抛物线分布。D3 处理(炼苗20 d)为最好,污染率低(4%),成活率最高(95%),瓶苗生势好,无黄叶,无黑色根;炼苗<10 d,虽然污染率低,但成活率低于85%;炼苗30 d,污染率高达8%,成活率降至93%。

表4 不同炼苗天数对紫菀石斛移栽成活的影响
2.5 不同基质对紫菀石斛移栽成活的影响
紫菀石斛生根瓶苗在自然光下炼苗20 d 后,叶色转深绿色,叶片厚大、舒展,茎基部转深绿色、粗壮,白色根增多、粗壮。从表5 可以看出,以E3 处理苗的长势最好,苗床下层铺厚度4 cm 树皮屑(大小2~3 cm),上层铺厚度4 cm 刨花,透气、沥水,保湿效果好,移栽成活率达96%,生长抽芽快;E4 处理表现也不错,树皮屑间隙大,难以操作,树皮屑上铺一层水苔,湿度控制不好,根基部易腐烂,生长抽芽慢;E1 处理腐熟消毒不彻底,透气、沥水性较差,移栽后刨花易长霉菌而板结,水肥吸收困难,成活率低(87%),但刨花成本低廉。
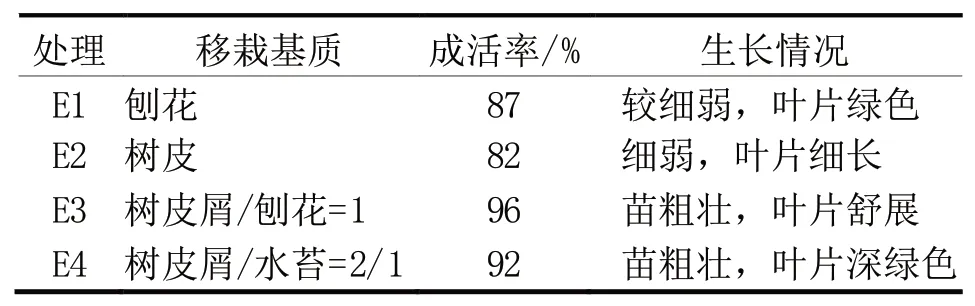
表5 不同基质对紫菀石斛移栽成活的影响
3 结论
通过试验研究,筛选出最适宜紫菀石斛种子萌发及原球茎诱导培养基为1/2 MS+蔗糖25 g/L+琼脂5.0 g/L+马铃薯泥5 g/L,萌发率达95%;增殖分化培养基为MS+蔗糖30 g/L+琼脂5.0 g/L+马铃薯泥50 g/L+香蕉泥20 g/L+6-BA 0.2 mg/L,增殖倍数达10.2 倍;壮苗生根培养基为3/4 MS+蔗糖20 g/L+琼脂5.0 g/L+马铃薯泥30 g/L+香蕉泥70 g/L+NAA 0.5 mg/L,生根率达100%,苗壮、株高、根系多而粗壮,生长好。
不同培养阶段添加天然有机物对紫菀石斛种子的种胚萌发生长有促进作用。种子萌发时,原球茎在1/2 MS 基本母液中添加马铃薯泥5%的培养基中生长好,说明马铃薯对原球茎增殖分化有促进作用,该试验结果与高燕等[6]的研究结果相符合。无菌播种获得的原球茎如不及时转接到增殖分化培养基中,会很快分化成小苗慢慢变黄,影响分化率。在显微镜下观察,紫菀石斛种子的种胚比白芨种子种胚小,积累的营养成分要少,紫菀石斛种子萌发诱导原球茎再进行增殖分化,这与李守岭等[7]报道相同。因此,在紫菀石斛组培快繁过程中,在培养基中添加不同浓度的天然有机物对紫菀石斛种子萌发、出苗情况也不同,其中以马铃薯增殖分化效果最佳,马铃薯和香蕉合理组配对壮苗生根效果最佳,这与高燕等[8]报道相同。
不同的炼苗天数对幼苗移栽成活率影响较大,以炼苗20 d 最适宜,移栽后幼苗叶片厚大、深绿色有光泽,茎生长粗壮呈深绿色,成活率最高(95%);炼苗<10 d,叶片绿色,但叶片不够厚实,移栽成活率较低;炼苗>30 d,污染率增加,瓶内养分降低,黄叶增多,移栽成活率下降。
移栽基质以下层透气、沥水性好(树皮屑)与上层腐熟消毒(刨花)的组合最好,下粗上细的保水、透气性适于丛生芽的抽芽生长,保肥、保水性好,移栽成活率最高(96%)。树皮屑和水苔虽然沥水性好,但高温高湿季节的湿度若控制不好,易引起根基部腐烂,移栽成活率下降。
