耐碳青霉烯类肠杆菌科细菌耐药的临床危险因素分析
2020-07-17余嘉茵
杜 霞 余嘉茵
(广东省深圳市龙城医院ICU,广东 深圳 518172)
肠杆菌科细菌是条件致病菌,主要存在于人体的呼吸道和肠道中,包括肺炎克雷伯菌、奇异变形杆菌、大肠埃希菌、阴沟肠杆菌、黏质沙雷菌、产酸克雷伯菌等[1]。耐碳青霉烯类肠杆菌科细菌(CRE)的感染与高发病率和病死率密切相关[2]。高剂量美罗培南联合多黏菌素是治疗CRE 所致感染的有限选择,而多黏菌素耐药菌株的出现使CRE 感染的治疗变得越来越困难[3]。虽然肠杆菌科细菌对碳青霉烯类药物的耐药机制十分复杂,但其主要机制包括以下两种:碳青霉烯酶的产生,主要包括KPC 和OXA-48;AmpCβ-内酰胺酶或超广谱β-内酰胺酶(ESBLs)的膜孔蛋白损失或表达降低,导致外膜通透性降低,这是我国CRE 耐药菌株的主要耐药机制[4]。近年来,由于广谱抗生素、侵入性手术在危重患者中的广泛应用,我国CRE 引起的感染增加。CRE 感染患者的高病死率和缺乏有效抗感染药物的现状对临床治疗提出了挑战。因此,我们对CRE 临床危险因素进行了研究分析,旨在为CRE 感染患者的治疗提供依据。
1 对象与方法
1.1 研究对象与分组 对2018 年5 月—2019 年6月我院ICU 住院患者180 例的临床资料进行了回顾性研究。其中男70 例,女110 例;年龄30~80岁,平均(65±16)岁。病例纳入标准:①年龄>18 岁;②急性生理学与慢性健康状况评分Ⅱ(APACHE Ⅱ)>8 分;③疑有ICU 内感染;④留取了标本进行细菌培养。病例排除标准:①入ICU 时存在明确感染;②妊娠期及哺乳期妇女;③因非医疗原因中断治疗的患者。收集研究期间非重复检出CRE 菌株患者(CRE 感染组)的临床危险因素,包括基本病史、抗生素使用史、免疫功能、侵入性手术等。选择同期非CRE 细菌感染的患者(非CRE 感染组)作为对照,采用相同的方法收集患者资料。入选病例的感染诊断均符合文献[5]中肺部感染或泌尿系感染或血液感染的诊断标准,根据其相应痰液、尿液、血液培养是否存在CRE,将患者分为CRE 感染组(60 例)和非CRE 感染组(120 例)。抗生素暴露指检测CRE前90 d 内使用过抗生素[6]。抗生素联合使用指同时使用2 种及2 种以上不同种类抗生素。本研究从所有患者或其家属处获得书面知情同意。
1.2 细菌的鉴定及药敏实验方法 采用DL-96细菌测定系统进行了细菌鉴定,采用最小抑菌浓度(MIC)法和K-B 法检测肠杆科细菌对亚胺培南、美罗培南、厄他培南的耐药性(药敏纸片10 ug),药物敏感试验和结果评估按照2015 年临床和实验室标准研究所(CLSI)推荐的MIC 方法进行。质控菌株为大肠埃希菌,碳青霉烯类抗菌药物亚胺培南、美罗培南、厄他培南对质控菌株的抑菌结果均在CLSI 的允许范围内。
1.3 统计学处理 采用SPSS 16.0 软件分析数据。计量资料以表示,计数资料以例数(%)表示。采用χ2检验和Logistic 回归单因素分析方法进行患者基础资料、基础疾病、抗生素使用史、免疫功能、有创手术与CRE 感染相关性的分析。采用多因素Logistic 回归分析方法研究CRE 感染的独立危险因素。P<0.05 为差异有统计学意义。
2 结 果
2.1 标本来源 标本来源以痰液标本为主,占60.0%(108/180 例),其次是尿液标本和血液标本,各占21.1%(38/180 例)和18.9% (34/180 例)。
2.2 CRE 分布 60 例患者中,检出肺炎克雷伯菌28 例(46.7%),大肠埃希菌10 例(16.7%),黏质沙雷菌10 例(16.7%),奇异变形杆菌8 例(13.3%),其他肠杆菌4 例(6.7%)。
2.3 CRE 感染的临床危险因素分析 对两组患者的基本病史、抗生素使用史、免疫功能和侵入性手术进行单变量分析。结果表明,ICU 入住时间>7 d、合并神经疾患、淋巴细胞减少、使用含β-内酰胺酶抑制剂的头孢菌素类抗生素、碳青霉烯类抗生素、抗生素联合用药等因素与CRE 感染有关。CRE 感染组的病死率和平均住院时间明显高于对照组,差异有统计学意义。见表1。
2.4 CRE 感染危险因素的多因素Logistic 回归分析 多因素分析结果显示,ICU 入住时间>7 d(95%CI 1.609~20.026,P<0.01)、使用β-内酰胺酶抑制剂抗生素(95%CI 2.219~27.071,P<0.01)和碳青霉烯类抗生素(95%CI 2.259~37.010,P<0.01)是CRE 医院感染的独立危险因素。见表2。
3 讨 论
CRE 是医院感染的一种重要病原菌,病死率高,尤其是合并严重其他疾病的患者[7-8]。由于质粒介导的碳青霉烯耐药菌株(产生KPC)在世界上广泛流行[9-10],临床推荐了几种基于多黏菌素、替加环素和美罗培南的联合疗法,但没有临床证据证明其有效性[3,11]。
本研究结果显示,ICU 入住时间>7 d 是CRE感染的一个重要危险因素。患者在ICU 停留时间越长,医院感染的可能性越高。更多的侵入性手术也使患者暴露于耐药细菌的风险更高。此外,CRE感染患者的病死率明显高于未检出CRE 的感染患者,平均住院时间比后者长。其他研究表明,CRE感染的住院费用也显著增加[12]。导致这一结果的原因是CRE 的抗感染治疗方法有限,目前必须联合使用大量药物。
使用β-内酰胺酶抑制剂是CRE 感染的独立危险因素。超广谱β-内酰胺酶(ESBL)不能水解碳青霉烯类抗生素,CRE 对碳青霉烯类抗生素的耐药性可能仅在伴有膜孔蛋白缺乏时发生[13-14]。一个有趣的现象是,几乎所有碳青霉烯酶基因阳性的菌株都有一个以上的ESBL 基因。ESBL 基因在细菌耐药性形成中的作用尚未明确[15]。
碳青霉烯类抗生素对肠杆菌科细菌的抗菌作用有利于碳青霉烯类产生菌的筛选,从而导致CRE 菌株的大量产生[16-17]。广谱抗生素联合β-内酰胺酶抑制剂对CRE 易感的原因包括抗生素的筛选和β-内酰胺酶抑制剂的诱导[18]。在其他研究中,联合使用抗生素是导致CRE 感染的独立危险因素[19],但在我们的研究中并没有发现。这种情况表明,导致CRE 感染的主要因素可能是β-内酰胺酶抑制剂和碳青霉烯类抗生素等广谱抗生素
的使用,而抗生素的组合是一个混杂因素。而金属酶产生和丝氨酸碳青霉烯酶产生是CRE 的主要耐药机制[20-21]。体外药敏试验中,米诺环素(对肠杆菌敏感率55.2%)、阿米卡星(对肠杆菌敏感率48.3%)和复方新诺明(对肠杆菌敏感率43.1%)对CRE 也有较高的敏感性,但米诺环素和复方新诺明治疗严重感染的疗效尚不清楚,阿米卡星的肾毒性大于其他药物。因此,上述药物可作为联合用药的选择之一。呋喃妥因也具有很高的敏感性(敏感率96.1%)[22],但只能用于尿路感染。阿维巴坦是新一代β-内酰胺酶抑制剂,用于抑制丝氨酸碳青霉烯酶(Ambler A),缺乏金属酶(Ambler B)活性[23],尽管头孢他啶/阿维巴坦在治疗CRE 感染方面表现出良好的效果,但该药物的使用受到了金属酶作为CRE 菌株主要耐药酶的限制。
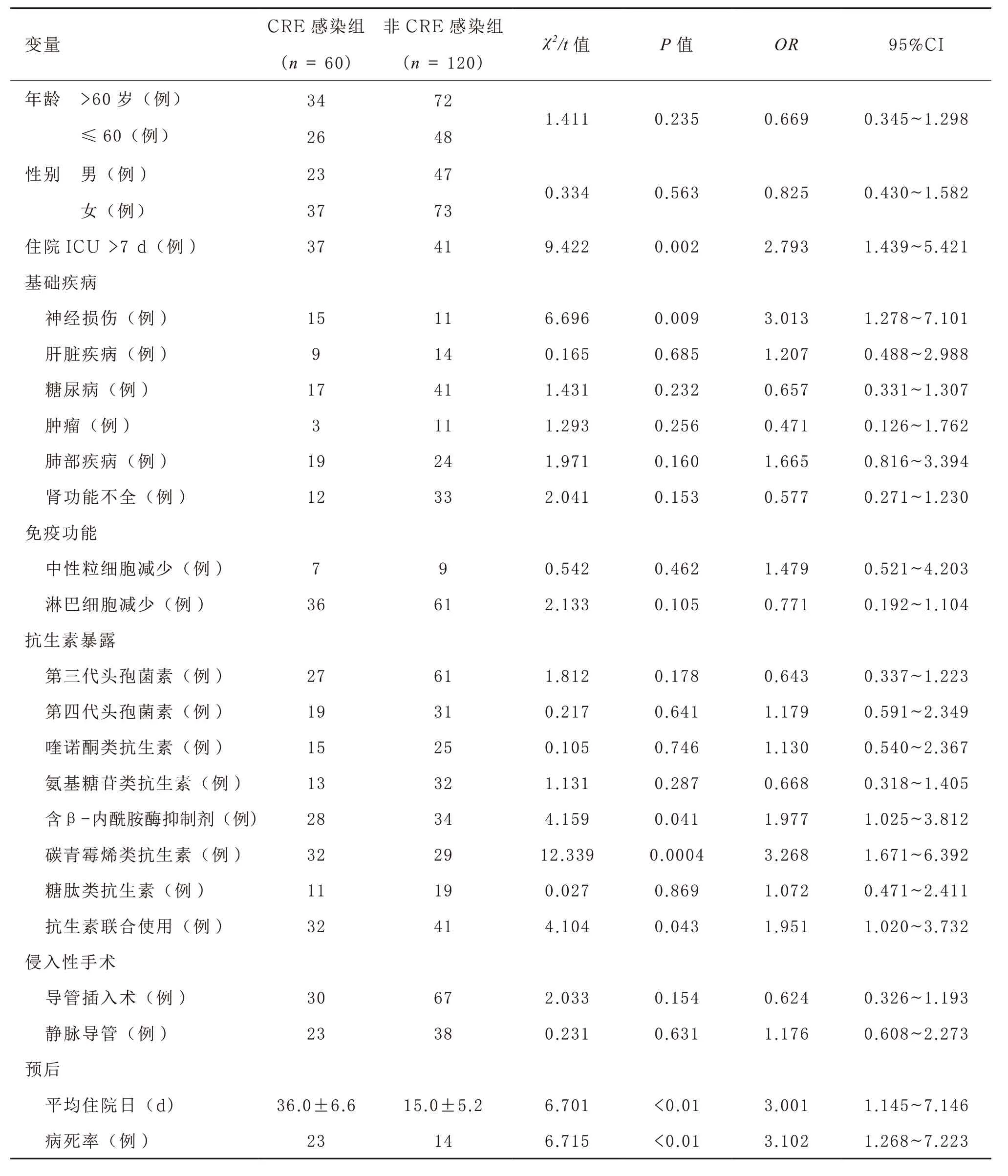
表1 CRE 感染的临床危险因素单因素分析
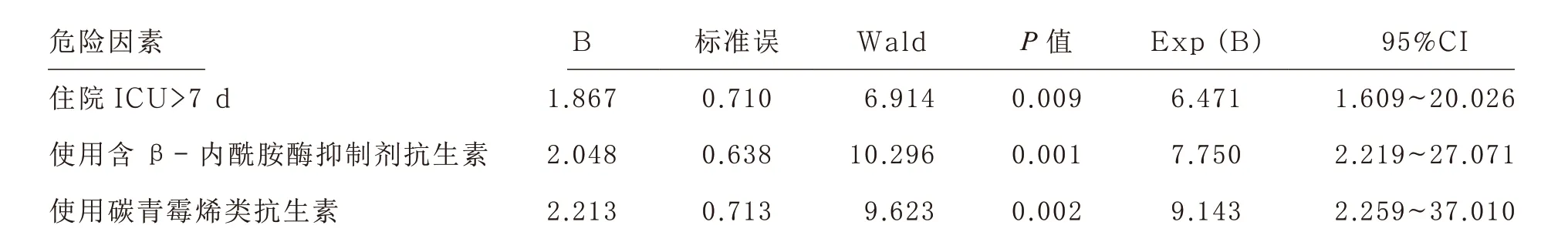
表2 CRE 感染危险因素的多因素Logistic 回归分析
