九寨沟国家级自然保护区长海夏季浮游植物群落结构及生态评价*
2020-07-17邢冰伟徐季雄邓贵平庞婉婷
邢冰伟,徐季雄,曹 玥,邓贵平,庞婉婷
(1:上海师范大学生命科学学院,上海 200234)
(2:成都理工大学旅游与城乡规划学院,成都 610059)
(3:九寨沟国家级自然保护区管理局,阿坝 623402)
九寨沟国家级自然保护区是国家首批5A级风景区,于1992年被联合国教科文组织列入世界自然遗产名录,1997年被纳入世界人与生物圈保护区网络. 九寨沟的旅游业发展迅速,游客人数从1984年的不足3万人次到2015年激增到超过5百万人次[1]. 游客人数的快速增长,使得水体中氮、磷浓度增加,湖泊水体富营养化[2],使九寨沟的生态系统变得异常复杂. 长海(33°0′75″~33°4′70″N,103°92′97″~103°94′38″E)位于九寨沟国家级自然保护区则查洼沟的中部,海拔3060 m,面积0.9957 km2,平均水深44.57 m,是九寨沟湖面最宽、水深最深的湖泊,湖泊最深处达百余米,呈S行展布. 丰水期的长海容积达4600×104m3,比树正沟和日则沟湖泊容积之和的3倍还多. 其水源补给来自于雨水、高山冰雪融化、降雨和地下水. 而水的排泄除了少部分会通过地表径流流向下游以外,主要通过地下岩通道排向另一侧的日则沟. 根据同位素示踪技术,长海水沿溶岩通道向日则沟箭竹海-天鹅海段渗透,丰水期量占箭竹海径流总量的21%,枯水期为28%,绝对渗透量稳定,无季节变化[3]. 长海是九寨沟内湖泊群重要的天然调节水库[4]. 因长海的水文地质条件,使其成为独特的高山湖泊生态系统.
高山湖泊对于全球气候变化及人类影响是一个极为敏感的参照系统[5-6]. 由于其处于特殊的地理位置和较为极端的环境条件,如低温、强辐射,大部分缓冲能力较低,营养水平低,因此,相对于其他湖泊而言,高山湖泊的水生态系统相对简单,对于环境的响应更快、更敏感. 即使很小的变化也能显著影响高山湖泊的理化性质,从而引起生物组成和群落结构的变化[6-8]. 浮游植物在水生生态系统中占有重要地位,对水域生态系统的物质循环、能量流动及维持水域生态系统平衡方面都起着非常重要的作用[9]. 因此研究高山湖泊浮游植物群落结构对揭示湖泊生态系统功能的变化,预测生态系统对当前以及未来环境变化的响应有着重要意义.
最早研究高山高寒湖泊浮游生物可以追溯到19世纪末20世纪初,主要是研究浮游动物的种类组成和地理分布[10-13],此后有关生命周期、浮游生物垂直迁移等生态学问题引起了研究者的关注[14-15]. 自1950年以来,学者们研究了在厚冰层下浮游植物生存的机制及调节垂直分布的季节性变化[16-18],金藻和隐藻等几种藻类的混合营养上[19-22],氮、磷的变化对湖泊有很大的生态影响等方面的问题[23-26],取得了一些重要的研究结果. 我国对于高山湖泊的研究较晚,云宝琛等调查了长白山天池的浮游植物群落结构,分析了其结构组成[27],马晓东等分析了新疆柴窝堡湖浮游植物的群落结构特征[28],我国高山湖泊众多,但相关研究相对较弱. 本文于2014年7月对长海浮游植物群落组成进行研究,探讨影响长海浮游植物水平分布和垂直分布的成因,为高山湖泊生态系统的研究提供资料.
1 材料与方法
1.1 采样时间和样点设置
于2014年7月,在长海全湖共布设12个样点. 在湖中心最深的s8点(80 m)自表层沿垂直方向布设9个分层(0.5、5、10、15、20、25、30、40、50 m)进行采样,见图1.
1.2 样品采集与处理
浮游植物定性、定量样品的采集及计数方法根据《淡水浮游生物研究方法》等相关文献[29-30]. 浮游植物鉴定采用经典文献[31-36]. 垂直样品用1 L采水器分别在0.5 m(s8-1)、5 m(s8-2)、10 m(s8-3)、15 m(s8-4)、20 m(s8-5)、25 m(s8-6)、30 m(s8-7)、40 m(s8-8)、50 m(s8-9)处采集2次,之后使用常规方法处理. 同步采集水样测水质. 其中水温、pH值、溶解氧(DO)等指标用YSI水质分析仪现场测定;总氮(TN)、氨氮、总磷(TP)、化学需氧量参照《湖泊富营养化调查规范》在实验室进行测定[37].
1.3 数据统计与分析
在Microsoft Excel 2010中完成主要数据整理及分析;Surfer 12软件完成对浮游植物水平分布等值线图绘制;C2软件完成部分浮游植物丰度和生物量变化的柱状图绘制.
优势种计算采用了Mcnaughton优势度(Y),公式为:
Y=fi(ni/N)
(1)
式中,ni/N为第i种个体数ni与总浮游植物个体数N的比值;fi为第i种在各点位的出现频率.
也可根据Kikvidze提出的优势种数目计算的方法:
(2)
式中,Vi是第i种的相对丰度;S为群落中的物种数;A为该群落中优势种个数.
Shannon-Wiener多样性指数(H′)计算公式:
H′=-∑(ni/N)log2(ni/N)
(3)
Margalef多样性指数(d)计算公式为:
d=(S-1)/lnN
(4)
Pielou均匀度指数(e)计算公式[38]为:
e=H′/lgS
(5)
2 结果与分析
2.1 长海浮游植物的水平分布
本次调查共发现浮游植物63种,隶属6门38属,其中硅藻门26属51种,绿藻门4属4种,甲藻门3属3种,金藻门2属2种,隐藻门2属2种,蓝藻门1属1种. 在长海浮游植物种类组成中,硅藻门种类数最多,占长海浮游植物种类数的81%,其他门浮游植物种类数比例较小. 由图2可知,各点位浮游植物种类数变化在15~26种之间,各位点种类组成变化不大,硅藻门在各点位种类组成中仍占据最大比例,占比达到47%~73%.
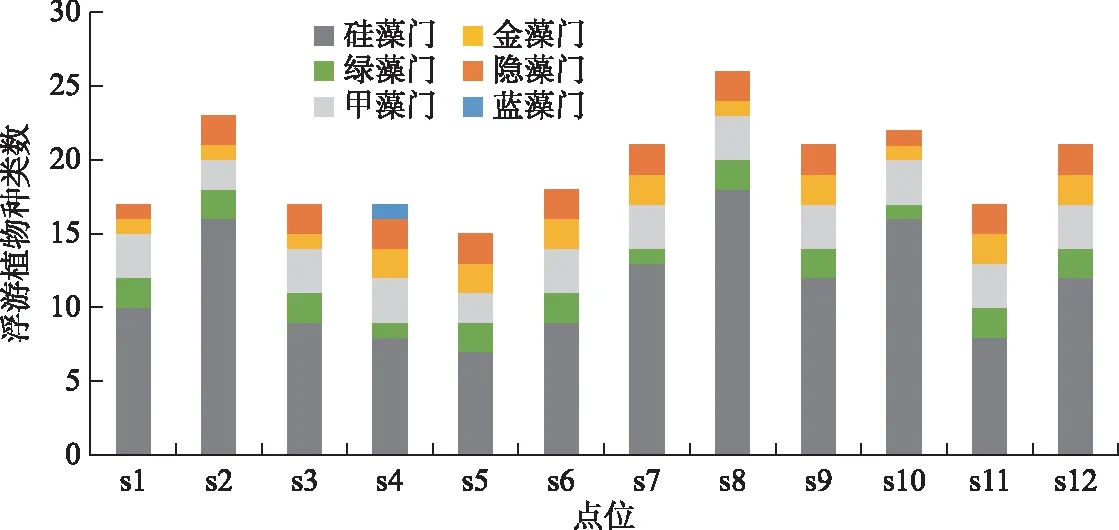
图2 长海各点位浮游植物种类组成
长海浮游植物丰度在水平变化上差异较大,在4.19×105~9.80×105cells/L之间变化,平均丰度为6.98×105cells/L. 其中s11点位浮游植物丰度最大,为9.80×105cells/L,其次是s4点位,为9.45×105cells/L,s1点位最小,为4.19×105cells/L. 从s1点位的入水口到s12点位的出水口,浮游植物丰度逐渐增加,而沿岸的浮游植物丰度大于湖心区域(图3).
生物量的分布规律与丰度略有不同(图3),表现为在水平分布上湖泊中部区域浮游植物生物量高于出水口和入水口区域. 长海浮游植物各点位在水平分布上生物量变化范围为0.19~0.52 mg/L,平均生物量为0.31 mg/L. 其中s4点位浮游植物生物量最大,为0.52 mg/L,其次是s7点位,为0.46 mg/L,s1点位最低为0.19 mg/L.
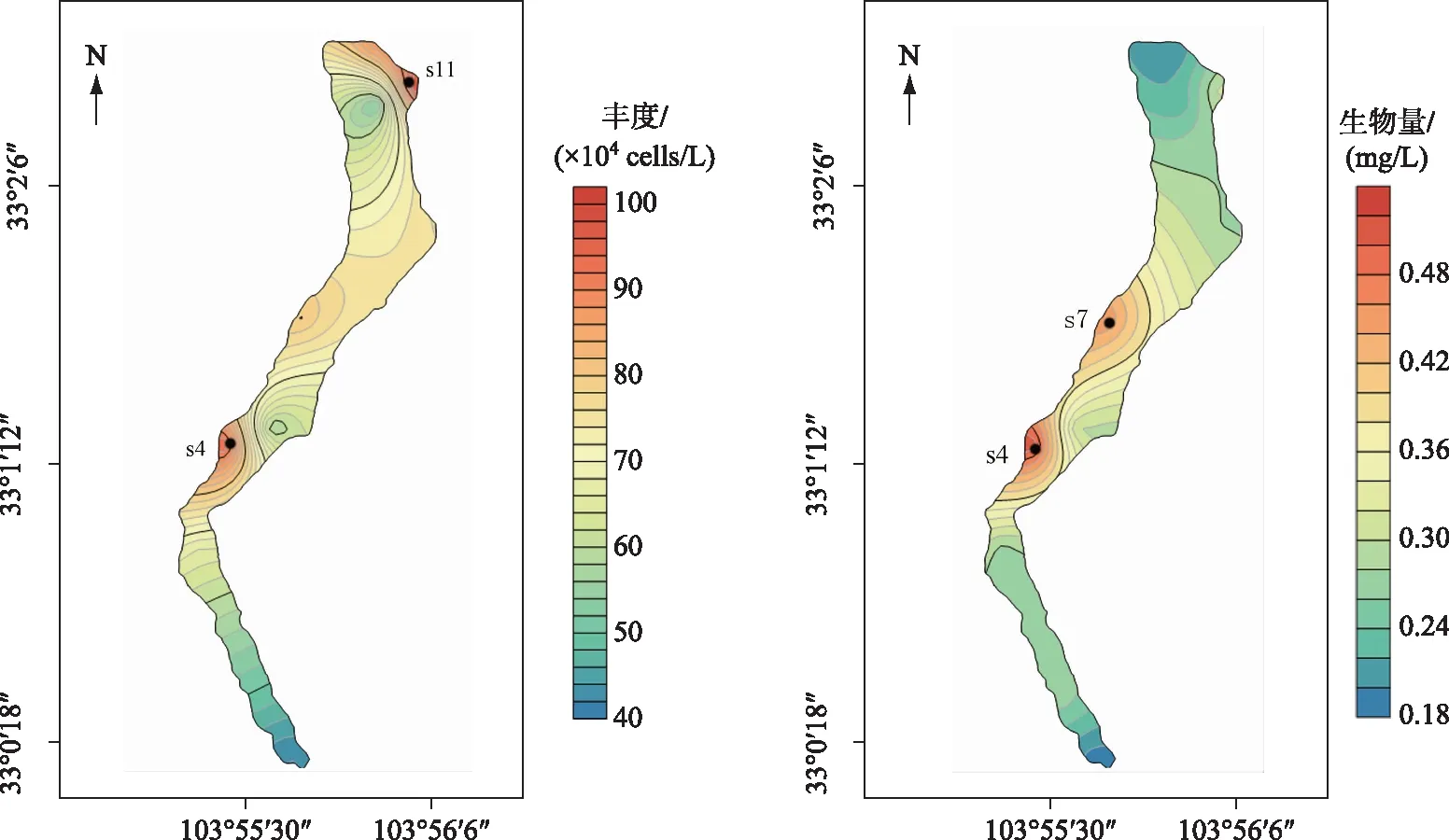
图3 长海浮游植物丰度和生物量水平分布
2.2 长海浮游植物的垂直分布
长海是一个高山深水湖泊,水温及生物的分层现象明显,为此我们在湖中心最深的位置(s8)做了浮游植物垂直分布情况的测定,各层面的浮游植物种类数和生物量见图4~6.
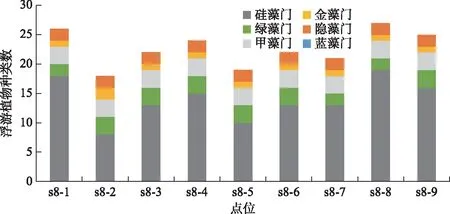
图4 长海s8点位浮游植物种类数垂直组成
从图4可以看出,浮游植物种类数差异不大,在18~27之间. 从种类组成而言,硅藻门比例最高,在44.44%~70.37%之间. 从垂直分布而言,浮游植物种类数均相差不大,种类组成均以硅藻门为主.
由图5a可知,浮游植物的总丰度从表层0.5 m至水下50 m呈现先增加,在20 m深处达到最大值1.14×106cells/L,之后随着深度的下降逐渐减少,并在50 m处达到最低值(5.83×105cells/L). 通过各门浮游植物丰度的比较可知,在垂直分布上各点位以硅藻门为主,其丰度占浮游植物总丰度的94.94%~97.01%. 变化趋势同浮游植物总丰度较为一致,在水深20 m处占比达到最高,在水深30 m处占比最低.
浮游植物生物量的垂直分布与丰度变化有明显差异(图5b),在水深0.5 m处浮游植物生物量达到最高,为0.34 mg/L,主要由甲藻门和硅藻门的种类组成. 从水深5~50 m呈现先增加后减少的趋势,在水深15 m和水深20 m达到峰值,均为0.29 mg/L,最低值在水深50 m为0.14 mg/L. 通过比较垂直分布各点位各门浮游植物生物量的变化可知,硅藻门的变化与总生物量的变化趋于一致,随着水深增加,硅藻门生物量先增加后减少,在水深20 m处达到最大值,0.18 mg/L,在水深50 m处达到最小值(0.10 mg/L). 而甲藻门在水深0.5 m处生物量最大,为0.21 mg/L,然而在水深5 m处生物量骤减,仅有0.04 mg/L,之后随着深度的增加,同样呈现先增加后减少的趋势,在水深15 m处达到峰值0.08 mg/L. 隐藻门的生物量在水深10~30 m比其余深度略高.

图5 长海s8点位浮游植物丰度(a)和生物量(b)的垂直变化
2.3 浮游植物优势种
将优势度大于0.02的定为优势种. 以丰度计算优势种时(表1),长海小环藻(Cyclotellachanghai)为主要优势种,在各点位平均相对丰度为77.26%. 在水平分布上,长海各点位的浮游植物丰度主要由长海小环藻组成(图6),各点位相差不大,其中s12点位长海小环藻相对丰度最高为84.71%,s6点位最低为69.85%.
以生物量计算优势种时(表2),飞燕角甲藻(Ceratiumhirundinella)的优势度最大为0.50,其次为长海小环藻,为0.28. 由图7可知,飞燕角甲藻和长海小环藻的相对生物量之和占浮游植物总生物量的近80%,其中飞燕角甲藻的平均相对生物量为49%,长海小环藻的平均相对生物量为29.86%. 从相对生物量的水平分布上来看,各点生物量的组成相差不大,均是由飞燕角甲藻和长海小环藻贡献,其中且除s12点位外,飞燕角甲藻在各位点的生物量均大于长海小环藻.

表1 长海浮游植物优势种(丰度)

表2 长海浮游植物优势种(生物量)
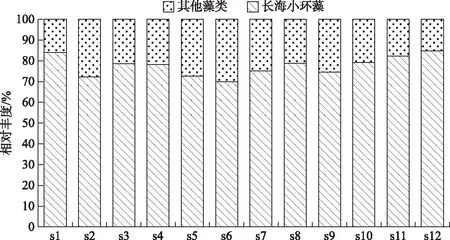
图6 长海小环藻和其他藻类相对丰度的水平分布

图7 飞燕角甲藻、长海小环藻和其他藻类相对生物量的水平分布
优势种的差异主要是由飞燕角甲藻体积系数较大数造成,虽然飞燕角甲藻在各点位的平均丰度较低,其丰度大小不到长海小环藻的1/100,但是飞燕角甲藻的体积系数大约是长海小环藻的313倍. 故在计算长海浮游植物优势种的时候考虑了丰度和生物量两种参数.
2.4 浮游植物多样性及水质评价
长海水质评价的方法包括理化参数评价和生物评价两种方法.
采用单项的水体理化因子对水质状况进行评价,包括TN、TP和DO. 长海水平各点位水体理化数据见表3,TN浓度范围为0.21~0.66 mg/L,平均值为0.40 mg/L;TP浓度范围为0.01~0.03 mg/L;DO浓度范围为7.36~9.82 mg/L,平均值8.68 mg/L. 根据地表水环境质量标准[39]进行水质状况评价可知,通过TN进行水质评价,大部分点位和平均值均显示长海水体应属于Ⅱ类水体,s8和s10点位偏向于Ⅲ类水体;通过TP进行水质评价,大部分点位和平均值均显示长海水体应属于Ⅰ类水体,s2点位偏向于Ⅱ类水体;通过DO进行水质评价,大部分点位和平均值均显示长海水体应属于Ⅰ类水体,s1和s7点位偏向于Ⅱ类水体(表4).
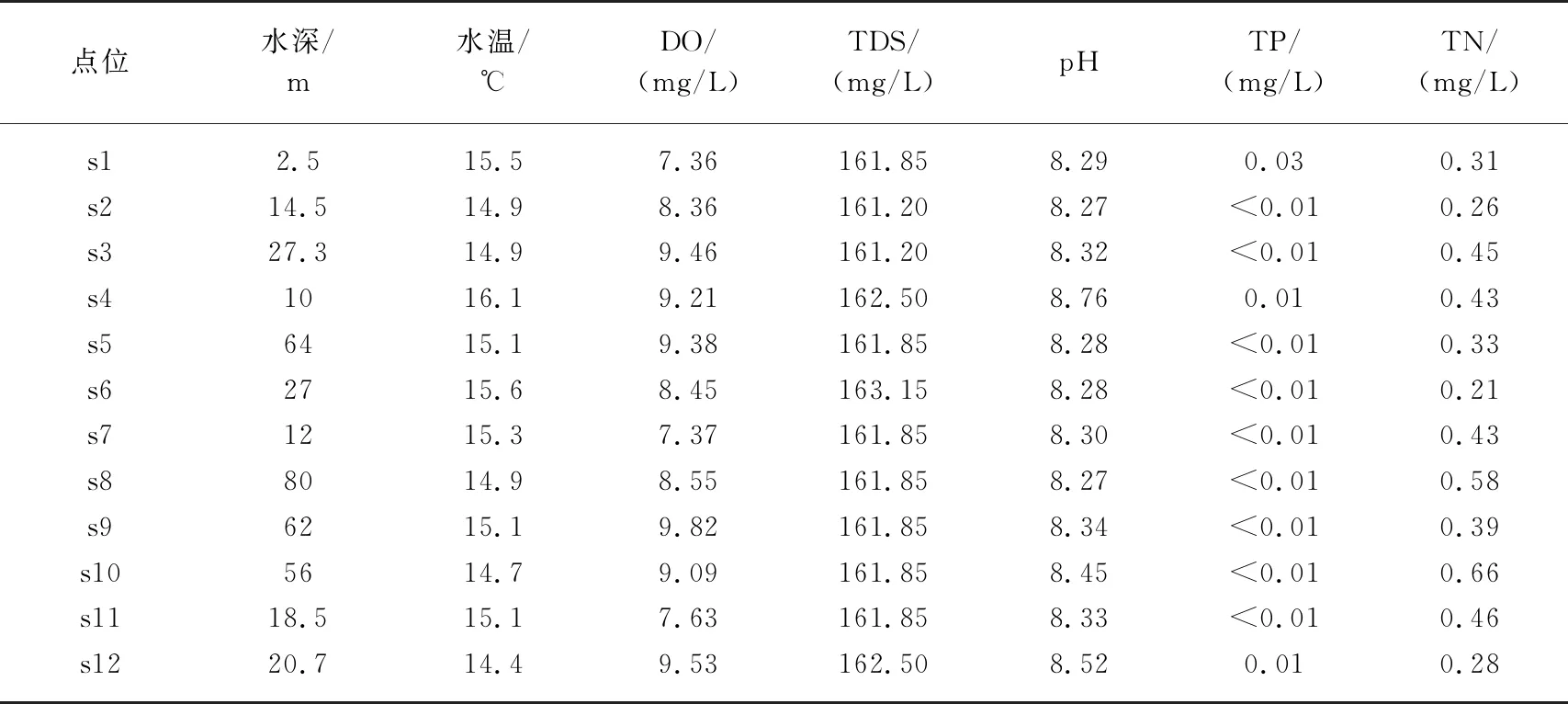
表3 长海各点位水体理化数据
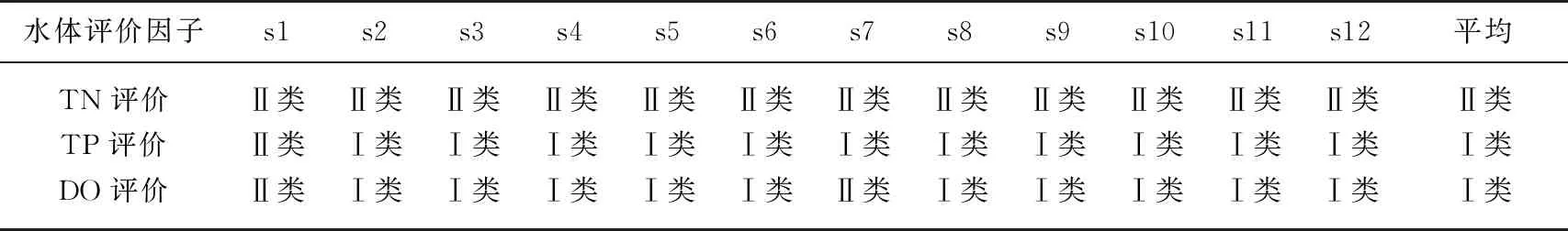
表4 长海水体理化因子水质评价
长海水质的生物参数评价主要包括浮游植物丰度、生物量、优势种和多样性指数.
长海浮游植物丰度为4.19×105~9.80×105cells/L,平均丰度为6.98×105cells/L,属于中营养型湖泊;长海浮游植物生物量为0.19~0.52 mg/L,平均生物量为0.31 mg/L,属于贫营养型湖泊.
通过与近似种Cyclotellacomensis、Cyclotellapseudocomensis和Cyclotellacostei[40]的生境和现场、后期理化监测数据比较发现,长海小环藻与上述形态近似种均属于生长在贫-中营养环境的浮游硅藻;其他优势种Cyclotelladistinguenda隶属小环藻属,世界广泛分布种,浮游硅藻主要生长在碱性水体;Cyclotellacretica隶属小环藻属,浮游硅藻,目前只在希腊克里特岛发现;Lindaviaradiosa(浮游硅藻),多出现在贫-中营养的高山湖泊;飞燕角甲藻,甲藻门浮游植物,浮游藻类,广泛分布种类,多出现在中营养且静止的水体[41].
浮游植物Shannon-Wiener多样性指数H′值范围为1.11~1.76,平均值为1.44,属于重污染;Margalef多样性指数d值范围为1.06~1.85,平均值为1.38,属于α-中污-重污染;Pielou均匀度指数e值范围为0.06~0.09,平均值为0.07,属于重污染(图8).
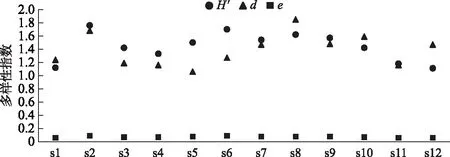
图8 长海浮游植物多样性指数分布
3 讨论
3.1 长海浮游植物群落水平分布特征
长海的浮游植物种类数只有63种,与洱海192种[42]、泸沽湖146种[43],抚仙湖151种[44]、滇池97种[45]、长白山圆池92种[46]相比较少,与意大利伊塞奥湖59种[47]相差不大,可能与长海的高海拔、湖泊面积小、水深较深有关. 在夏季的高山湖泊中,当温度和光照达到了非限制水平的时候,浮游植物的生长受到营养水平的限制[48-49]. 在贫-中营养型湖泊中,硅藻通常在浮游植物总丰度中占有最高的比例[50]. 在阿尔卑斯山48个湖泊中,硅藻门占了总生物量的50%以上[51]. 长海的浮游植物种类组成也是以硅藻门为主. 长海浮游植物丰度主要是受到长海小环藻丰度变化的影响,主要是因为长海水温和营养水平较低,按地表水标准属于Ⅰ~Ⅱ类水体,而长海小环藻相比于小环藻属的其他种类体积更小(7~11 μm),有较高的体积和面积比,能够更好地适应低温低营养环境. Garibaldi等[47]在1998-2000年间对伊塞奥湖浮游植物群落调查中也发现,小环藻在夏季优先生长,这得益于其体积小,沉降速率较低,与其他大型硅藻相比有较高的竞争二氧化硅的能力. 长海浮游植物的生物量由长海小环藻和飞燕角甲藻的共同影响,长海小环藻丰度较高而飞燕角甲藻的细胞体积相对较大.
因为长海处于则查洼沟的中部,只有一处面积较小的观景走廊,游客人流量和人为活动较小,是一个受人为干扰少、换水周期较长的高山冷水湖泊,所以其浮游植物丰度和生物量主要是由湖泊自身结构影响,受到光照、温度、深度和水体流动性的影响,从而造成了水平分布上浮游植物丰度和生物量的变化[48]. 浮游植物总丰度和生物量均显示沿入水口到出水口的方向逐渐增多,而靠近入水口的区域水体搅动性较大,不如近湖心区水体稳定,更适合长海小环藻和飞燕角甲藻生长;部分沿岸点位如s4的浮游植物丰度和生物量较大,主要因为靠近沿岸区,深度较浅,更容易受光和到来自沿岸区营养盐的影响[52].
3.2 长海浮游植物群落垂直分布特征
浮游植物的垂直分布的差异主要是因为沉降(没有运动能力且丰度比水大的藻类,例如硅藻)、漂浮(例如蓝藻的伪空胞)、鞭毛藻类的迁移,而水体透明度、光强度、水流、水体搅动和水温等理化因素也影响了浮游植物的垂直分布. 贡献了80%浮游植物丰度的长海小环藻是一种无鞭毛藻且密度大于水的藻类,随着水温的升高沉降速度加快. 但长海海拔高近3000 m,光强度较大,水体本身透明度高,表层高强度的光照和较高的水温会抑制长海小环藻的繁殖,随着深度增加,光强度和水温降低,水深15 m是长海小环藻最适的生长区域,而随着深度的下降生长率又逐渐降低[48]. 故浮游植物丰度变化呈现先增加后减小的趋势. 潘继征[53]等对抚仙湖的研究也表明,在深水湖泊,水体混合交换弱,会形成浮游植物上下分布明显差异,浮游植物主要分布在0~30 m水层,而且随着水深增加呈现递减趋势.
长海浮游植物生物量沿垂直方向的变化主要受到飞燕角甲藻生物量和长海小环藻生物量的共同影响. 飞燕角甲藻具有鞭毛,有自主迁移的能力,对水温和光强的要求比硅藻门要高,所以在水深0.5 m时,飞燕角甲藻的生物量达到最大值,随着水深增加,光照和水温降低,飞燕角甲藻的生物量也逐渐减少. 而小环藻生物量在垂直方向上呈现先增大后减小的趋势,并在15~20 m时达到其最大值. 因此可以说明光照和水温影响着长海浮游植物群落的组成、丰度和生物量的变化.
3.3 长海浮游植物多样性及水质状况
一般来讲,多样性指数越高,群落结构越稳定,水质状况也越好[21]. 但是长海的多样性指数和均匀度指数的评价显示水体呈重污染水平,而单因素理化指标显示长海水体属于Ⅰ~Ⅱ类水体,与生物评价中的优势种评价、生物量评价和丰度评价中的中-贫营养型水体结果是一致的,也与长海水环境现状相一致. 不同的水质评价指标显示出不同,甚至矛盾的评价结果[54]. 而在抚仙湖等高山湖泊中,多样性评价能够较好地评价水体状况. 如吉正元等[55]使用Shannon-Wiener多样性指数、Pielou均匀度和细胞密度这3项指标对抚仙湖水质进行了评价,显示抚仙湖水质为轻污染、贫中营养类型. 张俊芳等[56]综合Shannon-Wiener多样性指数、Pielou均匀度、Margalef多样性指数、Simpson多样性指数对山西宁武亚高山湖评价水体状况显示为轻污染. 长海浮游植物多样性指数评价显示为重污染,是因为长海的水温较低,平均水温在15℃,水体滞留时间较长,水域面积较大,人为干扰少,使得长海小环藻和飞燕角甲藻在丰度和生物量上占据了绝对优势,从而减少了多样性和均匀度. 在使用多样性判断水质状况时,应该了解影响该水体生物多样性的因素,然后再综合环境因子等其他指标分析和比较[57-58]. 因此,多样性评价不适合长海的水质评价,而应该参考水体理化因子评价与生物评价中的指示种评价以及生物量及丰度的评价结果. 虽然长海水质状况目前较好,但仍需对其加强重视,强化监管力度,控制游客数量,减少人为干扰,最大程度减少旅游开发对于环境的不利影响,实现生态旅游的可持续发展.
4 结论
1)长海共发现浮游植物6门38属63种,以硅藻门为主. 浮游植物平均丰度为6.98×105cells/L,平均生物量为0.31 mg/L.
2)在垂直分布上,从表层0.5 m至水下50 m浮游植物丰度呈现先增加后减少的趋势,在20 m水深处达到最大值. 生物量在0.5 m水深处最高,主要由甲藻门和硅藻门组成,之后随着深度先增加后减少.
3)长海的主要优势种是长海小环藻和飞燕角甲藻. 长海小环藻数量较多,飞燕角甲藻生物量较大.
4)长海浮游植物多样性指数较低,与水体现状和优势种评价结果不一致,说明长海的水质评价应该参考水体理化因子评价与生物评价中的指示种评价以及生物量及丰度的评价结果. 综合各种评价标准,可以得出,长海属于Ⅰ~Ⅱ类水体,处于贫-中营养水平.
致谢:感谢九寨沟国家级自然保护区管理局在采样中给予的帮助与支持,感谢美国波特兰州立大学潘仰东教授在研究中给予的意见和建议.
