miR-124-3p靶向调控MAPK 14对子痫前期大鼠胎盘滋养层细胞增殖及侵袭的影响
2020-07-17周俏苗汪洪林黄海燕许晶肖美芳龚护民吴栋才
周俏苗汪洪林黄海燕许 晶肖美芳龚护民吴栋才
(1.海南省妇女儿童医学中心,海口 570000;2.海南省人民医院妇产科,海口 570000)
子痫前期是妊娠期特有的疾病,据报道,子痫前期的全球发病率为2%~8%,约占全世界所有孕产妇死亡人数的14%,孕产妇和围产儿死亡的主要原因之一[1-2]。子痫前期一般发生于孕20周后,起源于胎盘,其特征在于高血压伴随母体或胎儿肾、肝、脑、心等多器官系统损害[3-4]。
目前关于子痫前期的主要发病机制并不清楚,早期多数学者认为早发型重度子痫前期的发病根源为胎盘[5]。胎盘在进化中形成了很强的侵袭能力,胎盘最重要的细胞是滋养层细胞[6]。滋养细胞是胎盘绒毛的特化细胞,在调节胚胎发育中起着至关重要的作用,特别在胎盘植入的孕妇中滋养细胞具有高度增殖和侵袭性[7]。微小RNA(miRNA)是近年来的研究热点,到目前为止人类中大约有2000多种成熟miRNA被发现[8]。最新研究发现,miRNA在人类胎盘组织中的表达可影响滋养细胞的侵袭和增殖等生物学功能,从而影响胎盘的正常发育[9]。比如,Zhu等[10]研究发现,低表达的miR-18a可能通过对其靶基因的调节而参子痫前期过程。陈静等[11]人发现miR-155可以通过下调CYR61而参与子痫前期的发病过程。miR-124家族最早是Mishima等[12]于2007年从小鼠大脑中提取出来,主要包括miR-124-1、miR-124-2、miR-124-3三个亚型。近年更是发现,miR-124在肿瘤的形成过程中发挥重要的作用,可通过靶向基因调控细胞的增殖和侵袭[13]。而在本研究中,我们将探讨miR-124-3p与子痫前期的调控机制。子痫前期的发病机制不是任何单个分子的作用,miRNA通过靶向基因参与滋养细胞侵袭障碍、促进血管内皮损伤等病理过程,促进子痫前期的发生与发展[14]。p38丝裂原活化蛋白激酶(p38MAPK)信号通路可以影响细胞的增殖、分化与凋亡等系列细胞过程,根据目前研究表明,p38MAPK蛋白家族包括 p38α(即 MAPK 14)、p38β、p38γ 和 p38δ 4 种异构体亚型[15]。 最新研究发现,p38MAPK参与子痫前期的发病[16]。在本研究中,我们将进一步探讨miR-124-3p与 MAPK 14对子痫前期胎盘滋养层细胞的增殖与侵袭产生影响,希望为子痫前期的治疗提供新思路。
1 材料和方法
1.1 实验材料
1.1.1 实验动物
成年的SPF级SD大鼠(20只雌性、10只雄性)购买于湖南省斯莱克景达实验动物公司[SCXK(湘)2016-0004],月龄 2~3个月,体重 200~220 g。无菌手术在海南省人民医院实验设施进行[SYXK(琼)2017-0011]。实验获我院伦理委员会审批[2017]7号文件(201707),并按实验动物使用的3R原则给予人道的关怀。
1.1.2 细胞
HEK293T细胞购自中科院上海细胞库。
1.2 主要试剂与仪器
lipofectamin 2000试剂盒购自美国Invitrogen公司;miR-124-3p的模拟物及对照均购买于Invitrogen;MAPK 14-wt质粒、MAPK 14-mut质粒由广州锐博生物科技公司合成;Dual-Luciferase Peporter Assay System购自美国Promega公司;实验所用引物均由上海吉玛制药技术有限公司提供;BCA购自美国Thermo Fisher公司;本研究所用抗体均购自英国Abcam公司;细胞凋亡试剂盒购自美国R&d Systems公司;Matrigel胶购买于美国BD公司。
倒置显微镜、CO2培养箱购自OLYMPUS奥林巴斯公司。
1.3 实验方法
1.3.1 动物模型建立及滋养层细胞的提取
置于恒温恒湿环境中分笼饲养,自由采食饮水,适应一周。雌性与雄性按2∶1合笼,第2天早上进行分泌物涂片镜检,发现精子则定为妊娠期第1天。将孕鼠随机分为正常组与模型组,妊娠第10天开始,模型组皮下注射L-NAME 100 mg/(kg·d),正常组注射相同浓度的生理盐水,至第18天,检测平均尾动脉收缩压达到(110.12±5.73)mm/Hg,尿蛋白达到(6.33±0.42)mg/24 h,则视为造模成功。
剖宫产后处死母鼠,取出胎盘,分离出绒毛膜滋养层组织。剪成厚度在3 mm左右的薄片,37℃水浴下用0.25%的胰酶消化3次,每次10 min。3000 r/min离心5 min去沉淀,得到细胞悬液,PBS洗涤2次,用含10%FBS的DMEM/F12重悬细胞,接种于培养板中,在37℃、5%CO2的培养箱中培养。倒置显微镜下观察可见上皮样细胞形态,呈板层状生长。鉴定为无杂质滋养层细胞后,在37℃、5%CO2培养箱中进一步培养。细胞传代后,用第三代细胞滋养细胞转染。
1.3.2 细胞转染
本实验分两组进行转染,第一组:Control组(正常对照组)、NC组(子痫前期大鼠滋养层细胞转染阴性对照组)、miR-124-3pmimic组(子痫前期细胞转染miR-124-3p过表达组)、miR-26b-3pinhibitor组(子痫前期大鼠滋养层细胞转染miR-26b-3p抑制物组)。第二组:NC组(子痫前期大鼠滋养层细胞转染MAPK 14转染阴性对照)、si-MAPK 14组(子痫前期大鼠滋养层细胞转染MAPK 14干扰组)、oe-MAPK 14组(子痫前期细胞转染MAPK 14过表达)。
本实验使用lipofectamin 2000(Invitrogen)试剂盒进行转染,转染序列、目的质粒均于上海吉玛生物公司合成并购买。按照转染试剂说明书操作如下:用250μL无血清Opti-MEM(Gibco,美国)培养基分别稀释5μg目的质粒和5μL Lipofectamine 2000,轻弹混匀。室温静置5 min,两者混合均匀,放置20 min后将100μL混合液加到培养孔中,来回轻柔摇晃细胞培养板,置于37℃、5%CO2培养箱中培养继续培养6~8 h后换成完全培养基培养24 h后再用于后续实验。
1.3.3 双荧光素酶报告实验
生信网站Target Scan分析确认miR-124-3p与MAPK 14存在结合位点,接着用双荧光素酶报告实验验证miR-124-3p与MAPK 14的靶向调节调节作用。HEK293T细胞接种至24孔板,培养24 h,用脂质体转染法将MAPK 14-wt质粒和MAPK 14-mut质粒分别和miR-124-3pmimic与 miR-NC转染至HEK293T细胞内,转染48 h后收集细胞,根据Dual-Luciferase Peporter Assay System说明书指示(E1910,Promega,美国)检测萤火虫荧光素酶活性,以萤火虫荧光素酶活性/海肾荧光素酶活性作为相对值进行统计分析。
1.3.4 qRT-PCR检测相关基因的表达
首先采用经典的TRIzol(Invitrogen,美国)提取总RNA,紫外分光光度计测定OD260/OD280以及总RNA浓度。Primer Script TMRT reagent Kit将1μg总RNA反转录反应获得cDNA。采用实时荧光定量PCR检测相关基因的表达。反应条件为:95℃进行2 min初始变性,随后在95℃变性15 s,60℃退火30 s,最后68℃延伸1 min,扩增35个循环。基因的相对表达量根据 2-△△Ct公式计算,GAPDH作为MAPK 14的内参基因,U6作为miR-124-3p的内源性对照。反应中所用的引物如表1所示。

表1 qRT-PCR引物序列表Table 1 Primer sequence of qRT-PCR
1.3.5 Western blot检测相关蛋白的表达
PBS洗涤2次,加入细胞裂解液,冰上裂解10 min。将裂解后的蛋白吸入EP管内,BCA测蛋白浓度(Thermo Fisher,美国)。 5×Loading Buffer混合煮沸5 min后进行SDS-PAGE凝胶电泳。电泳完成后将蛋白转移至PVDF膜上,含5%BSA的TBST室温摇床封闭1 h,TBST洗涤一遍后加入一抗(购买于Abcam公司)包括:MMP-2兔多克隆抗体(1∶2000,ab92536),MMP-9兔单克隆抗体(1∶10000,ab76003),GAPDH兔单克隆抗体(1∶10000,ab181602),4℃振荡过夜,TBST摇床洗涤3遍,每次15 min。山羊抗兔二抗(ab205718,Abcam)孵育1 h,TBST摇床洗涤3次,每次15 min。将膜上液体沥干后轻轻放于保鲜膜上,加入ECL发光液,反应1 min。保鲜膜将 PVDF膜封住,X光胶片曝光。Image J进行灰度扫描,GAPDH为内参进行,用目标条带与GAPDH条带的灰度值比值来表示相对蛋白表达量。
1.3.6 MTT检测细胞增殖
转染24 h后,取对数生长期细胞接种于96孔板(每毫升1×105个细胞),每组6个复孔,培养24、48、72 h后,每孔加入10μL MTT溶液(5 mg/mL,购买于上海碧云天生物公司),再于37℃、5%CO2培养箱中孵育4 h,酶标仪测定570 nm处吸光度。
1.3.7 流式检测细胞凋亡与周期
各组细胞转染48 h后,用0.25%的胰酶消化收集细胞,PBS洗涤2次。按细胞凋亡试剂盒操作,细胞记数,调整细胞浓度为1×105/mL,用80μL的平衡试剂重悬,接着加入10μL的Annexin V-FITC(10 μg/mL)及10μL的PI(5μg/mL),混匀后室温孵育15 min,再加入400μL的缓冲液,于流式细胞仪检测细胞凋亡情况。
同上收集细胞,PBS洗涤2次,3000 r/min离心5 min。取1 mL细胞悬液(细胞浓度约为5×105/mL),离心后用预冷是75%乙醇固定2 h。PBS洗涤1次,细胞筛网过滤一次去细胞团,离心后按说明书(BD,美国)指示,再加入500μL的RNase/PI染色液混匀,室温避光孵育15 min。上机前4℃保存,于流式细胞仪检测细胞周期。
1.3.8 Transwell检测细胞侵袭
孔径为8μm的Transwell板购买于美国康宁。各组细胞转染后,胰酶常规消化,1000 r/min离心5 min,PBS洗涤两遍。将100μL含有2×104个细胞的悬液接种于预涂有基质凝胶的上室(侵袭实验前先将100μL稀释好的Matrigel胶加入上室中,室温过夜处理)。下室加入500μL完全培养基后置于培养箱内24 h。取出Transwell上室,用棉签棒擦去滤膜上层胶以及细胞,用70%的甲醛快速固定10 min,0.02%结晶紫染色5 min,蒸馏水洗涤2次。随机取5个视野,显微观察染色细胞数拍照并计算平均值。

图1 miR-124-3p在正常大鼠与子痫前期大鼠胎盘滋养层细胞中的表达Note.Compared with Normal group,*P<0.05.Figure 1 Expression of miR-124-3p in placenta of normal and preeclampsia rats
1.4 统计学方法
所有数据均用SPSS 21.0统计软件(IBM公司,美国)处理。计量资料以平均数±标准差(±s)表示。两组间比较用t检验,多组间比较采用单因素方差分析(ANOVA),以P<0.05为差异有统计学意义。
2 结果
2.1 miR-124-3p在子痫前期大鼠胎盘滋养层细胞表达
为研究miR-124-3p在子痫前期大鼠胎盘滋养层细胞表达,qRT-PCR检测miR-124-3p在正常大鼠胎盘滋养层细胞及子痫前期大鼠胎盘滋养层细胞的表达(图1),结果显示:与正常大鼠胎盘滋养层细胞相比,子痫前期大鼠胎盘滋养层细胞中miR-124-3p表达明显增加(P<0.05)。
2.2 miR-124-3p可影响子痫前期大鼠胎盘滋养层细胞增殖

图2 过表达或抑制miR-124-3p后子痫前期大鼠胎盘滋养层细胞的增殖情况Note.Compared with Control group,*P<0.05.Compared with NC group,#P<0.05.Compared with miR-124-3p mimic,&P<0.05.Figure 2 Proliferation of placental trophoblast cells in preeclampsia rats after overexpression or inhibition of miR-124-3p
在子痫前期大鼠胎盘滋养层细胞中转染miR-124-3pmimic及miR-124-3pinhibitoor,MTT检测各组细胞增殖情况(图2),结果发现,与正常大鼠滋养层细胞Control组相比,其余各组子痫前期大鼠滋养层细胞增殖能力明显降低;同NC组相比,miR-124-3pmimic组细胞增殖能力明显降低,miR-124-3pinhibitor组增殖能力明显增强(均P<0.05)。
2.3 miR-124-3p可影响子痫前期大鼠胎盘滋养层细胞周期与凋亡
流式检测细胞周期(图3A、3B),结果发现,与Control组相比,其余各组细胞G1/G0期细胞的比例明显上升;与NC组相比,miR-124-3pmimic组G1/G0期细胞的比例明显上升(P<0.05);miR-26b-3pinhibitor组 G1/G0期细胞的比例明显下降(P<0.05)。
流式细胞术检测细胞凋亡结果显示(图3C、3D),结果发现,与Control组相比,其余各组细胞凋亡明显增加;同NC组相比,miR-124-3pmimic组细胞凋亡明显增加,miR-124-3pinhibitor组凋亡明显降低(均P<0.05)。
2.4 miR-124-3p对子痫前期大鼠胎盘滋养层细胞侵袭及相关因子的影响
Transwell分析检测转染后细胞的侵袭能力(图4A、4B)。结果显示:与Control相比,其余各组细胞侵袭能力均显著降低;与NC组相比,miR-124-3pmimic组细胞侵袭能力显著降低,miR-124-3pinhibitor组细胞侵袭能力显著增加(P<0.05)。
Western blot检测侵袭相关因子 MMP-2及MMP-9的蛋白表达(图4C),结果发现,与Transwell侵袭能力结果一致。与 Control相比,其余各组MMP-2及MMP-9表达均显著降低;与NC组相比,miR-124-3pmimic组MMP-2及MMP-9表达显著下调,miR-124-3pinhibitor组MMP-2及MMP-9表达显著上调(P<0.05)。
2.5 MAPK 14在子痫前期大鼠胎盘滋养层细胞中低表达,且miR-124-3p靶向负调控MAPK 14
qRT-PCR检测MAPK 14在正常大鼠胎盘滋养层细胞及子痫前期大鼠胎盘滋养层细胞的表达(图5A),结果显示:与正常大鼠胎盘组织相比,子痫前期大鼠胎盘滋养层细胞中MAPK 14表达明显下调(P<0.05)。
网站分析发现miR-124-3p与MAPK 14存在结合位点(图5B)。双荧光素酶报告检测发现(图5C),与NC组相比,miR-124-3p与野生型MAPK 14-wt共转染组中荧光素酶活性强度明显下降(P<0.05),与突变型MAPK 14-mut共转染组的荧光素酶活性强度无明显差异。
2.6 干扰/过表达MAPK 14对子痫前期大鼠胎盘滋养层细胞增殖与迁移的影响
在子痫前期大鼠胎盘滋养层细胞中转染si-MAPK 14及过表达MAPK 14,MTT检测各组细胞增殖情况(图6A),结果发现,同NC组相比,si-MAPK 14组细胞增殖能力明显降低,oe-MAPK 14组增殖能力明显增强(均P<0.05)。
流式检测细胞凋亡(图6B),结果发现,同NC组相比,si-MAPK 14组细胞凋亡明显率上升,oe-MAPK 14组细胞凋亡率明显下降(均P<0.05)。
Transwell检测细胞侵袭能力(图6C),结果发现同NC组相比,si-MAPK 14组细胞侵袭能力明显率下降,oe-MAPK 14组细胞侵袭能力明显上升(均P<0.05)。
综上结果可知,干扰/过表达MAPK 14可模拟miR-124-3pmimic或miR-26b-3pinhibitor的实验结果。
3 讨论
胎盘是胎儿和母体环境重要的交换界面,胎盘最重要的细胞是滋养层细胞。但其发育和侵袭过程受到时间和空间的严格精细调控,对其调节失控会导致各种疾病,包括子痫前期[17]。
近年来,miRNA在子痫前期发病过程中发挥的作用成为研究热点,越来越多的研究表明,miRNA参与调控子痫前期的疾病进程[18]。通过Meta分析,有学者发现子痫前期患者胎盘组织中差异性表达的miRNA至少有20个,其中11个呈现低表达,9个高表达[9]。刘文娟等[19]进一步发现,子痫前期组胎盘组织中miR-27b的表达水平高于对照组,且重度子痫前期组胎盘组织的miR-27b的表达水平高于轻度子痫前期组。这与本研究结果类似,本研究也发现,与正常大鼠胎盘组织相比,子痫前期大鼠胎盘组织中miR-124-3p表达明显增加。

图3 流式检测细胞周期及细胞凋亡Note.A、B,Cell cycle flow cytometry results and analysis.C、D,Cell apoptosis flow cytometry and results analysis.Compared with Control group,*P<0.05.Compared with NC group,#P<0.05.Compared with miR-124-3p mimic,&P<0.05.Figure 3 Flow cytometry for cell cycle and apoptosis

图4 子痫前期大鼠胎盘滋养层细胞侵袭情况及相关因子的表达Note.A、B,Transwell analysis was used to detect the invasiveness of trophoblast cells after transfection.C,The expression of MMP-2 and MMP-9 were detected by Western blot.Compared with Control group,*P<0.05.Compared with NC group,#P<0.05.Compared with miR-124-3p mimic,&P<0.05.Figure 4 Invasion of placental trophoblasts and expression of related factors in preeclampsia rats
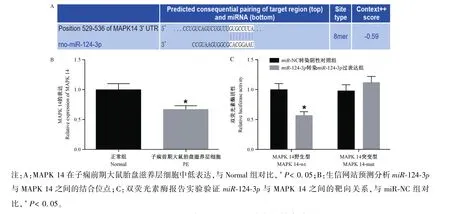
图5 miR-124-3p与MAPK 14具有靶向结合关系Note.A,MAPK 14 was low expressed in placental trophoblast cells of preeclampsia rats.Compared with Normal group,*P<0.05.B,The binding sites between miR-124-3p and MAPK 14 were predicted and analyzed by the website.C,The target relationship between miR-124-3p and MAPK 14 was verified by the double Luciferase Report experiment.Compared with miR-NC group,*P<0.05.Figure 5 miR-124-3p has a targeted binding relationship with MAPK 14

图6 干扰/过表达MAPK 14对子痫前期大鼠胎盘滋养层细胞增殖与迁移的影响Note.A,MTT was used to detect the proliferation of cells in each group after overexpression/interference of MAPK 14.B,Flow cytometry was used to detect the apoptosis of cells in each group and the statistical analysis chart.C,Transwell was used to detect the invasiveness in microphotography and result analysis.Compared with NCgroup,*P<0.05.Compared with si-MAPK 14 group,#P<0.05.Figure 6 Effect of interference/overexpression of MAPK 14 on proliferation and migration of placental trophoblasts in preeclampsia rats
miRNA通过结合靶基因 mRNA的3′UTR直接调控蛋白质的翻译表达,调控细胞的增殖、侵袭、凋亡等生物学过程[20]。在本实验中,网站分析发现miR-124-3p与MAPK 14存在结合位点,且MAPK 14在子痫前期大鼠胎盘滋养层细胞中低表达,miR-124-3p靶向负调控MAPK 14。过往研究证实,miR-124-3p是脑组织中表达最为丰富的miRNA,其表达失调与肿瘤发生有关[21]。由于滋养层细胞增殖、侵袭等生物学功能与肿瘤细胞有极大的相似性,因此推测miR-124-3p可通过靶向基因影响滋养层细胞的增殖、侵袭等功能。
滋养层细胞可分化成具有类似肿瘤细胞的高侵袭能力的绒毛外滋养层细胞,其具有的侵袭性可侵入子宫内膜将胎盘锚定在子宫,协助胎盘重铸血管,为胎儿发育提供必需的营养物质和氧气,保证胎儿的正常发育和生长[22]。而子痫前期与miRNA的作用机制在于通过靶基因参与妊娠滋养细胞的增殖和侵袭,具体来说参与滋养细胞侵袭障碍以及调节血管生成因子,促进血管内皮损伤[23]。比如之前研究发现,miR-210通过抑制其靶分子-受体酪氨酸激酶配体(EFNA3)和 HOMEOBOX-19的表达,降低滋养细胞侵袭性,抑制滋养细胞的迁移和浸润[24]。过往众多研究已证实了p38MAPK在子痫前期的作用[25-26],氧化应激产物,激活p38MAPK的磷酸化,还可以通过调节钙离子泵,使血管内皮细胞内钙离子浓度超负荷,导致血管平衡紊乱,引发内皮细胞损伤和功能障碍,影响胎盘浅着床,导致重度子痫前期的发生[27-28]。在本次研究中,我们进一步发现,miR-124-3p可靶向负调控MAPK 14,对子痫前期大鼠胎盘滋养层细胞的增殖与侵袭产生影响。
综上所述,miR-124-3p在子痫前期大鼠胎盘组织中高表达,MAPK 14低表达。miR-124-3p可靶向负调控MAPK 14,对子痫前期大鼠胎盘滋养层细胞的增殖与侵袭产生影响。不过子痫前期的病因复杂,可能与血管、遗传、胎盘缺血缺氧、免疫或环境等多种因素参有关,本文仅从胎盘角度揭示子痫前期的发生发展,未来希望可从其他角度进行探索,进一步为子痫前期的预防与治疗提供思路。
