透明细胞肾癌裸鼠模型构建及靶向药物敏感性研究
2020-07-17永李晓娟姜棋予张鹏冯帆李瑞生
魏 永李晓娟姜棋予张 鹏冯 帆李瑞生*王 科*
(1.青岛大学附属医院,泌尿外科,青岛 266000;2.中国人民解放军海军第971医院,泌尿外科,青岛 266071;3.中国人民解放军总医院第五医学中心,临床研究管理中心,北京 100039;4.中国人民解放军总医院第一医学中心,泌尿外科,北京 100853)
肾癌是一种常见的泌尿系统肿瘤,其最为主要的病理类型是肾细胞癌(renal cell carcinoma,RCC)[1],其中透明细胞肾癌(clear renal cell carcinoma,ccRCC)是RCC的主要病理类型,约占RCC发病总数的85%以上[2]。目前,外科手术切除虽然是原发性肾癌的首选方案,但罹患多发弥散肾癌以及肾癌复发的患者难以接受外科手术治疗,总体预后较差[1-2]。对这些患者,分子靶向治疗(服用各种口服小分子蛋白激酶抑制剂)是其主要治疗策略[3-4]。尽管如此,肾癌分子靶向治疗仍存在诸多问题[3-4]:存在个体差异、存在药物耐受(drugresistance)现象、费用昂贵等。因此,研究和建立相关研究模型与研究方法,预测患者对分子靶向药物的敏感性具有重要的理论和实践意义。肾癌相关研究的主要模型包括利用现有的肾癌细胞系(如Caki-1、Caki-2以及786-O)进行体外培养或接种免疫缺陷动物建立肿瘤抑制模型[5]。最近的研究显示,收集肿瘤组织标本,从中分离出单个细胞建立患者来源的细胞系(patients-derived cells,PDCs)具有重要意义[6]:(1)与现有细胞系相比,PDCs更为贴近临床实际;(2)利用PDCs接种免疫缺陷动物能够获得患者来源的肿瘤细胞动物模型(patientderived tumor xenograft model,PDX model),开展相应肿瘤学、肿瘤药理学研究工作;(3)灵活运用PDCs、PDXs等模型能够对患者体内肿瘤细胞对药物的敏感性进行预测。因此,本研究着眼于ccRCC这一最为常见和有代表性获得与制备了5株ccRCC的PDCs,利用这5株PDCs接种建立了PDX模型,检测了这些 PDCs对分子靶向药物舒尼替尼(Sunitinib)、索拉非尼(Sorafenib)、乐伐替尼(Lenvatinib)、瑞戈非尼(Regorafenib)、阿帕替尼(Apatinib)以及安罗替尼(Anlotinib)的敏感性。
1 材料和方法
1.1 实验材料
1.1.1 实验动物
SPF级BALB/c裸鼠,4周龄,体重13~15 g,400只,雌性,均购自北京斯贝福生物科技有限公司[SCXK(京)2016-0002];动物饲养于解放军总医院第五医学中心动物[SYXK(军)2017-0016]。动物饲养环境:温度22℃~25℃,湿度40%,自由进食和饮水。本实验通过了解放军总医院第五医学中心动物伦理委员会审查(IACUC-2017-009)。在实验过程中,严格按实验动物使用的3R原则给予实验动物福利。
1.1.2 细胞系
5例患者来源的ccRCC细胞系、现有肾癌细胞系Caki-1与Caki-2由中国人民解放军总医院第一医学中心泌尿外科张鹏博士惠赐。
1.2 主要试剂与仪器
分子靶向药物:舒尼替尼(Sunitinib,产品编号为S7781)、索拉非尼(Sorafenib,产品编号为S7397)、乐伐替尼(Lenvatinib,产品编号为S4371)、瑞戈非尼(Regorafenib,产品编号为S1178)、阿帕替尼(Apatinib,产品编号 S5248)以及安罗替尼(Anlotinib,产品编号为 S8726)等均购买自美国Selleck公司;细胞/组织样品总RNA提取、反转录(reverse transcription)以及qPCR等试剂盒均为美国ABI公司产品;吸入麻醉剂异氟烷(isoflurane)购买自深圳瑞沃德公司;手术的器械和材料等动物实验常规材料由本实验室保存;实时定量PCR仪(qPCR仪,美国ABI公司,ABi-7500型号)等均由本实验室提供。
1.3 实验方法
1.3.1 分子靶向药物溶液配制
以有机溶剂DMSO、吐温80以及PEG400(国药集团北京公司)充分溶解药物粉末(得到药物母液),使用生理盐水对药物母液进行稀释(通过搅拌和超声震荡等以避免药物析出),最终溶液中的有机溶剂DMSO不超过1‰、吐温80以及PEG400不超过 2‰[7-8]。
1.3.2 定量PCR实验
收集ccRCC细胞样品(包括ccRCC现有细胞系、Caki-1、Caki-2、786-O以及ccRCC 的 PDCs)或肿瘤组织样品(将ccRCC的PDCs接种裸鼠形成皮下肿瘤,再收集皮下肿瘤样品),提取总RNA进行反转录,再进行qPCR实验检测ccRCC细胞中分子靶向药物目的作用靶标(包括各种受体酪氨酸蛋白激酶VEGFR-1、VEGFR-2、VEGFR-3、PDGFR-α、PDGFR-β 以及 c-Kit;以及MAPK、PI3K/AKT信号通路的主要蛋白激酶AKT、ERK-1以及 ERK-2)。qPCR定量方法为SYBR Green 染色法(2-△△CT法),以肌动蛋白β-Actin为参比,依据定量PCR实验中各目标基因的相对表达水平[9-10]。引物序列见表1。
目标基因在ccRCC细胞中的表达水平结果显示为其相对于内参β-Actin的相对表达水平对所得qPCR的数据进行分析:(1)以前述分子靶向药物作用靶标在ccRCC PDCs以及ccRCC细胞系中的表达水平(目标基因相对于内参β-Actin的相对表达水平)分别绘制热图(heatmap);(2)对于ccRCCPDCs,分别检测在经过体外培养后的系列时间点(体外培养1周、培养2周和培养3周)时,ccRCCPDCs中前述分子靶向药物作用靶标的表达量,依据其表达变化(与对照组,未经体外培养的ccRCCPDCs细胞相比,经过体外培养的ccRCCPDCs中基因的表达变化倍数(folds),其中表达增加为正值,表达下降为负值)绘制热图;(3)对于ccRCCPDCs,分别检测在经过体内扩增(通过裸鼠成瘤作用实现体内扩增1次、扩增2次和扩增3次)后,ccRCCPDCs中前述分子靶向药物作用靶标的表达量,依据其表达变化(与对照组,未经体内扩增ccRCCPDCs细胞相比,经过体内扩增的ccRCCPDCs中基因的表达变化倍数(folds),其中表达增加为正值,表达下降为负值)绘制热图。
1.3.3 ccRCC细胞的体外培养及在裸鼠中的扩增
收集得到ccRCC的肿瘤组织(包括肿瘤组织以及少量外科手术切除中连带的癌旁组织),将肿瘤组织和癌旁组织进行分离后,取少许组织(包括肿瘤组织和癌旁组织)做HE染色进行病理分析确证组织标本的特异性,再将所获得的肿瘤组织进行下一步实验。使用钢筛(200目)对所得ccRCC肿瘤组织进行研磨,收集研磨所得的细胞悬液即获得ccRCC的PDCs[11]。对于所获得的ccRCC的PDCs:(1)在液氮中冻存备用;(2)对ccRCC PDCs进行体外培养;(3)将ccRCCPDCs接种裸鼠皮下形成肿瘤组织。体外培养实验:使用添加有 10%FBS的DMEM培养ccRCC细胞Caki-1等或ccRCC PDCs,再收集细胞按照前述方法进行定量PCR检测;裸鼠皮下成瘤实验:制备前述ccRCC PDCs细胞悬液后,使用注射器将ccRCC PDCs细胞悬液接种于裸鼠皮下(每个接种点接种约6×106个细胞,体积约0.3 mL)[12]。3~4周后,ccRCC PDCs能够在裸鼠皮下形成肿瘤组织,剖取肿瘤组织表面性状较好的部分制备为肿瘤组织微块,将组织微块接种于裸鼠皮下,再次形成皮下肿瘤组织,此为利用裸鼠成瘤作用实现1次ccRCC PDCs的体内扩增。在此基础上,收集原始ccRCC PDCs以及经过3次体内扩增后的ccRCC PDCs肿瘤组织中的总RNA样品,依据前述方法进行定量PCR实验。对于患者来源的ccRCC细胞的保存,分别通过:(1)依据前述方法收集获ccRCC肿瘤组织,通过研磨的方法获得ccRCC细胞(I代),直接在液氮中保存作为原始细胞库;(2)将直接从ccRCC组织标本中分离得到的ccRCC细胞(I代)接种裸鼠形成肿瘤组织以实现扩增,再收集裸鼠皮下肿瘤组织研磨以大量的ccRCC细胞(II代),将细胞在液氮冻存保存并进行后续实验。

表1 引物序列Table 1 Sequences of the primers
1.3.4 分子靶向药物对肾肿瘤动物模型的治疗
将前述(1.3.3部分所述)II代的ccRCC PDCs接种裸鼠皮下,接种3~4 d后以口服灌胃给药方式给予裸鼠2 mg/kg的分子靶向药物,每2 d给药一次,经过15次治疗后,收集肿瘤组织标本,使用游标卡尺测量皮下肿瘤的长度与宽度,计算肿瘤体积=肿瘤长轴长度×肿瘤短轴长度×肿瘤短轴长度/2[13]。同时对肿瘤组织进行称重,计算抑制率=(对照组肿瘤体积-药物治疗组肿瘤体积)/对照组肿瘤体积×100%或(对照组肿瘤重量-药物治疗组肿瘤重量)/对照组肿瘤重量×100%。
1.4 统计学方法
2 结果
2.1 ccRCC PDCs的制备及其质量控制
首先获得ccRCC组织标本进行病理学确认(见图1),确定收集的到的肿瘤组织的特异性,再利用ccRCC肿瘤组织制备得到了ccRCC PDCs,在PDCs以及ccRCC细胞系中检测了分子靶向药物的作用靶标(包括系列受体酪氨酸蛋白激酶以及MAPK、PI3K/AKT信号通路的主要蛋白激酶)的表达量。结果显示:分子靶向药物的作用靶标在ccRCCPDCs中的表达量显著高于在ccRCC细胞系中的表达量(见图2)。在此基础上,分别通过体外培养或体内扩增(在裸鼠体内通过成瘤作用实现扩增)的方法对ccRCC PDCs进行扩增,再检测不同扩增方法对分子靶向药物作用靶标的表达水平。结果显示:体外长期培养ccRCC的PDCs(持续培养1周、2周或3周),分子靶向药物的作用靶标表达出现明显下调,而通过裸鼠成瘤作用实现ccRCC PDCs的扩增(通过裸鼠成瘤的方法对ccRCC PDCs实现3次扩增),ccRCC PDCs中分子靶向药物作用靶标的表达能够保持稳定(见图3)。这表明,通过裸鼠成瘤作用实现ccRCC PDCs的扩增能够保持其自身特性的稳定,反映出其在患者体内的特征。
2.2 分子靶向药物对ccRCC PDCs裸鼠成瘤的抑制活性检测
结果显示:分子靶向药物能够抑制ccRCCPDCs细胞在裸鼠皮下的成瘤作用,不同患者来源的PDCs对分子靶向药物的敏感性存在患者的个体差异。进一步,在所选分子靶向药物中,舒尼替尼、索拉非尼、乐伐替尼、瑞戈非尼和安罗替尼对ccRCC PDCs裸鼠成瘤有明确的抗肿瘤活性(见图4和表2),其中乐伐替尼的抗肿瘤活性优于其他几种分子靶向药物(见图4和表2),而阿帕替尼的抗肿瘤活性稍弱(图4,表2)。在上述结果中(图3,图4,表2),图4是所选6种分子靶向药物对其中1株 ccRCC PDCs(2号ccRCC PDCs)在裸鼠皮下成瘤的抑制活性,而图5则显示为ccRCC代表性的分子靶向药物(索拉非尼)对5株ccRCC PDCs在裸鼠中皮下成瘤的抑制活性。表2为所选6种分子靶向药物对5株ccRCC PDCs在裸鼠皮下成瘤的抑制活性(结果显示为药物分别对肿瘤大小与肿瘤体积的抑制率)。
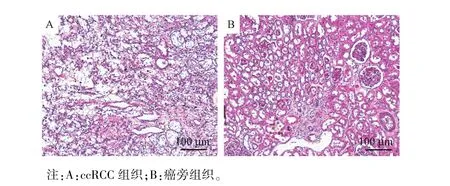
图1 ccRCC组织标本的病理染色结果(HE染色)Note.A,ccRCC tissue.B,aired non-tumor tissue.Figure 1 Pathological staining results of ccRCC tissue specimens(HE staining)

图2 分子靶向药物作用靶标热图Note.Relative to the expression level of internal referenceβ-actin.Figure 2 Thermogram of targets targeted by molecules targeted drugs
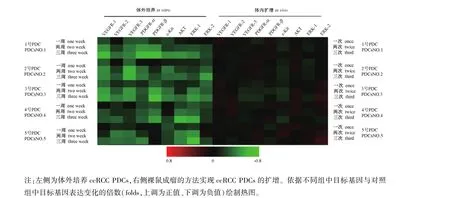
图3 通过体外培养或裸鼠成瘤作用实现ccRCC PDCs的扩增以及不同扩增方法对ccRCC PDCs中分子靶向药物作用靶标表达的影响Note.The left part is amplification of ccRCC PDCs by in vitro culture.The right part is amplification of ccRCC PDCs in nude mice.Heat maps were drawn based on folds of target genes’expression changes in the different groups and control groups(folds,positive up/increasing,down negative/decreasing).Figure 3 Amplification of ccRCCPDCs by in vitro culture or tumor formation in nude mice and the effect of different amplification Methods on target expression of the targets of molecular targeting agents in ccRCC PDCs
表2 分子靶向药物对ccRCCPDCs皮下肿瘤抑制率(±s)Table 2 The inhibitory rates of molecular targeting agents on five lines of ccRCCPDCs’ subcutaneous growth in nude mice
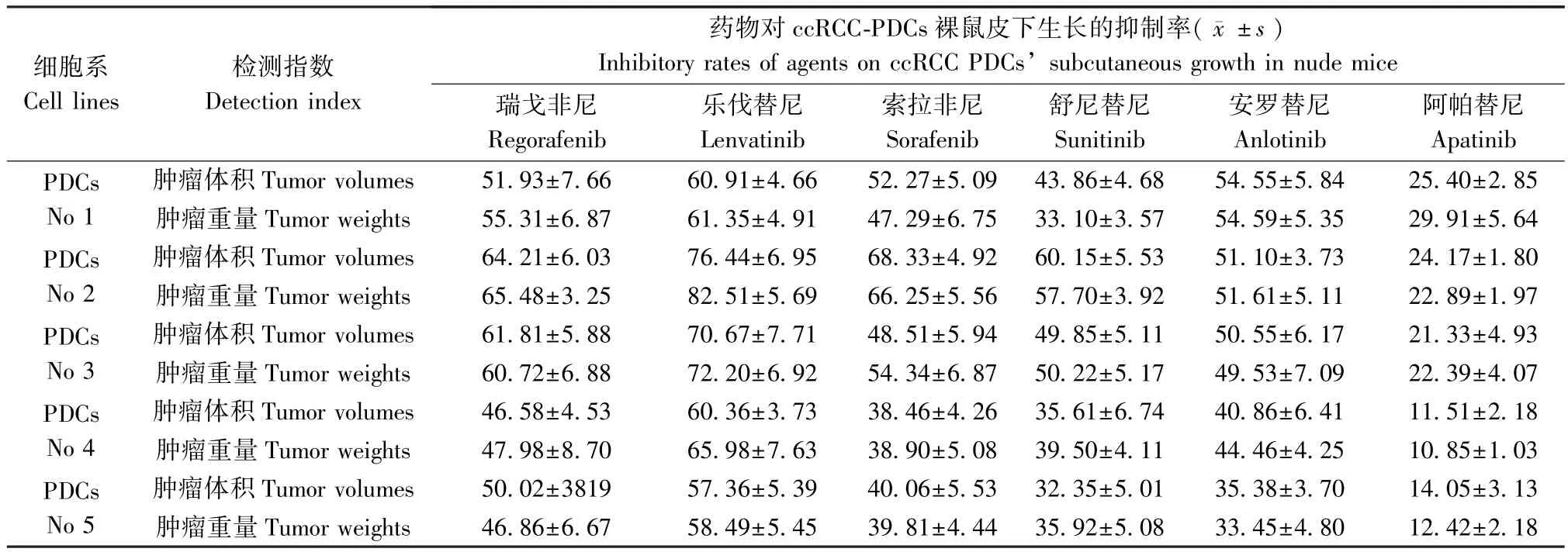
表2 分子靶向药物对ccRCCPDCs皮下肿瘤抑制率(±s)Table 2 The inhibitory rates of molecular targeting agents on five lines of ccRCCPDCs’ subcutaneous growth in nude mice
细胞系Cell lines检测指数Detection index药物对ccRCC-PDCs裸鼠皮下生长的抑制率(images/111.png±s)Inhibitory rates of agents on ccRCCPDCs’subcutaneous growth in nude mice瑞戈非尼Regorafenib乐伐替尼Lenvatinib索拉非尼Sorafenib舒尼替尼Sunitinib安罗替尼Anlotinib阿帕替尼Apatinib PDCs No 1肿瘤体积 Tumor volumes 51.93±7.66 60.91±4.66 52.27±5.09 43.86±4.68 54.55±5.84 25.40±2.85肿瘤重量 Tumor weights 55.31±6.87 61.35±4.91 47.29±6.75 33.10±3.57 54.59±5.35 29.91±5.64 PDCs No 2肿瘤体积 Tumor volumes 64.21±6.03 76.44±6.95 68.33±4.92 60.15±5.53 51.10±3.73 24.17±1.80肿瘤重量 Tumor weights 65.48±3.25 82.51±5.69 66.25±5.56 57.70±3.92 51.61±5.11 22.89±1.97 PDCs No 3肿瘤体积 Tumor volumes 61.81±5.88 70.67±7.71 48.51±5.94 49.85±5.11 50.55±6.17 21.33±4.93肿瘤重量 Tumor weights 60.72±6.88 72.20±6.92 54.34±6.87 50.22±5.17 49.53±7.09 22.39±4.07 PDCs No 4肿瘤体积 Tumor volumes 46.58±4.53 60.36±3.73 38.46±4.26 35.61±6.74 40.86±6.41 11.51±2.18肿瘤重量 Tumor weights 47.98±8.70 65.98±7.63 38.90±5.08 39.50±4.11 44.46±4.25 10.85±1.03 PDCs No 5肿瘤体积 Tumor volumes 50.02±3819 57.36±5.39 40.06±5.53 32.35±5.01 35.38±3.70 14.05±3.13肿瘤重量 Tumor weights 46.86±6.67 58.49±5.45 39.81±4.44 35.92±5.08 33.45±4.80 12.42±2.18
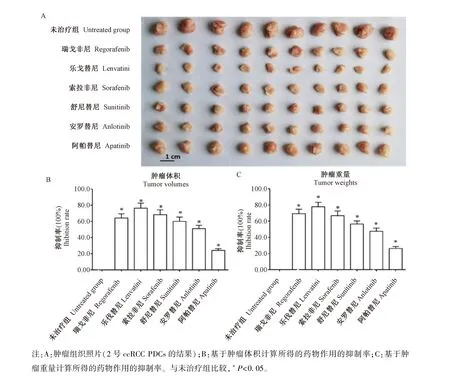
图4 分子靶向药物对ccRCC PDCs在裸鼠皮下成瘤的抗肿瘤作用Note.A,The results are shown as the represented images(from the No.2 ccRCC PDCs)of subcutaneous tumor tissues.B,inhibition rate of drug action calculated based on tumor volume.C,inhibition rate of drugaction calculated based on tumor weights.Compared with untreated group,*P<0.05.Figure 4 The anti-tumor effect of molecularly targeted agents on the tumor formation of ccRCC PDCs in nude mice
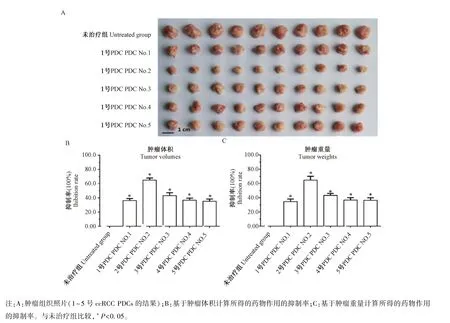
图5 索拉非尼对5株ccRCC PDCs在裸鼠皮下成瘤的抗肿瘤作用Note.A,Rrepresented images(from the No.1 to No.5 ccRCC PDCs)of subcutaneous tumor tissues.B,inhibition rate of drug action calculated based on tumor volume.C,inhibition rate of drug action calculated based on tumor weight.Compared with untreated group,*P<0.05.Figure 5 The anti-tumor effect of Sorafenib on the tumor formation of the five lines of ccRCC PDCs in nude mice
3 讨论
目前,分子靶向治疗已成为各种无法接受外科手术切除的恶性肿瘤患者,如进展期肝细胞癌(hepatocellular carcinoma,HCC)等的主要治疗策略[14]。Sorafenib是由拜耳公司(Bayer Corporation)研发并出品的分子靶向药物,不仅能够作为进展期HCC的一线治疗药物,也广泛应用于肾癌的治疗[15]。除Sorafenib外,舒尼替尼(Sunitinib)也被用于肾癌治疗[16]。除此之外,一些新型分子靶向药物如Lenvatinib(日本卫材公司)[14]、Regorafenib(拜耳公司)[14];Anlotinib(正大天晴公司)与Apatinib(江苏恒瑞公司)等也具有类似的作用机制[17-18]。本研究首先制备得到了患者来源的ccRCC细胞(PDCs),然后将PDCs接种裸鼠形成肿瘤细胞,通过灌胃给药进行分子靶向治疗。结果显示,本研究利用5例患者来源的ccRCC细胞成功建立了相关模型,所有5株细胞的数据均用表详细列出,其中2号PDC作为代表性结果出示了肿瘤组织的照片。进一步,所选5种分子靶向药物对ccRCC PDCs的裸鼠成瘤作用有明确的抗肿瘤活性,其中Lenvatinib的抗肿瘤活性优于其他几种分子靶向药物,而Apatinib的抗肿瘤活性稍弱。同时,分子靶向药物的抗肿瘤活性依据ccRCC PDCs的患者来源具有患者个体差异。
一直以来,肾癌细胞系(ccRCC cell lines)是肾癌相关研究的常用和主要研究模型,但肿瘤细胞在患者体内的存活与增殖受到肿瘤微环境、肿瘤组织间质等的影响,与在体外培养存在巨大差距[19]。现有肾癌细胞系在其建立和广泛应用过程中经历了体外长期培养,其自身特性已发生了诸多变化。例如文中选用了最为常用和代表性的Caki-1细胞,在PubMed数据库中检索最早对其使用的记录可上溯至1979年[20],因此现有细胞系从其建立到使用至今已经历了漫长的时间(逾数十年),已经无法反映出现阶段患者体内ccRCC细胞的实际情况。为此,本研究获得了ccRCC的PDCs,并建立了动物模型。结果发现,经过较长期的体外培养,ccRCC PDCs中分子靶向药物的作用靶标有明显下调,而通过将PDCs接种裸鼠形成肿瘤的方式能够实现ccRCC细胞在裸鼠体内的扩增,在这一过程中,分子靶向药物的作用靶标的表达基本稳定。这表明,使用常规体外培养的方法对ccRCC PDCs进行扩增,环境的改变(例如在体条件下肿瘤组织微环境等的缺失)会导致细胞逐渐丢失其原有的一些特性[19],这体现在本研究中即为ccRCC PDCs细胞中,多种受体酪氨酸蛋白激酶以及MAPK、PI3K/AKT等信号通路下游的蛋白激酶等的表达水平的下降,最终导致ccRCC PDCs的特征特别是对分子靶向药物的敏感性会与其在患者体内的情况存在巨大差异,无法准确反映出实际情况。而在裸鼠体内建立ccRCC PDCs细胞的肿瘤模型,裸鼠体内的环境更易于保持ccRCC PDCs自身的原有特性,具有重要意义。
综上所述,本研究不仅建立了基于ccRCC PDC的动物模型并检测了不同分子靶向药物对ccRCC PDCs在裸鼠体内的抗肿瘤活性,还确定了不同扩增和保存方法对ccRCC PDCs自身生物学特性的影响。这不仅有助于发现和揭示受试分子靶向药物新的适应症,也能够为ccRCC分子靶向治疗提供新的实验依据和更为有效的动物模型。
