新型抗菌性Hawley保持器的机械强度及抑制菌斑生物膜活性的作用
2020-07-17曹丽张宁白玉兴
曹丽, 张宁, 白玉兴
首都医科大学附属北京口腔医院口腔正畸科,北京(100050)
聚甲基丙烯酸甲酯(polymethyl methacrylate,PMMA)具有强度较高、与口腔环境生物相容性佳、容易制作成型等优点,广泛应用于制作正畸保持器[1]。然而口腔内有多种微生物,其中大多数被认为是条件致病菌[2],这些细菌常附着于保持器表面或周围,积聚形成牙菌斑生物膜,不仅会引起龋齿、牙周病、产生口腔异味[3]而且会降低保持器的使用寿命[4]。在口腔环境中,唾液蛋白吸附于材料表面,形成一层均匀无细胞的薄膜,即获得性膜,获得性膜形成后细菌就会积聚、繁殖进而形成牙菌斑。如果将具有抑制蛋白黏附的物质添加到材料中,就可以从源头抑制菌斑的形成。甲基丙烯酰氧乙基磷酸胆碱(2⁃methacryloyloxyethyl phos⁃phorylcholine,MPC)能有效抑制蛋白质的黏附,目前已经广泛应用于临床[5]。已有学者将MPC 添加到牙科树脂、正畸粘接剂等口腔材料中,在一定程度上减少了蛋白质的附着,抑制了菌斑的形成[5]。但尚未有研究将MPC 添加到甲基丙烯酸甲酯(methyl methacrylate,MMA)中。本研究拟将MPC添加到MMA 中,并在口外模拟口腔环境,评价改性MMA 材料的长期力学性能和抗菌性能,为临床应用提供理论依据。
1 材料和方法
1.1 主要设备与材料
正畸基托聚合物I 型粉、液(日进,中国);MPC(Sigma⁃Aldrich,美国);十二烷基硫酸钠(Sig⁃ma⁃Aldrich,美国);PBS(Sigma⁃Aldrich,美国);牛血清蛋白溶液(Sigma⁃Aldrich,美国);DMSO(Sigma⁃Aldrich,美国);大豆血琼脂培养板(Sigma⁃Al⁃drich,美国);轻型唾液链球菌琼脂培养板、杆菌肽(Sigma⁃Aldrich,美国);原代人牙龈成纤维细胞(Sciencell 2620,美国);蛋白质分析试剂盒(Fisher Scientific,美国);活/死细菌生存力试剂盒(Molecu⁃lar Probes,美国);自动冷热浴循环仪(森日达,中国)、万能材料测试机(MTS,美国)、荧光显微镜(Nikon,日本)、酶标仪(SpectraMax M5,美国)。
1.2 MPC 改性MMA 试件的制备
选用正畸基托聚合物I 型粉、液,按照材料说明书推荐的调和比例粉︰液=1︰0.45 进行调拌。根据预实验结果,将MPC 按照0%、1.5%、2.25%、3%、4.5%和6%的质量百分比添加到MMA 中。每组制备10 个试件,分组如下:MMA + 0% MPC(对照组);MMA+ 1.5% MPC(1.5% MPC 组);MMA+2.25% MPC(2.25% MPC 组);MMA+ 3% MPC(3%MPC 组);MMA+ 4.5% MPC(4.5% MPC 组);MMA+6%MPC(6%MPC 组)。
1.3 人工唾液浸泡及冷热循环实验
本研究参照文献及ISO/TS 11405:2003 标准进行人工唾液浸泡及冷热循环。将试件置于37 ℃恒温水浴箱中,在人工唾液中分别浸泡1、90、180 d,在每一时间点将试件取出后放入自动冷热浴循环仪中进行5 000 次冷、热温差(5 ℃30 s、55 ℃30 s)循环[6]。
1.4 三点弯曲检测
将大小为2 mm×2 mm×25 mm 的长方形试件经过人工唾液浸泡和冷热循环实验后取出,使用万能材料测试机进行三点弯曲试验。跨度为10 mm,以1 mm/min 的速度加力直到试件断裂。弯曲强度按照公式3PmaxL/(2bh2)计算,其中P 代表断裂时的载荷,L 代表跨距,b 代表试件的宽度,h 代表试件的厚度。弹性模量按照公式(P/d)(L3/[4bh3])计算,其中d 为线性弹性区域的斜率。
1.5 抗蛋白附着性能的测试
将粉、液调拌至材料到达面团期时放入圆形试件模具中,最终制作成直径8 mm、厚度0.5 mm 的圆形试件。为了去除未固化的单体,检测前需将试件在蒸馏水中搅拌1 h,然后干燥并进行环氧乙烷消毒。根据力学性能测试结果,在不影响MMA力学性能的前提下,MPC 的最大添加质量百分比为3%。因此抗蛋白和抗菌性能的试件共分为两组:对照组(0%MPC)和实验组(3%MPC),每组10个。
试件表面蛋白附着量的检测使用的是双辛丁酸法。首先将试件放在PBS 中浸泡2 h 后,将试件取出放入牛血清蛋白溶液(bovine serum albumin,BSA)中,浸泡浓度为4.5 g/L,然后放置于37 ℃恒温箱中2 h。2 h 后取出试件在PBS 中漂洗5 min,再放入含有1%十二烷基硫酸钠的PBS 溶液中,超声振荡仪震荡20 min后检测PBS溶液中的蛋白质浓度。
1.6 抗菌性能的检测
1.6.1 人唾液的收集及牙菌斑全菌生物膜模型的建立 人唾液捐赠者的纳入标准是:牙周、牙体健康的成年人;口内无修复体或活动义齿;近3 个月内无抗生素服用史;捐赠前8 h 未刷牙;禁饮食2 h以上。捐赠者通过咀嚼聚酯封口膜刺激分泌唾液,并放入15 mL 离心管中、冷藏。将收集的唾液混合后,使用无菌甘油进行稀释,混合唾液的最终浓度为70%,储存在⁃80 ℃冰箱中[5]。
人全菌生物膜的接种液是将上述混合唾液与McBain 培养基混合而成,其比例为1∶50。McBain培养基的配制方法如下:将2.5 g 粘蛋白、2.0 g 细菌蛋白胨、2.0 g 胰蛋白胨、1.0 g 酵母提取物、0.35 g 氯化钠、0.2 g 氯化钾、0.2 g 氯化钙、0.1 g 盐酸半胱氨酸、0.001 g 血红素、0.000 2 g 维生素K1 放入1 L 蒸馏水中,调整pH 值为7 后高温高压下制备。将试件放入24 孔板中,加入接种液1.5 mL/孔,于培养箱(37 ℃,5% CO2)中培养48 h,在培养时间到达8 h、16 h 时需进行换液[5]。
1.6.2 生物膜活/死细菌染色 使用活/死细菌生存力试剂盒进行生物膜的染色后,在荧光显微镜下观察染色的生物膜。不同的荧光染色代表不同状态的细菌:绿色荧光代表的是活细菌、红色荧光代表死细菌、橙黄色荧光代表接近或重叠的死/活细菌[5]。
1.6.3 细菌生物膜代谢活性的检测 MTT 法是检测生物膜代谢活性的常用方法,通过比色分析检测黄色化合物四唑MTT 经酶催化作用后还原为水不溶的紫色甲臜[5]。将覆盖有全菌生物膜的试件放入新24 孔板中,加入MTT 染料(1 mL/孔)后于37 ℃、5%CO2的培养箱中培养。1 h 后再将试件转至新24 孔板中,加入DMSO,于室温下避光温和搅拌20 min。在此过程中DMSO 可以溶解甲臜晶体。然后每孔吸取200 μL 的DMSO 溶液放入96 孔板中,通过读取酶标仪在540 nm 处的吸光度值来判断生物膜的代谢活性。吸光度越高,则生物膜代谢活性越高。
1.6.4 菌落形成单位(CFU)计数 选取2 mL 的试管,每个试管中放入一个覆有生物膜的试件,通过超声震动仪及涡旋混合震荡仪将生物膜混匀。分别放入3 种琼脂平板中培养后测定CFU:胰蛋白大豆血琼脂培养板进行总微生物的测定;含有15%蔗糖的轻型唾液链球菌琼脂培养板进行总链球菌的测定;加0.2 U/mL 杆菌肽的MSA 琼脂培养板进行变形链球菌的测定[5]。
1.7 细胞毒性检测
使用MTT 法检测细胞增殖活性。本实验的浸提比例为1.13 cm2/mL,将试件放入6 mL DMEM 细胞培养基中37 ℃下搅拌24 h 获得原始浸提液。将原代人牙龈成纤维细胞用含有10%胎牛血清、100 IU/mL 青-链霉素的新鲜DMEM 培养基传代培养至第4~8 代。培养成2.5 × 104个/mL 的细胞悬液后,以4 000 个/孔的细胞浓度接种于96 孔板中,每孔铺板200 μL,每个浸提浓度复孔6 个。空白对照组为新鲜的细胞培养液。分别在处理24、72 h 后用酶标仪在490 nm 波长下测定吸光度值,计算细胞相对增殖率(relative growth rate,RGR)。RGR=实验组OD490/空白对照组OD490× 100%,并依据RGR将材料的毒性反应进行分级,0 级:RGR ≥100%;1级:75%≤RGR ≤99%;2 级:50%≤RGR ≤74%;3级:25% ≤RGR ≤73%;4 级:1% ≤RGR ≤24%;5级:RGR=0%。
1.8 统计学分析
应用SPSS 19 软件对数据进行分析,不同组别的三点弯曲结果、抗菌、抗蛋白附着结果及细胞相对增殖率满足正态性与方差齐性,数据用±s表示,采用单因素方差分析和Tukey′s 检验进行组间比较。对长期浸泡后的两组试件的三点弯曲、抗菌、抗蛋白附着结果进行重复测量方差分析。进行重复测量资料分析时,先进行Mauchly 球形检验,若满足球形检验则重复测量分析的F检验不需要进行自由度校正,若不满足球形检验,则采用Greenhouse⁃Geisser 法进行自由度校正。P<0.05 为差异有统计学意义。
2 结 果
2.1 各组试件不同浸泡时间下三点弯曲检测实验结果
随着MPC 的增加,改性MMA 试件的力学性能不断下降,对照组和3%MPC 组差异无统计学意义(P>0.05),与对照组、1.5% MPC、2.25% MPC、3%MPC 相 比,4.5%MPC 和6%MPC 组 的 力 学 性 能 下降,差异有统计学意义(P<0.05)。见表1。
比较对照组和3% MPC 组的力学性能,两组不同时间及两组间的交互效应均有统计学意义(P<0.05),表明两组试件随着干预时间增加,机械强度均有下降趋势,时间因素的作用随分组不同而异。见表2。

表1 添加MPC 后的MMA 试件弯曲强度和弹性模量比较Table 1 Comparison of the fracture strength and elastic modulus of different MMA specimens incorporating MPC x±s
表2 添加MPC 后的MMA 试件不同浸泡时间下弯曲强度和弹性模量的比较Table 2 Comparison of the fracture strength and elastic modulus of different MMA specimens incorporating MPC after different water⁃aging times±s

表2 添加MPC 后的MMA 试件不同浸泡时间下弯曲强度和弹性模量的比较Table 2 Comparison of the fracture strength and elastic modulus of different MMA specimens incorporating MPC after different water⁃aging times±s
MPC: 2⁃methacryloyloxyethyl phosphorylcholine; MMA: methyl methacrylate; * indicates the F or P value of the main effect;Δ indicates the F or P value of the interactive effect
Groups Flexural strength(MPa)Elastic modulus(GPa)1 d 71.52±3.73 69.59±4.33 70.41±4.03 1.31 0.29 90 d 68.89±3.96 71.66±4.50 70.28±4.23 1.28 0.30 180 d 64.48±1.81 68.97±3.31 66.73±2.56 6.71 0.001 Total 68.30±3.17 70.07±4.05 69.14±3.61 5.16*0.04*F P F P Control group 3%MPCgroup Total t P 11.52 1.19 5.65*3.42Δ 0.01 0.32 0.01*0.04Δ 1 d 2.14±0.23 2.12±0.16 2.13±0.20 1.03 0.39 90 d 2.02±0.42 2.10±0.37 2.06±0.40 0.79 0.51 180 d 1.77±0.31 2.07±0.37 1.92±0.34 3.32*0.03*Total 1.98±0.32 2.10±0.30 2.04±0.31 5.07*0.04*6.19 0.08 4.54*3.00Δ 0.006 0.928 0.02*0.06Δ
2.2 两组试件抗蛋白附着、菌斑代谢活性及菌落形成单位比较
两组试件的抗蛋白附着、菌斑代谢活性及菌落形成单位差异有统计学意义(P<0.001),3%MPC 组试件表面的蛋白附着量下降约80%、菌斑代谢活性下降约50%、菌落形成单位计数下降约70%;不同时间及两者间的交互效应无统计学意义(P>0.05)。见表3~表6。
2.3 两组试件表面细菌黏附性能的定性比较
由生物膜死/活细菌染色结果可见(图1):对照组有大量绿色活菌,3%MPC组水老化1、90、180 d后均可见绿色活菌数量明显减少;因此,MPC具有持久稳定的抑制蛋白黏附进而减少菌斑形成的能力。
2.4 各组试件细胞相对增殖率的结果
处理24 h 后,对照组及3% MPC 组的细胞增殖率分别为(93.5±1.3)%、(97.8±0.7)%,差异无统计学意义(P>0.05);处理72 h组后,对照组及3%MPC组的增殖率分别为(120.9±1.5)%、(116.4±0.5)%,差异无统计学意义(P>0.05)。处理24 h 后两组细胞毒性均为1级,处理72 h后均为0级。
表3 添加MPC 后的MMA 试件不同浸泡时间下抗蛋白附着、生物膜代谢活性的比较Table 3 Comparison of protein adsorption and biofilm metabolic activity of different MMA specimens incorporating MPC after different water⁃aging times±s

表3 添加MPC 后的MMA 试件不同浸泡时间下抗蛋白附着、生物膜代谢活性的比较Table 3 Comparison of protein adsorption and biofilm metabolic activity of different MMA specimens incorporating MPC after different water⁃aging times±s
MPC: 2⁃methacryloyloxyethyl phosphorylcholine; MMA: methyl methacrylate; * indicates the F or P value of the main effect;Δ indicates the F or P value of the interactive effect
Groups Control group 3%MPC group Total Protein adsorption(μg/cm2)Biofilm metabolic activity(A540/cm2)1 d 6.16±1.41 0.77±0.52 3.47±0.97 43.82<0.001 90 d 6.18±2.70 0.82±0.26 3.50±1.48 22.67<0.001 180 d 6.89±1.21 0.85±0.67 3.87±0.94 73.56<0.001 Total 6.41±1.77 0.81±0.48 3.61±1.13 543.85*<0.001*F P F P t P 0.48 0.08 0.48*0.33Δ 0.62 0.93 0.57*0.66Δ 1 d 0.41±0.05 0.21±0.05 0.31±0.05 52.29<0.001 90 d 0.45±0.08 0.22±0.04 0.67±0.06 34.61<0.001 180 d 0.43±0.07 0.21±0.05 0.32±0.06 42.81<0.001 Total 0.43±0.07 0.21±0.05 0.43±0.06 2 123.02*<0.001*0.94 0.10 0.84*0.35Δ 0.41 0.91 0.44*0.70Δ
表4 添加MPC 后的MMA 试件不同浸泡时间下总微生物形成单位计数结果比较Table 4 Total microorganisms CFU counts of different MMA specimens incorporating MPC after different water⁃aging time ±s

表4 添加MPC 后的MMA 试件不同浸泡时间下总微生物形成单位计数结果比较Table 4 Total microorganisms CFU counts of different MMA specimens incorporating MPC after different water⁃aging time ±s
MPC: 2⁃methacryloyloxyethyl phosphorylcholine; MMA: methyl methacrylate; * indicates the F or P value of the main effect, and Δ indicates the F or P value of the interactive effect
Groups Control group 3%MPC group Total Total microorganisms(CFU)F P tP 1 d(3.0±2.0)×109(7.5±1.5)×108(1.9±1.1)×109 4.08 0.03 90 d(3.7±1.7)×109(4.5±2.9)×108(2.1±1.0)×109 3.92 0.03 180 d(2.5±3.1)×109(2.0±1.4)×108(1.4±1.6)×109 5.84 0.01 Total(3.1±2.2)×109(4.7±1.8)×108(1.8±1.2)×109 51.37*<0.001*0.39 7.16 0.19*2.71Δ 0.72 0.12 0.83*0.11Δ
表5 添加MPC 后的MMA 试件不同浸泡时间下总链球菌形成单位计数结果比较Table 5 Total Streptococci CFU counts of different MMA specimens incorporating MPC after different water⁃aging time ±s

表5 添加MPC 后的MMA 试件不同浸泡时间下总链球菌形成单位计数结果比较Table 5 Total Streptococci CFU counts of different MMA specimens incorporating MPC after different water⁃aging time ±s
MPC: 2⁃methacryloyloxyethyl phosphorylcholine; MMA: methyl methacrylate; * indicates the F or P value of the main effect, and Δ indicates the F or P value of the interactive effect
Groups Control group 3%MPC group Total Total Streptococci(CFU)F P tP 1 d(2.8±1.8)×108(6.0±1.0)×107(1.7±1.0)×108 3.56 0.04 90 d(6.5±1.9)×108(3.8±2.0)×107(3.4±1.1)×108 6.90 0.01 180 d(6.5±2.0)×108(5.8±2.0)×107(3.6±1.1)×108 6.72 0.01 Total(5.3±1.9)×108(5.2±1.7)×107(3.6±2.9)×108 495.84*<0.001*12.4 0.99 4.13*4.72Δ 0.08 0.50 0.14*0.13Δ
表6 添加MPC 后的MMA 试件不同浸泡时间下变形链球菌形成单位计数结果比较Table 6 Mutans Streptococci CFU counts of different MMA specimens incorporating MPC after different water⁃aging time ±s
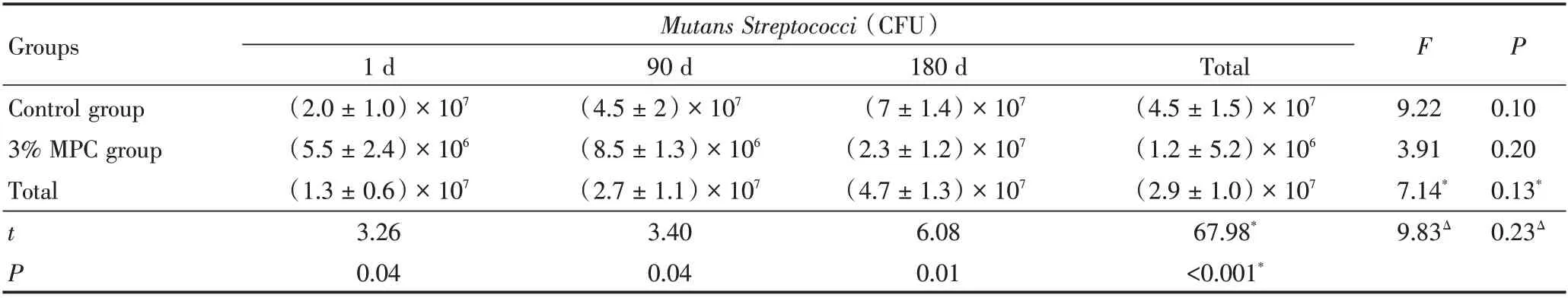
表6 添加MPC 后的MMA 试件不同浸泡时间下变形链球菌形成单位计数结果比较Table 6 Mutans Streptococci CFU counts of different MMA specimens incorporating MPC after different water⁃aging time ±s
MPC: 2⁃methacryloyloxyethyl phosphorylcholine; MMA: methyl methacrylate; * indicates the F or P value of the main effect, and Δ indicates the F or P value of the interactive effect
Groups Control group 3%MPC group Total Mutans Streptococci(CFU)F P tP 1 d(2.0±1.0)×107(5.5±2.4)×106(1.3±0.6)×107 3.26 0.04 90 d(4.5±2)×107(8.5±1.3)×106(2.7±1.1)×107 3.40 0.04 180 d(7±1.4)×107(2.3±1.2)×107(4.7±1.3)×107 6.08 0.01 Total(4.5±1.5)×107(1.2±5.2)×106(2.9±1.0)×107 67.98*<0.001*9.22 3.91 7.14*9.83Δ 0.10 0.20 0.13*0.23Δ

Figure 1 Representative live/dead staining photos of biofilms adherent on the MMA specimens incorporating MPC图1 添加MPC 后的MMA 试件菌斑生物膜死/活细菌染色
3 讨 论
正畸保持器主要由MMA 构成,MMA 具有较强的吸水性[2],而且保持器形貌复杂,表面和内部的多孔性结构更利于细菌的积聚和定植。长期暴露于口腔环境中,塑料基托表面势必会附着大量的菌斑生物膜,其结构和微生物种类类似于牙菌斑[7],不仅影响口腔健康而且会降低基托材料的强度,缩短使用周期[5]。
在口腔中,材料暴露于复杂的环境,除了内源性的蛋白质、细菌等,还有日常饮食摄入的化合物,这些物质发生复杂的相互作用会导致材料的物理、化学和机械性能发生变化[8]。水分子是导致基托材料老化的主要因素之一。它可渗透到基托材料中引起聚合链断裂,从而使材料的韧性下降、脆性增加[9]。基托材料的老化不仅与水、温度、所受载荷等物理化学因素有关,还与唾液蛋白和细菌代谢活性等生物因素密切相关[10]。研究表明,义齿长期佩戴在口腔中,细菌可经由微孔隙侵入义齿内部,通过酶活性或产生挥发性代谢产物导致义齿的机械性能下降[10]。Lohbauer 等[11]发现20%的义齿基托材料在水老化3 个月后会出现弯曲强度及弹性模量的降低。有学者报道MPC 可改变基托表面特性,减少水分子的吸附,从而延缓其机械性能的下降[12]。本研究中,不同时间以及对照组与3%MPC 两组间的交互效应均有统计学意义,两组试件随着干预时间增加,机械强度均有下降趋势。可见改性材料的强度下降得到了延缓。此外,MPC 的添加不会影响材料的美观性能,目前已有学者将MPC 添加到了牙色树脂充填材料和玻璃离子粘接剂中,发现添加MPC 后树脂和粘接剂的美观性能未受到影响[13]。
唾液蛋白吸附于牙齿或者基托表面形成的获得性薄膜为细菌的黏附聚集以及菌斑的成熟提供了必要条件。如果基托材料自身能够抑制蛋白质的黏附,则材料表面附着的细菌将大幅度减少,因此可以从源头抑制菌斑的形成[14]。MPC 是一类常用的抑制蛋白附着的生物复合体。它同时带有正、负两种电荷,具有很强的亲水性,可与水分子产生坚固的水合层,其周缘几乎无结合水[14],不利于蛋白质的黏着,因此可抑制细菌的黏附及菌斑的形成[15]。此外MPC 具有与甲基丙烯酸甲酯聚合的功能性基团,聚合后可发挥持久的抑制蛋白黏附的功能并且能一定程度上增强机械耐受力。通过MPC 对丙烯酸义齿基托材料进行表面改性,研究其抗蛋白黏附的功能,发现含有MPC 的义齿基托材料,其表面蛋白附着量下降约70%,而且能发挥持久的抗蛋白黏附的效能[16]。本研究中,与对照组相比,添加3% MPC 后的改性MMA 试件表面的蛋白附着量下降约80%、菌斑代谢活性下降约50%、菌落形成单位计数下降约70%,不同时间及两者间的交互效应差异无统计学意义。由此可见,MPC 可发挥长期、稳定的抗蛋白黏附及抑制菌斑形成的作用。
任何一种新型材料在进入临床应用之前,必须要进行生物相容性的检测,才能保障临床应用的安全性和可靠性。正畸保持器需要在口内长时间佩戴,与患者的牙龈及黏膜等均有密切的接触,因此对于改性材料的生物安全性是需要密切关注的。Tan 等[17]使用MPC 与甲基丙烯酸共聚物对疏水性丙烯酸人工晶状体表面进行改性的研究中发现,改性材料既不会产生严重的细胞毒性,也不会导致异常的细胞增殖。本研究中,处理24、72 h 后对照组及3%MPC 组的细胞毒性分级为1 或0,可见MPC 改性的新型正畸保持器具有良好的细胞相容性,其应用具有可行性。
