上颌窦底黏膜在上颌窦底提升术后窦底空间成骨中的作用
2020-07-17陈松龄朱双喜
陈松龄, 朱双喜
中山大学附属第一医院口腔科,广东广州(510080)
牙种植修复已成为临床上解决患者牙缺失的理想修复方法。但是,上颌后牙区牙缺失后常引起该区垂直向骨量不足,是该区域进行牙种植的常见问题[1]。目前,上颌窦底提升术是解决上颌后牙区垂直向骨量不足的关键技术,在临床上得到了广泛的应用。Boyne 等[2]在1980 年首次提出了上颌窦底提升术,以牙种植体应用为目的,又称为上颌窦开窗式提升术。此后,又产生了经牙槽嵴入路的上颌窦底提升术[3]。早期传统的观点认为,当上颌后牙区牙槽嵴严重萎缩、剩余牙槽骨高度为1~6 mm 时采用开窗式上颌窦底外提升术;经牙槽嵴上颌窦底内提升法适用于剩余牙槽骨高度为7~9 mm 时,尤其是单颗上后牙缺失[4]。近期的观点已有了很大的变化,相当多的人认为,当剩余的骨量高度低于6 mm 时,釆用侧壁开窗上颌窦底提升术;骨量高于6 mm 时,釆用经牙槽嵴上颌窦底提升术。但也有不少的观点认为,低于6 mm 的高度时,只要植入时种植体的初期稳定性许可,都可以行经牙槽嵴上颌窦底提升牙种植术[5⁃7]。
上颌窦底提升后的成骨机制一直是学者关注的问题,因为上颌窦底提升技术的变化必然是以上颌窦底提升后空间成骨的理论基础为根据。上颌窦黏膜是上颌窦底提升后窦底空间成骨过程中不可或缺的生理结构,近年来人们对它的关注逐渐增多,有关它的研究成为热点。本文将从上颌窦底黏膜与上颌窦底提升成骨的关系、上颌窦底黏膜的屏障和成骨功能、参与窦底空间成骨的成骨细胞来源、上颌窦黏膜干细胞成骨分化的分子调控机制作一阐述,为更好地认识上颌窦黏膜在上颌窦底提升术后空间成骨中的作用提供参考。
1 上颌窦底黏膜与上颌窦底提升成骨的关系
上颌窦底提升术剥离上颌窦底黏膜,术后可在窦底黏膜下方形成新骨。现阶段,研究表明这个成骨过程与提升的上颌窦黏膜和周围骨壁形成的密闭空间有关[8⁃9]。植入空间维持装置或骨移植材料等都可达到维持上颌窦底提升术后窦底空间的目的,稳定的窦底空间维持,是上颌窦底成骨的重要因素[10⁃11]。植入材料吸收越慢,窦底形成的空间越稳定,成骨效果就越好[12]。在密闭的空间里,窦底成骨的过程相当于引导骨再生过程,周围骨壁和上颌窦黏膜有效地阻挡软组织的上皮细胞和纤维细胞等进入,允许成骨细胞的进入[4]。因而,保持窦底空间的稳定性和密闭性非常重要。
保持空间稳定性的方法主要还是在窦底空间内植入骨移植材料[13]。虽然植入材料的种类很多,但目前应用的材料主要有3 种:自体骨、异种骨和同种异体骨。自体骨是成骨能力强,成骨效果快的材料,但却有吸收快的缺点,因而,在临床应用中最常用的是异种骨和同种异体骨移植材料,这两种材料由于吸收慢,维持空间稳定,其最后的成骨效果不亚于自体骨,甚至超越自体骨,并且由于不需开辟第二手术区而广泛使用[14]。Scala 等[15]行猴子开窗式上颌窦底提升同期牙种植,术中不植入骨移植材料,发现早期愈合过程中窦底空间的维持效果较差,种植体根部在愈合后1 月未见新骨形成,表明维持窦底空间在上颌窦底提升术后是非常必要的。有实验报道,在开窗式上颌窦底提升术中将上颌窦黏膜上抬,缝合于侧面骨窗保持成骨空间,同期牙种植,结果发现负载12 个月种植体存留率达100%[8]。
保持窦底空间的密闭性也是成骨的重要因素,可有效阻止上皮细胞和纤维细胞等的进入,使空间能有效地成骨[10]。经牙槽崤上颌窦底提升无疑是能够保持窦底空间密闭性的方法[10](图1)。应用开窗式上颌窦底提升术形成的空间密闭性则由于有骨窗的存在可能受到影响[16]。如何处理骨窗以保持窦底空间密闭性,对保障空间成骨具有重要意义。许多的临床和动物实验研究报道,开窗式上颌窦底提升的骨窗采用骨片复位或屏障膜封闭骨窗口,其成骨的效果指标优于不封闭骨窗口的指标[17⁃19]。这些研究为开窗式上颌窦底提升时采用封闭窗口的方法提供了实验基础(图2)。

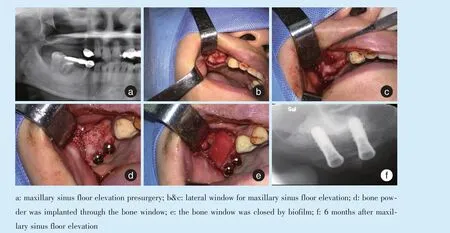
Figure 2 The stability and tightness of the sinus floor space after lateral window sinus floor elevation are conducive to osteogenesis图2 侧壁开窗上颌窦底提升窦底空间的稳定性和密闭性有利于成骨
近年来,上颌窦底提升同期牙种植不需要在窦底空间植入骨移植材料,同时获得成功的研究报道不少[20]。有研究将卷尾猴分为2 组,上颌窦底提升时使用自体骨材料组和不使用自体骨材料组,同期进行牙种植体植入,结果两组的骨种植体接触率和骨质量无明显差异[21]。还有许多临床应用报告上颌窦底提升术不植骨同期牙种植也能获得很高的种植体存留率,且行使正常的咀嚼功能,这无疑很鼓舞人心[22⁃23]。分析这些临床报道,可发现报道的病例多为经牙槽嵴上颌窦底提升病例,窦底空间具有极好的密闭性,植入的种植体长度一般都不长或提升的空间高度有限,一般不超过4 mm,这样较低高度的空间容易维持。良好的空间稳定性和密闭性促进了即使不植入骨移植材料也能保证窦底空间的成骨进程,在临床上获得种植体存留和成功。但尽管如此,笔者在研究中仍发现,不植骨的窦底空间获得的成骨高度不能超过种植体的顶部,多数都在种植体顶部以下,最高也只能与种植体顶部持平(图3、图4)。
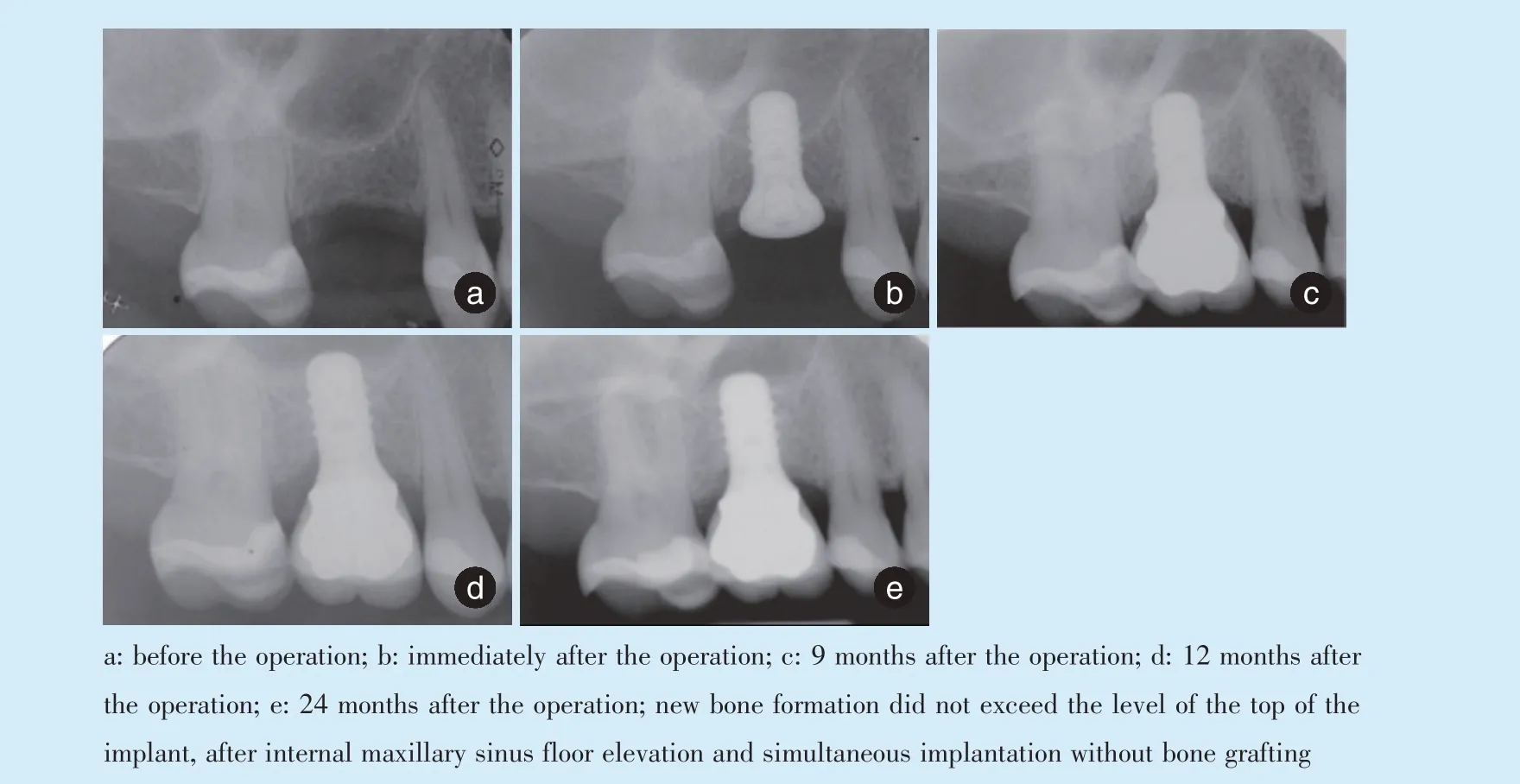
Figure 3 New bone formation did not exceed the level of the top of the implant图3 经牙槽嵴上颌窦底提升不植骨同期牙种植
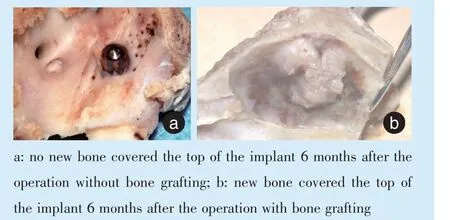
Figure 4 Experimental study on osteogenesis after sinus floor elevation and simultaneous dental implantation in dogs with or without bone grafting图4 犬上颌窦底提升不植骨和植骨同期种植的成骨实验研究
上颌窦底提升术同期牙种植是否进行骨移植或替代材料填充,必须根据上颌窦底空间成骨的原理来进行综合分析,即要注意保持空间的稳定性,如果不植骨不能维持空间,则要考虑植骨。但是,一些严格维持上颌窦的空间稳定(如植入骨移植材料)和空间密闭性(经牙槽嵴上颌窦底提升,或封闭侧壁上颌窦底提升的骨窗口)的临床病例也有不少的失败结果,有人认为是窦底空间的成骨能力不足。对于一些窦底骨板缺损、骨板连续性中断,上颌窦底骨质患有慢性炎症的病例显然是可以由于窦底空间的成骨细胞来源不足,而引起成骨受限甚至不成骨,导致种植失败。对于这类病例显然选用自体骨作为植入空间的材料,成功的系数会更高。但也应当注意,植入自体骨并不一定成功,上颌窦底空间周围组织的条件(血运、成骨细胞和感染)以及全身情况(年龄、糖尿病及其他慢性病等)也有决定性意义。
在上颌窦底提升过程中,要充分考虑保持窦底空间的稳定性和密闭性,其中妥善处理上颌窦黏膜起到了极其重要的作用。避免黏膜的穿孔破裂,屏障侧壁开放的骨窗,才能保证窦底空间的密闭性。植入的骨移植材料推荐选用慢吸收的材料,以维持窦底空间较长时间的稳定。行经牙槽嵴上颌窦底提升同期不植骨牙种植时,必须考虑到过高的黏膜提升(如超过4 mm 或更高)可能由于没有植入材料的支撑,造成黏膜的塌陷,不能维持良好的空间。
2 上颌窦底黏膜在上颌窦底提升中的屏障和成骨功能
上颌窦底提升术后成骨的理论基础是手术造成窦底空间,在空间内发生类似引导骨组织再生的新骨形成[24],例如典型的侧壁开窗式上颌窦底提升术是在窦底空间植入材料,形成和保持窦底空间,并利用生物屏障膜或复位的骨板覆盖颊侧骨窗维持所需的空间,使增殖速度较慢的成骨细胞生长,防止增殖较快的上皮细胞和成纤维细胞长入,新骨形成与同期植入的种植体形成良好的骨结合[25]。因此,上颌窦底黏膜在窦底空间成骨过程中至少也是起到了生物屏障膜的作用。
Li 等[26]对比格犬行开窗式上颌窦底提升同期牙种植时,使用生物屏障膜覆盖颊侧骨窗,结果发现窦底空间只有新生骨的形成,而没有应用生物屏障膜覆盖颊侧骨窗的窦底空间有部分纤维组织长入(可能由于剥离的骨膜损伤以及开窗过大过低),实验表明窦底空间除了由骨窗口可让软组织长入外,上颌窦底黏膜虽然含有软组织成份,但并没有从上颌窦底黏膜来源的软组织长入,这说明了上颌窦底黏膜是起到屏障膜的作用。上颌窦底黏膜在维持成骨空间中起到天然的生物屏障膜作用的同时,其本身是否具有成骨能力呢?这对于理解上颌窦底提升术的成骨具有重要的意义。
Mahler 等[27]对5 例上颌窦底外提升术后感染的患者进行研究,经抗炎、手术清创及植入骨移植材料后,影像学检查骨移植材料最上方出现“穹顶”高密度影,提示上颌窦底黏膜可能存在成骨的潜力。有临床病例观察到在上颌窦囊肿摘除后进行上颌窦底提升术,3 个月愈合后,在颊侧骨窗和上颌窦底黏膜之间的空间可见新生骨组织充满[28]。Jung 等[29]报道通过上颌窦颊侧开窗,提升上颌窦黏膜取出该处异位的阻生牙后5 个月发现牙槽窝和上颌窦底新骨形成。这些在临床上观察到的现象提示上颌窦底黏膜具有成骨能力。为进一步探索上颌窦底黏膜是否具有成骨能力,Srouji等[30]进行了动物实验研究,观察到上颌窦底黏膜含有骨膜样的细胞层;此后又进行了进一步研究,将上颌窦底黏膜的上皮层与固有层和骨膜样层分离后,折叠成袋状移植入裸鼠皮下,可见有大量类骨样组织形成,同时免疫组化染色结果证实上颌窦底黏膜的骨膜样层成骨。Gruber 等[31]发现成年猪上颌窦底黏膜的冰冻切片中STRO⁃1 表达阳性,STRO⁃1 是间充质祖细胞的标志物;在骨形态发生蛋白⁃6(bone morphogenetic protein 6,BMP⁃6)和BMP⁃7 诱导培养下,猪上颌窦底黏膜来源细胞的STRO⁃1 和碱性磷酸酶(alkaline phosphatase,ALP)活性检查呈阳性,成骨细胞特异性细胞外基质蛋白骨钙素(osteocalcin,OCN)的表达水平和细胞外基质的钙积累量增加。故而认为,猪上颌窦底黏膜含有间充质祖细胞,进而分化形成成骨细胞,它们可以在BMP⁃6 和BMP⁃7 诱导下分化成骨。
笔者课题组于2005 年开始对上颌窦底黏膜在上颌窦底提升术中的成骨作用进行研究,在冲顶式经牙槽崤上颌窦底提升同期牙种植的动物实验研究中发现,当上颌窦底提升高度小于4 mm 时,窦底空间有足够的新骨形成并与种植体形成骨性结合,提示上颌窦黏膜在窦底空间成骨中至少起到屏障膜的作用,因为窦底空间没有纤维组织的形成。随后,收集犬上颌窦底黏膜标本,分离了黏膜骨膜样细胞层,并从中成功提取了骨原细胞,经诱导分化证实了这些细胞具有成骨能力。并从人的上颌窦底黏膜成功分离并培养了这些骨原细胞,并进行了多分化研究,发现这些细胞的CD105 和STRO⁃1 表达阳性,与骨髓间充质干细胞(bone mar⁃row stromal stem cells,BMSSCs)、牙髓干细胞(dental pulp stem cells,DPSCs)、牙周膜干细胞(periodontal ligament stem cells,PDLSCs)一样具有成骨成软骨等多分化性能(图5~图7),从而将这些间充质干细胞首次正式命名为上颌窦黏膜干细胞(maxillary sinus membrane stem cells,MSMSCs)[32]。
笔者课题组上述的系列研究从组织学水平、细胞学水平至分子生物学水平,充分证实了上颌窦底黏膜在上颌窦底提升的成骨过程中不仅起到屏障膜的作用,并且具有成骨性能。这些研究结果,提高了人们对上颌窦底提升术后窦底空间成骨原理的认识,正是因为上颌窦底黏膜的屏障功能和成骨功能,才能使上颌窦底提升的窦底空间阻止了软组织上皮细胞和纤维细胞的进入,才能使空间形成了类似于引导骨组织再生的成骨反应过程。这一认识对临床应用具有重要的现实价值,也必将对进一步深入研究促进上颌窦底提升成骨的机理具有深远的影响。
3 上颌窦底黏膜是窦底空间成骨细胞的来源

Figure 6 Maxillary sinus membrane stem cells have chondrogenic capacity图6 上颌窦底黏膜干细胞的成软骨能力
骨组织的形成和愈合需要有骨原细胞,骨原细胞迁移、分化为成骨细胞,成骨细胞合成和分泌细胞外基质,最终矿化成骨[33]。关于上颌窦底提升术后窦底空间成骨过程中成骨细胞的来源有很多的研究。首先,在上颌窦底提升术后空间成骨过程中骨髓间充质干细胞(bone marrow stem cells,BMSCs)可从下方牙槽骨和周围的上颌窦骨壁迁移至表面分化为成骨细胞,这是因为窦底黏膜提升后窦底空间下方和周围骨皮质吸收,进而使骨髓腔暴露、BMSCs 迁移至骨皮质表面而促使新骨产生[34-35]。这种途径的成骨细胞是窦底空间新骨产生的主要来源。同时,有人认为上颌窦底提升术中产生的骨组织碎片也可能是成骨细胞的来源之一[8]。血液也在上颌窦底提升术后成骨过程中起作用,上颌窦底黏膜提升后局部血液凝固,刺激骨形成[36]。血凝块中含有大量生长因子,能够激活组织修复和骨形成[37⁃38]。上颌窦底黏膜可分为上皮层、固有层、黏膜下层和接近骨表面的骨膜样层四层[37⁃38]。那么上颌窦底黏膜是不是窦底新骨产生的成骨细胞来源呢?笔者课题组作了下列研究。

Figure 7 Maxillary sinus membrane stem cells have osteogenic capacity图7 上颌窦底黏膜干细胞的成骨能力
Guo 等[32]研究表明人上颌窦底黏膜骨膜层含有间充质干细胞。进一步研究[39⁃40]发现,这些干细胞似乎参与了窦底空间的成骨反应。在犬侧壁开窗式上颌窦底提升模型设计了3 种形式的模型:正常上颌窦底提升模型,上颌窦底提升+阻隔骨壁成骨模型,上颌窦底提升+阻隔黏膜成骨模型。实验结果证实了上颌窦底黏膜来源的MSMSCs 参与了窦底空间的成骨反应,这些细胞即使是在上颌窦骨壁被阻隔不能形成新骨的情况下也能使窦底空间产生新骨。这证实了上颌窦底黏膜是窦底空间新骨产生的成骨细胞来源之一。这一发现对于深入认识上颌窦黏膜在上颌窦底提升术中的作用具有十分重要的意义。但该实验研究同时指出来源于上颌窦黏膜的MSMSCs 促使新骨形成的能力要远比来源于周围骨壁的成骨细胞的成骨能力弱,尽管如此,但其作用却不容轻视。首先,上颌窦底黏膜的MSMSCs 主要来自于骨膜样层,骨膜样层屏障了上颌窦底黏膜的软组织进入窦底空间,保障了窦底空间成骨的正常进行。其次,骨膜样层还能产生成骨细胞进入窦底空间参与成骨。最后,这些来源于黏膜的MSMSCs 同样对骨形成蛋白、富含血小板血浆的浓缩生长因子(concentrate growth factor,CGF)等具有骨诱导性或激活成骨的植入材料产生明显的成骨反应。在临床中也有证据提示富血小板血浆能激活上颌窦底黏膜的成骨反应,这是值得进一步探索和研究的现象。
在临床实践中需要注意的是,在上颌窦底提升术中,要充分仔细地考虑骨壁的成骨能力。对于窦底骨板穿孔或骨质己存在炎症、慢性疾病(如糖尿病)等影响骨质的新骨生成的病例,行上颌窦底提升牙种植方法时,因为没有骨壁的骨再生,容易导致空间成骨的不足,甚至失败,影响牙种植的成功。
4 上颌窦黏膜干细胞成骨分化的分子调控机制
研究MSMSCs 的成骨分化过程及其调控机制对于发挥上颌窦底黏膜的成骨作用,对于促进窦底空间的新骨形成具有重要的理论基础和临床应用意义,但目前研究较少,笔者课题组对MSMSCs成骨通路以及非编码RNA 调控MSMSCs 成骨反应过程进行了系列研究。
在成骨通路研究方面,Rong 等[39]发现建立3 组比格犬上颌窦外提升术后4 周时,新生组织中有骨骼发育和血管形成,成骨相关的OCN、促进骨生成的生长和分化因子表达升高;窦底黏膜中成骨相关基因:促进成骨性细胞黏附因子、促进骨生成的生长和分化因子等表达升高。同时结果还表明MSMSCs 的成骨分化过程中存在BMP⁃2、Runt 相关转 录 因 子2(runt ⁃ related transcription factor 2,Runx2)、锌指转录因子、骨桥蛋白(osteopontin,OPN)等因子高表达,表明MSMSC 的成骨过程与BMPs 通路密切相关,这与机体内其它区域的成骨反应过程基本相同。
上颌窦黏膜来源的成骨细胞和骨壁来源的成骨细胞,这两种细胞的成骨过程都与BMP 成骨通路密切相关,成骨反应过程相同,上述研究结果提示了在临床应用中,行上颌窦底提升后窦底空间中植入自体骨、BMP、CGF 等骨诱导性物质以及CGF 等都起到同时促进两种来源成骨细胞的成骨作用。
在对非编码RNA 调控MSMSCs 成骨的研究方面,笔者课题组发现miRNAs、lncRNAs 和circRNAs都参与了调控成骨反应过程。
大量的研究报道小分子RNAs 可在转录和转录后水平调控基因表达,调节细胞增殖和分化,进而影响个体生长发育和疾病的发生过程[41⁃43]。微小RNAs(miRNAs)是一类广泛存在的非编码小分子RNA,参与各种生理和病理过程的调控[44]。荣琼等[45]研究发现4 周时,在窦底黏膜中差异表达的miRNAs 有74 个,部分差异表达的miRNAs 与成骨过程相关,从而调控成骨的反应过程,但大多数miRNAs 对成骨过程的作用尚未见报道。应用miRNAs 芯片对BMP⁃2 诱导培养后的MSMSCs 中miRNAs 的表达量进行分析,筛选出表达差别明显的miRNAs,生物学分子实验证明,miR⁃27b⁃3p 和miR⁃1827 可抑制hMSMSCs 在体内外的成骨分化作用[46⁃47]。
近年来,长链非编码RNAs(long noncoding RNA,lncRNAs)作为竞争性内源性RNA 调控miR⁃NAs 进而影响间充质干细胞的成骨分化的研究多有报道[48]。为深入研究,研究者利用lncRNAs 芯片对BMP⁃2 诱导培养后的MSMSCs 中lncRNAs 的表达量进行分析,发现lnc⁃NTF3⁃5[49]、lncRNA MO⁃DR[50]表达量上调明显,结合相关实验明确了lnc⁃NTF3⁃5、lncRNA MODR 可调节MSMSCs 的成骨分化生物学功能。所以,lncRNAs 可通过介导miR⁃NAs 调控成骨通路的靶基因,从而影响MSMSCs 的成骨分化过程。
环状RNAs(circular RNAs,circRNAs)是一类新的非编码RNA,在多种疾病中发挥着重要作用[51⁃52]。研究表明circRNA_33287 对MSMSCs 成骨分化过程发挥正向调控作用,circRNA_33287 作为ceRNA 海绵性吸附miR⁃214⁃3p 靶向调控RUNX3,在调节MSMSCs 的成骨分化中发挥作用[53]。
上颌窦底黏膜来源的MSMSCs 的成骨过程受非 编 码RNAs 的 调 控,miRNAs、lncRNAs 和cir⁃cRNAs 在转录和转录后水平对MSMSCs 的成骨分化过程发挥调控作用。探讨和认识非编码RNA 对成骨过程的调控,对于深入认识MSMSCs 的成骨机制,以期在基础研究和临床实践中通过干预和影响非编码RNA 的生物学靶点,促进上颌窦底提升术新骨生长,对提高上颌后牙区种植成功率有极其重要的意义。
