亚硒酸盐还原菌除硒效果与吸附机理分析
2020-07-17曾涛涛张诗琦付云书蔡萍莉荣丽杉
曾涛涛,张诗琦,胡 青,付云书,蔡萍莉,荣丽杉
(南华大学 污染控制与资源化技术湖南省高校重点实验室,湖南 衡阳 421001)
0 引 言
硒(Se)对人类健康有着极为重要的作用,但在采矿、金属冶炼、烧煤火电厂及局部农业灌溉中,产生的硒浓度稍高就会污染环境[1],局部地方硒浓度甚至达到10 mg/L以上[2]。硒在自然界中主要以+6、+4、0和-2价四种价态存在[3],其中Se(Ⅵ)和Se(Ⅳ)容易迁移扩散,引起硒污染[4]。国家对含硒废水处理日益重视,在2015年《城镇污水处理厂污染物排放标准》(征求意见稿)中,将总硒排放限值定为0.01 mg/L[5]。
传统物理、化学方法处理含硒废水包括:膜分离、混凝沉淀、吸附、电化学等[6]。这些方法存在成本高、能耗大,容易产生二次污染等问题。微生物可将高价硒还原成Se(0),来降低硒污染风险,受到研究者重视。
研究发现芽孢杆菌、假单胞菌、肠杆菌、希瓦氏菌等[4,7]具有去除硒能力。李丹等[8]发现沼泽红假单胞菌(Rhodopseudomonaspalustrisstrain N)对2 mmol/L亚硒酸盐还原率达到91.4%。廖青等[9]从广西富硒区土壤中分离出8株硒能力较强的菌株,其在固体培养基中对硒的耐受浓度在10 000 μg/mL以上,分子生物学鉴定结果发现主要为芽孢杆菌与粘质沙雷氏菌。J.Zhang等[10]从安徽富硒土壤中分离到两株细菌,经过鉴定为Lysinibacillusxylanilyticus与Lysinibacillusmacrolides,它们在36 h内可完全去除1 mmol/L的亚硒酸钠。H.Ayano等[11]从土壤中分离得到一株Pseudomonassp.(假单胞菌),能同时去除1 mmol/L的Se(Ⅳ)和Cd(Ⅱ)。
目前,已有分离的除硒菌主要从土壤中获得。为了研究水体中除硒菌特性,作者从江西某富硒泉水中取样,分离纯化亚硒酸盐还原菌,并进行分子生物学鉴定;探讨其耐硒能力与除硒效果;通过扫描电镜、红外光谱分析等技术分析细菌除硒机理。
1 材料与方法
1.1 富硒水样采集
从江西省宜春市某富硒温泉、古井及山泉中取水样,收集在预先用体积比例为5%的硝酸清洗干净的聚乙烯瓶中,水样保存在4 ℃冰箱中直至分析。试验中总硒含量采用3′3-二氨基联苯胺分光光度法测定[12]。
1.2 亚硒酸盐还原菌分离
配制LB固体培养基,取100 μL水样,采用涂布稀释与平板划线法,在25 ℃、好氧条件下,培养3 d分离出纯菌落,观察其形态特征。生理生化特征主要分析溶解氧、温度、pH、接种率、初始亚硒酸钠浓度等对菌落生长的影响。设置4因素4水平正交试验(表1),测定细菌的最适生长条件。

表1 正交试验因素与水平设置
1.3 细菌耐硒能力测定
为了研究细菌的耐硒能力,将处于对数期的B-E细菌菌悬液(OD600=0.9),按10%体积比比例加入到亚硒酸浓度分别为1~7 mmol/L的LB培养基中,在有氧(DO=6.56)、30 ℃、pH=7.5、转速150 r/min的恒温震荡器中反应18 h,测定OD600值,以此来衡量细菌生长情况。所有试验均设置三组平行,计算平均值与相对误差。
1.4 菌属分子生物学鉴定
通过16S rDNA基因进行分离菌株的分子生物学鉴定。DNA提取使用基因组DNA分离试剂盒(TSP101-50)进行提取,采用超微量分光光度计测定DNA浓度,以27F和1492R通用引物进行16S rRNA基因PCR扩增[10]。
PCR反应体系包含:金牌MIX酶30 μg/L、引物12 μg/L、引物22 μg/L和模板1 μg/L。扩增步骤为:首先,DNA在98 ℃下进行初始变性120 s;然后,进行35个循环,包括在98 ℃下变性10 s,在55 ℃下退火10 s,在72 ℃下延伸20 s;获得的序列在72 ℃下终延伸2 min;然后,使用ABI3730XL测序仪进行16S rDNA序列测定。用MEGA 7.0进行系统发育分析[13],并将所得16S rRNA基因序列上传至GenBank数据库,获得基因登录号为:MF403055、MF576499、MF576500和MF576501。
1.5 亚硒酸盐还原菌除硒效果
因为亚硒酸盐还原菌可将Se(Ⅳ)还原为红色单质硒Se(0),所以通过LB培养基颜色变化(出现红色),可定性确定菌株对亚硒酸盐还原能力[14]。根据工业含硒废水中常见硒含量[15],分别配制初始亚硒酸钠浓度为3.0、4.9、6.0、12.0、33.0 mg/L的人工含硒废水,分析亚硒酸盐还原菌除硒效果。
1.6 除硒机理分析
1.6.1 细菌表面形态观察
通过SEM-EDS分析除硒前、后细菌表面形态特征及元素含量。样品处理方法为:首先,用体积比例为2.5%的戊二醛固定4 h;此后,用磷酸缓冲液(PBS缓冲液)(pH7.2)洗涤3次;然后分别用体积比例为30%、50%、70%、85%、90%乙醇脱水1次,100%乙醇脱水2次,每次20 min;最后,用六甲基二硅氮烷覆盖样品,以提高样品在显微镜下可见度,将处理好的样品固定在玻璃培养皿中,在干燥器中冷冻干燥24 h;最后,利用扫描电镜(Zeiss EVO18型)观察除硒前后细菌形态,利用能谱仪分析元素组成及比例。
1.6.2 细菌官能团作用分析
用傅里叶变换红外光谱仪(Thermo Nicolet Avatar 460)采集除硒前、后细菌官能团光谱特征(4 000~300 cm-1),分析细菌官能团在硒去除中的作用。样品预处理方法:将样品冷冻干燥,与适量KBr晶体混合,完全研磨直至无小颗晶体的粉末,压制在砂浆中,进行检测。
2 结果与讨论
2.1 分离细菌特性分析
将分离得到4株细菌命名为B、C、D、E菌,它们的菌落特征相似,表现为白色、圆形、长(2.73±0.2)μm、宽(0.76±0.1)μm、表面粗糙、不透明、边缘起伏、质地柔软等。经过革兰氏染色,显示4株细菌均为革兰氏阳性菌。B-E菌的耐硒能力结果如图1所示。
当亚硒酸钠浓度为1~2 mmol/L时,B、C、D细菌OD600值变化不大,说明这三株菌生长较慢;当亚硒酸钠浓度为5 mmol/L时,4株细菌OD600均最大,代表它们生长最佳;当亚硒酸钠浓度为7 mmol/L(553 mg/L),B、C、D细菌OD600值在2.0左右,而E细菌OD600接近3.0,表示这些细菌仍生长良好。成永丽等[13]从植物根瘤中分离出6株根瘤菌,它们对硒的耐受能力在3~6 mg/L之间。舒梅等[16]从富硒地区的农家酸菜中分离筛选出2株乳酸菌,可耐受终浓度320 mg/L的亚硒酸钠。而本实验分离的4株细菌对亚硒酸钠耐受性达到553 mg/L,说明属于超强耐硒菌。
正交试验结果如表2所示。B、C、E细菌的适宜温度35 ℃,适宜pH值为7.0或7.5,需要适宜的亚硒酸钠浓度。而D细菌适宜温度为45 ℃,不需要亚硒酸钠的条件生长良好。对于各细菌,影响因素的主次顺序为B菌:pH>温度>接种率>SeO32-初始浓度;C菌:温度> pH>接种率> SeO32-初始浓度;D菌:SeO32-初始浓度>温度> pH>接种率;E菌:温度> pH>接种率> SeO32-初始浓度。
2.2 分离细菌的菌属鉴定
将B-E菌16S rDNA基因测序所得结果,在NCBI数据库中搜索相似序列,构建系统发育树,结果如图2所示。序列比对发现4株细菌与芽孢杆菌属相似度最高(>99%)。其中,B、C、E菌与芽孢杆菌属(Bacillussp)分支更接近,而D菌与Bacilluscereus菌属在一个分支,说明B、C、E菌相互间亲缘关系较近。综合考虑B-E菌的16S rDNA基因序列相似性分析结果与系统发育树,判断分离纯化的B-E菌为芽孢杆菌属。
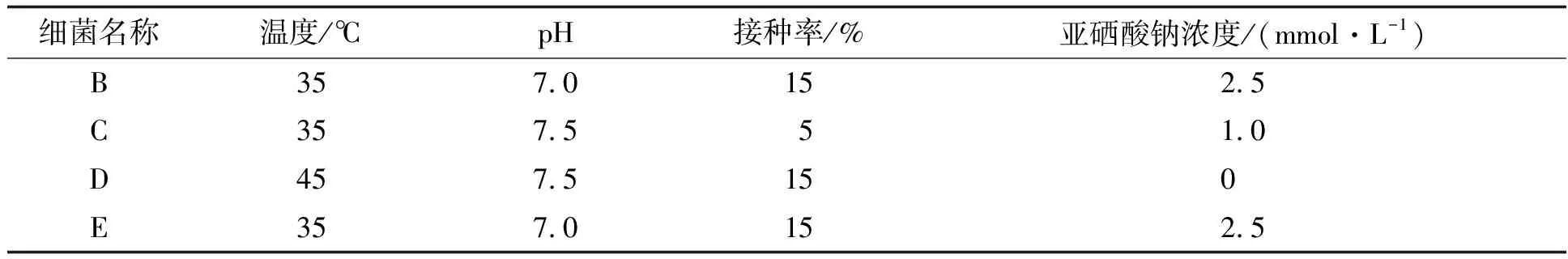
表2 B-E菌最适生长条件
芽孢杆菌在硒去除中有较多报道,R.R.Mishra等[17]发现巨大芽孢杆菌(Bacillusmegaterium)可在40 h内去除0.25 mmol/L的亚硒酸钠。袁永强等[18]研究了Bacillussp.SeRB-2对亚硒酸钠的还原动力学,发现Se(Ⅳ)的细菌还原符合一级反应动力学,还原反应主要集中在对数期和稳定生长前期,对1 mmol/L的Se(Ⅳ)还原效率最高可达90%,可有效降低硒污染程度。因此,本研究也继续探讨分离的亚硒酸盐还原菌除硒效果。
2.3 亚硒酸盐还原菌除硒效果
作者此前曾发现,微生物可以将高价硒还原为硒单质,使培养液变红[14],本试验发现了类似的现象,说明B-E菌具有还原亚硒酸盐的能力。4株细菌在18 h内,对亚硒酸钠浓度为3.3、4.9、6.0、12.0、33.0 mg/L的人工废水均有很好的去除效果;对33.0 mg/L亚硒酸钠去除效果最好(>99.7%)。舒梅等[16]分离筛选出2株乳酸菌,当培养液含亚硒酸钠浓度为20 mg/L时,菌株对硒的转化率可达74.5%。而本实验分离的B-E菌去除硒能力更高。选择B菌来考察其对高浓度硒去除效果,75 h内对2.5 mmol/L(197.5 mg/L)亚硒酸钠去除情况如图3所示。
在0~20 h,总硒浓度从2.5 mmol/L下降到1.1 mmol/L,去除率为56%;对应的OD600值从接近0升高到1.6。在12~50 h,总硒浓度进一步下降到0.36 mmol/L,总硒累积去除率达到85.6%,OD600值升高到最大值2.7。此后到75 h,总硒浓度小幅度下降到0.22 mmol/L,总硒累积去除率达到91.2%,此阶段OD600值略有下降,但依然保持在2.2以上。本研究分离的芽孢杆菌除硒能力高于此前报道的巨大芽孢杆菌[17]、Bacillussp.SeRB-2[18]等,说明分离的细菌具有处理高浓度含硒废水的潜力。
2.4 除硒机理分析
2.4.1 细菌表面形态及元素变化
将处理高浓度含硒废水的B菌,进行SEM-EDS分析,结果如图4所示。放大20 000倍后的SEM结果显示,细菌成杆状,宽约0.8~1 μm,长约1.2~2 μm,与此前报道的芽孢杆菌形态类似[18]。除硒前细菌形态饱满、表面光滑,除硒后细菌表面出现褶皱,少部分细菌塌陷,但大部分细菌依然形态完整。这表明分离的芽孢杆菌能够耐受高浓度亚硒酸盐。
EDS结果显示,除硒前,细菌表面未含有硒元素。而除硒后,表面积上出现明显的硒峰(1.38~1.40 keV),表明细菌表面存在一定量的硒。统计元素含量分析,发现硒元素占细菌表面元素比例的9.87%(表3),可确定细菌对硒的富集作用。
2.4.2 细菌官能团作用分析

与其它官能团峰位变化幅度相比,羟基、蛋白酰胺带Ⅱ的酰胺基峰位变化最显著,移动约80 cm-1;蛋白酰胺带I基团峰位移动约17.5 cm-1。推测此变化主要是由于亚硒酸根离子与羟基、酰胺基之间的相互作用引起的[19],即酰胺基及羟基团在亚硒酸钠吸附去除中起到重要作用。因此,亚硒酸盐还原菌对硒除了有还原效果之外,还有吸附作用,具体还原机理,将在后续研究中探讨。
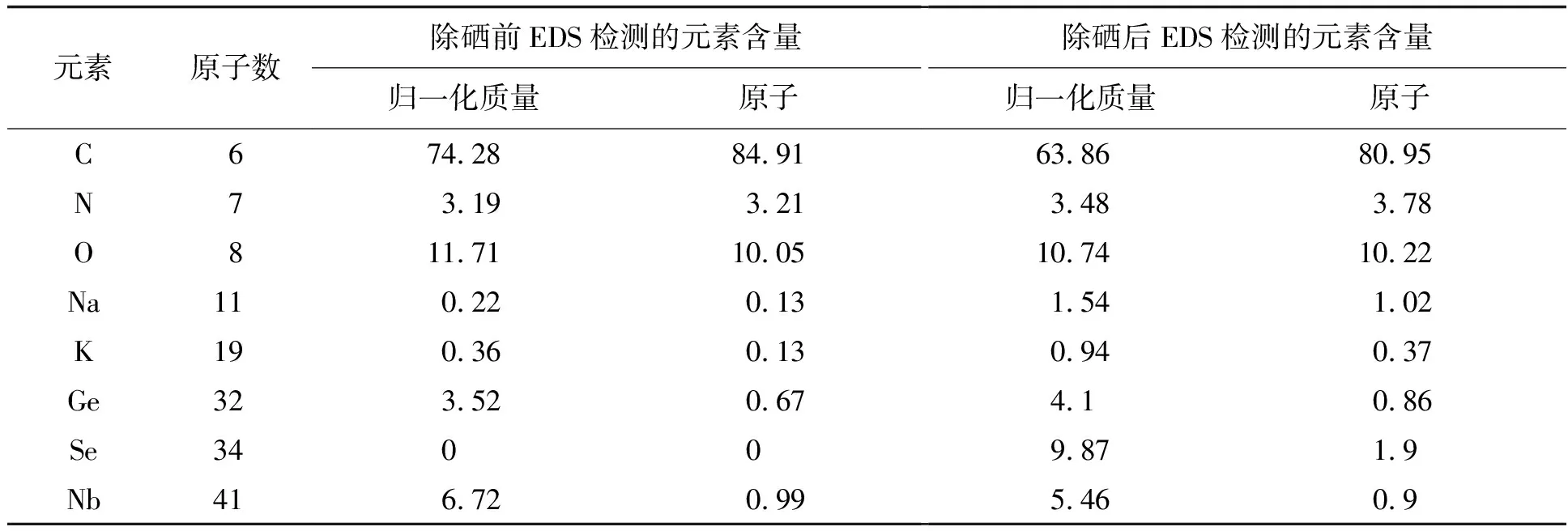
表3 EDS检测的元素含量
3 结 论
1)分离获得4株亚硒酸盐还原菌,均具有很强的亚硒酸耐受能力,在7 mmol/L(553 mg/L)的亚硒酸浓度下生长良好,分子生物学鉴定发现4株细菌均为芽孢杆菌属(Bacillus)。
2)4株亚硒酸盐还原菌具有良好的除硒能力,它们在18 h内对33 mg/L亚硒酸钠去除率均高于99.7%;B菌在75 h内对高浓度亚硒酸钠(197.5 mg/L)去除率在达到91.2%。
3)扫描电镜能谱(SEM-EDS)分析表明,细胞在高浓度含硒废水处理下形态完整,细胞表面存在硒元素。红外光谱(FTIR)分析表明,酰胺基及羟基团在细菌吸附除硒中起重要作用。
