肾脏上皮样血管平滑肌脂肪瘤的临床特点分析
2020-07-16方辉龙杨元兴李黎明
方辉龙,杨元兴,李黎明
(天津医科大学总医院泌尿外科,天津300052)
肾脏血管平滑肌脂肪瘤(angiomyolipoma,AML)通常被认为是一种良性错构瘤,世界卫生组织(world health organization,WHO)在2004年发布的肾脏肿瘤组织学分类中指出,有两种类型的肾脏AML:经典型和上皮样。经典型AML 是良性肿瘤,由不同比例的脂肪组织、异常增生的血管和平滑肌细胞构成。上皮样AML 的组织学特征与经典型AML 不同,它主要由上皮样细胞组成,并且含有经典型AML的3种成分,脂肪成分少。肾脏上皮样血管平滑肌脂肪瘤(epithelial angiomyolipoma,EAML)被认为是潜在的恶性间叶性肿瘤,部分患者可能存在局部复发、淋巴结转移和远处转移风险,预后不良。由于EAML发病率较低,在临床上少见,目前临床医生对其疾病的认识是不足的。本研究收集天津医科大学总医院2012年6月-2018年11月入院手术治疗的10例EAML 患者的临床资料,进行病例总结和分析,以系统地阐明EAML 的临床表现、影像特点、病理特征、治疗和预后。
1 资料与方法
1.1 临床资料 回顾性分析天津医科大学总医院在2012年6月-2018年11月收治的EAML 患者的临床资料,共10例患者。其中女性9例,男性1例。年龄最大69 岁,最小17 岁,平均年龄36 岁。10例患者既往均无结节性硬化症病史。临床表现为患侧腰部疼痛或胀痛不适6例,其中1例入院后出现高热、寒战,1例伴有恶心、呕吐;右侧上腹部疼痛2例,其中1例伴有呕吐;腹胀、腹痛伴无痛性肉眼血尿1例;左上腹肿物进行性增大,伴腹胀1例;3例在体检时发现,其中1例伴有低热。入院后术前化验尿常规潜血阳性4例,血常规化验血红蛋白提示贫血5例,肾动态显像提示患侧肾功能受损3例。其余化验检查未见明显异常。
1.2 方法
1.2.1 影像学检查 所有患者术前行影像学检查,肿瘤位于右侧6例,左侧4例。肿瘤直径最大约15.1cm,最小约3.1 cm,平均直径约9.8 cm。10例均行彩超检查,超声提示囊实性包块4例,混杂低回声团块、其内可见液性暗区1例,回声不均匀、内可见无回声区的中强回声包块3例,中低回声团块1例,较强回声团块1例。7例超声提示肿块边界较清楚,1例肿块包膜稍厚不光滑,2例超声未描述肿块边界情况。所有患者CT 平扫可见肿块内含有脂肪成分5例,7例行CT 增强检查,2例增强后呈明显强化,1例中度强化,2例不均匀强化,2例未见明显强化,4例肿块边界欠清(图1)。所有患者均未见肾静脉、下腔静脉血栓,未见淋巴结和远处转移。本组患者仅有3例行MRI 检查,表现为等T1短T2信号影,呈不均匀增强。根据彩超、CT 或MRI 影像学检查,结合临床症状,术前诊断肾脏血管平滑肌脂肪瘤6例,其中5例合并出血,诊断肾脂肪肉瘤1例,诊断肾癌1例,诊断腹膜后恶性肿瘤1例,诊断肾囊实性占位,考虑肾积脓可能性大1例。
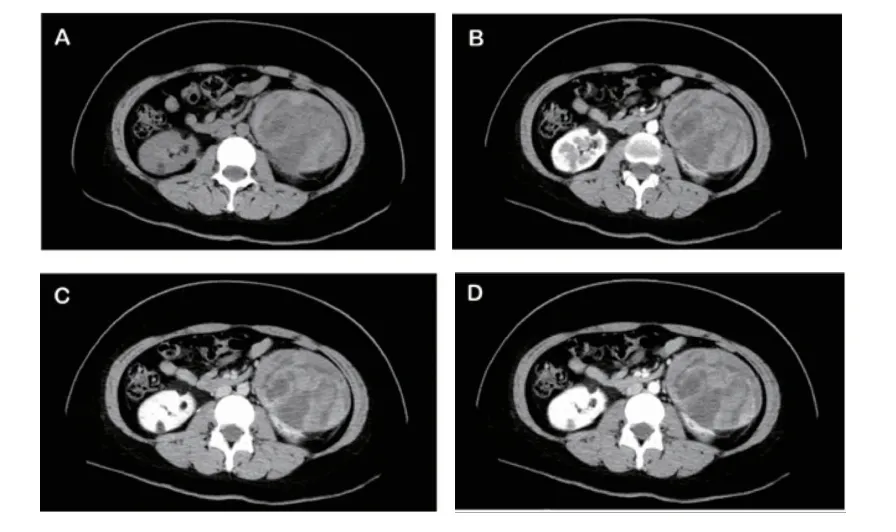
图1 肾脏CT 平扫和增强Fig 1 Renal CT plain scan and enhancement
1.2.2 手术方法 10例均采用手术切除治疗。1例术前考虑右肾癌,肿瘤大小约3.1 cm×2.5 cm,考虑肿瘤体积较小,同时为了更好的保留患者的肾功能,采取“腹腔镜右肾部分切除术”;1例术前考虑右肾脂肪肉瘤,术中探查发现肿瘤基底与肾脏背侧关系密切,无法分离,将肿物大部游离后予以切除,送冰冻病理检查,冰冻病理结果考虑脂肪肉瘤,手术行“右肾根治性切除术”;1例术前诊断肾囊实性占位,肿瘤大小约12.8 cm×10.9 cm,患者入院后第1天即出现高热、寒战,给予抗感染、退热等处理,入院后第2 天在超声引导下行“右肾区囊性占位穿刺术”,并留置引流管,引出脓液送细菌培养,继续给予抗感染、退热、补液等处理,患者仍反复发热,临床考虑肾积脓可能性大,遂于入院后第4 天行“右肾切除术”。1例术前考虑左腹膜后恶性肿瘤,术中发现肿瘤后上方约直径2.0 cm 范围与左肾下极延续,难于分离,距侵犯处约1.0 cm 楔形切除左肾下极肾组织,此患者手术方式为“左腹膜后肿物切除+左肾部分切除术”。术前考虑肾脏AML 合并出血5例,其中2例行“腹腔镜肾部分切除术”,3例行“开放性肾部分切除术”。术前1例未出血的肾脏AML 行“腹腔镜肾部分切除术”。
2 结果
2.1 病理诊断及免疫组化结果 多数肿瘤大体标本呈灰褐色、灰黄色,切面呈灰黄、灰红、灰褐色相间,部分病灶内部可发生出血、坏死以及囊性变。其中5例肿瘤标本可以见到局部出血灶以及坏死组织,1例肿瘤标本可见继发性慢性脓肿形成,3例肿瘤可见异型细胞成份,核分裂象可见。10例病例均行HMB-45 和SMA 免疫组化染色。在HMB-45染色中,8例呈阳性反应,1例广泛阳性,1例少数细胞阳性。在SMA 染色中,5例呈阳性反应,2例部分阳性,1例弥漫阳性,1例弱阳性,1例阴性。10例标本中有6例行Melan-A 染色,5例呈阳性反应,1例部分阳性(图2)。10例EAML 患者的术后病理免疫组化标志物的表达结果如表1 所示。根据病理标本的常规染色和免疫组化染色结果,8例病理诊断为肾脏EAML,2例病理诊断为肾脏AML,部分呈EAML(表2)。
2.2 治疗及随访结果 10例患者均采取外科手术切除治疗,术后均未采用化疗药物、靶向药物或哺乳动物雷帕霉素靶蛋白抑制剂等治疗。对10例患者通过门诊复查以及电话随访的方式进行术后随访,随访时间截止至2019年7月,10例患者中有8例获得随访,有2例失随访,术后随访完成率80%。8例随访患者的术后随访时间为7~50 个月,平均随访时间28 个月。随访的8例患者目前均存活,根据术后复查的相关影像学检查,暂未见肿瘤复发和远处转移。
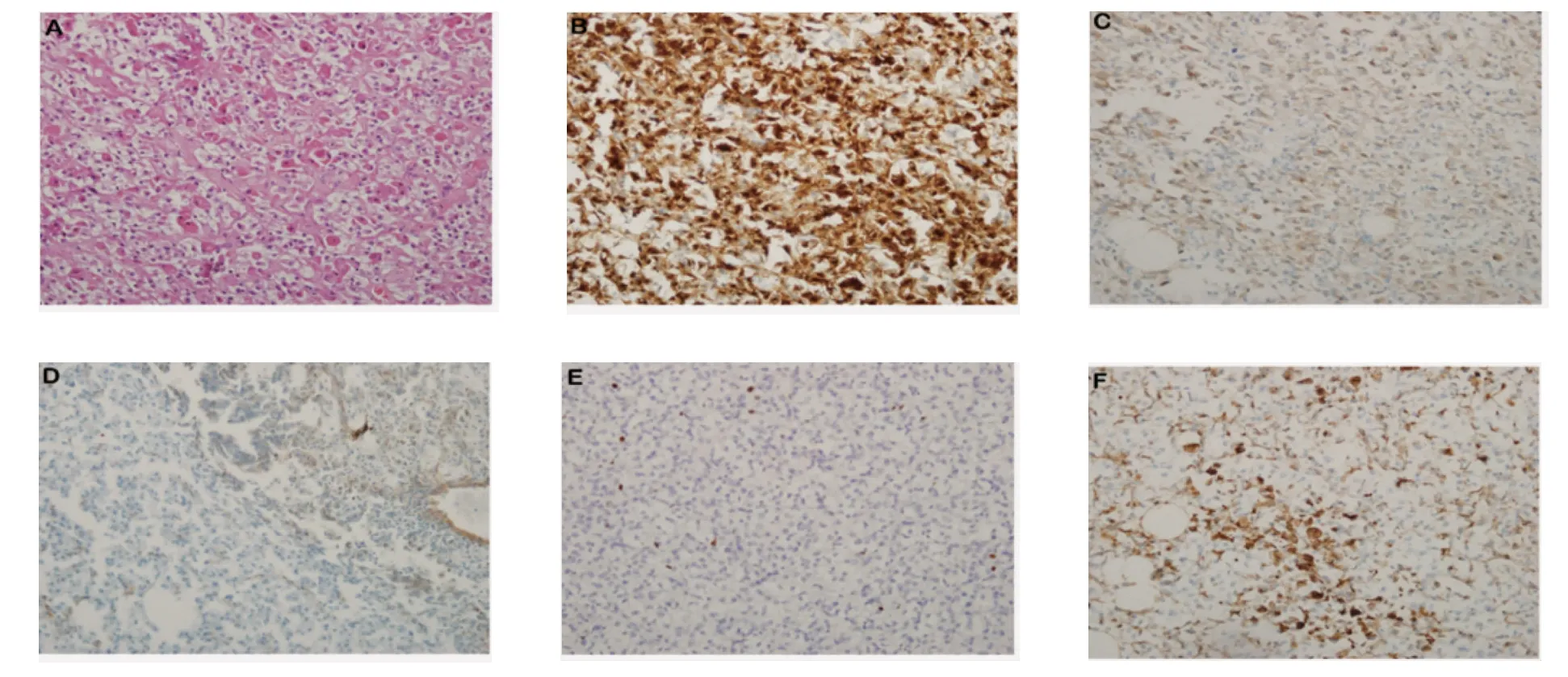
图2 病理HE 染色和免疫组化染色Fig 2 Pathological hematoxylin-eosin staining and Immunohistochemical staining
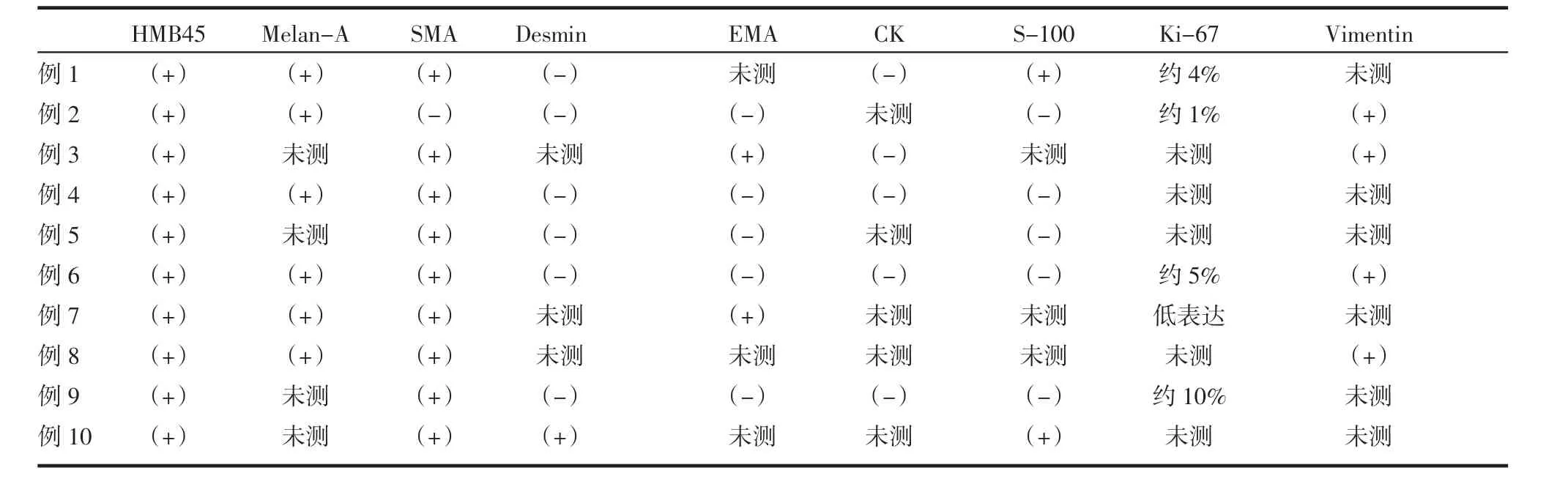
表1 免疫组化标志物在10例EAML 中的表达结果Tab 1 Expression results of immunohistochemical markers in 10 cases of EAML

表2 10例EAML 患者的术前诊断与病理结果Tab 2 Preoperative diagnosis and pathological results of 10 patients with EAML
3 讨论
EAML 由Mai 等[1]在1996年首次报道。经典型AML 是良性肿瘤,主要由不同比例的脂肪组织、异常增生的血管和平滑肌细胞构成,缺乏上皮细胞成分。而EAML 与经典型AML 相比,其上皮细胞比例明显增多,且缺乏脂肪成分。随着病理和影像医学技术的进展,越来越多的EAML 被诊断,使临床医生对EAML 有了更加深刻的认识。有研究发现,EAML较经典型AML 的发病年龄更小,肿瘤体积更大[2]。本研究平均发病年龄为36 岁,肿瘤平均直径约9.8cm,与该文献相符。也有文献指出EAML 在女性中更常见(男女比例为1:3),EAML 的性别差异可能与雌激素刺激有关,因为上皮样细胞对孕酮受体的免疫组化呈阳性反应[3]。本研究女性9例,男性1例,女性明显多于男性。EAML 是一种间叶性肿瘤,具有恶性潜能,EAML 患者中有一半以上与结节性硬化症(tuberous sclerosis,TSC)有关,EMAL 患者合并TSC 的比例明显高于经典型AML[4]。TSC 是一种常染色体显性遗传疾病,其特征在于可出现全身多发良性肿瘤,包括脑、皮肤、眼、心脏、肺和肾等器官均可受累。
3.1 临床表现 EAML 患者起病隐匿,早期常无症状,常于体检的影像学检查中发现肾脏肿瘤。随着肿瘤的增大,压迫或侵袭肾盂、肾盏以及周围组织器官时,可出现腰痛、腹痛和血尿等临床症状,可能会发生出血并导致不良后果。在本研究的10例患者中,3例于体检时发现,7例因有临床症状而就诊,包括患侧腰腹部疼痛、肉眼血尿、腹部肿块等症状。有研究指出患者年龄越小,肿瘤体积越大,肿瘤破裂出血的风险越高,肿瘤大小是影响肿瘤出血的最重要因素[5]。本研究患者年龄较年轻(平均年龄36岁),肿瘤体积较大(平均直径约9.8 cm),7例有症状患者的肿瘤直径大于4.0 cm,5例出现肿瘤破裂出血,并且直径均大于4.0 cm。这些数据表明患者的肿瘤越大,产生临床症状的概率就越大。由于EAML 缺乏特异性的临床表现,在临床上经常与肾癌等肿瘤相混淆。因此,临床上需要影像学检查辅助诊断,术后病理进一步明确诊断。
3.2 影像学特点 EAML 的影像学特征不同于经典型AML、肾细胞癌和肉瘤。经典型AML 可以通过影像学中的脂肪成分来诊断。然而,由于EAML 成像时缺乏可见的脂肪成分,常被误诊为肾癌。如果在影像学上发现病灶内同时存在钙化灶和脂肪,应首先考虑肾癌的可能性大,因为EAML 病灶中很少含有钙化灶。通过对现有文献的回顾,尽管有关EAML影像学表现的文献报道较少,但是以下这些影像学特点可能为EAML 提供诊断思路:(1)彩超显示为实性肿物回声不均匀,多为缺乏脂肪的肿物,CDFI 可见丰富的血流信号,边界较清晰;彩超显示为囊实性肿物回声不均匀,多为富含脂肪的肿物,CDFI 可见少量血流信号,边界较模糊[6]。(2)CT 平扫呈稍低密度或者稍高密度,边界清晰,缺乏脂肪成分,CT 增强动脉期具有明显或较明显均匀强化,少数轻度强化,强化方式为快进快出,部分肿瘤病灶内可见血管影[7]。但也有文献报道指出CT 平扫的密度比正常肾实质的密度更高,CT 增强呈明显不均匀强化,强化方式为快进慢出[8]。(3)MRI 具有一定特征性,主要为病灶在T2WI 上表现为低信号,增强后呈不均匀强化[9]。本研究彩超所示大多数肿块边界较清楚,超声可见囊实性或不均匀实性病灶。本研究10例CT平扫可见病灶呈低密度或者稍高密度影,病灶内可见脂肪成分5例,7例CT 增强检查,5例可见不同程度的强化。由于MRI 检查耗时长,价格较昂贵,本研究的患者术前行MRI 检查例数少,10例患者当中仅有3例行MRI 检查,表现为等T1短T2信号影,1例MRI 增强检查呈不均匀强化。鉴于该病的影像学表现形式不一,且经常与肾癌等肿瘤的影像学表现相混淆,仅靠影像学难以正确诊断,因此还需要病理学做进一步明确诊断。
3.3 病理特征 目前诊断EAML 的主要依据仍然是病理HE 染色和免疫组化染色。肿瘤大体标本为无明显包膜的实性或囊实性肿物,质地中等,切面为灰黄色或者灰白色相间,部分病灶内部可发生出血、坏死及囊性变。肿瘤可通过肾静脉或腔静脉转移至远处器官,常见的转移器官包括肝脏和肺部,癌样生长模式和肾静脉受累提示肿瘤恶性程度较高[10]。EAML 由血管组织、上皮样平滑肌细胞和脂肪细胞按不同的比例构成,主要以上皮样细胞为主,上皮样细胞围绕血管周围排列,常呈套袖状和巢索状。上皮样细胞主要呈多边形或圆形,细胞质丰富,胞质存在嗜酸性颗粒,细胞核大,核质比例高,核仁明显,有时可见有丝分裂。部分区域的上皮样肿瘤细胞可见异型成分,并且可见病理性核分裂像。少数存在可见的多核巨细胞。EAML 的免疫组织化学染色对黑色素细胞标志物(HMB-45、Melan-A)和平滑肌细胞标志物(smooth muscle actin,SMA)呈阳性反应,但对上皮细胞标志物(cytokeratin,CK)呈阴性反应[8]。本研究的免疫组化结果显示:所有10例HMB-45 染色呈不同程度阳性,其他恶性肿瘤如肾细胞癌和肉瘤不表达HMB-45,可与其鉴别;10例中有6例行Melan-A 染色均呈阳性反应;在10例SMA 染色中,除外1例阴性反应,其余皆为不同程度阳性;10例中有5例行CK 染色均呈阴性反应。本研究的这些免疫组化标志物与文献报道相符,有助于EAML 的诊断。另有研究报道3例EAML 并指出上皮细胞钙黏蛋白(E-cadherin)和β-连环蛋白(β-catenin)可能是EAML 免疫组化染色的另一个指标[11]。EAML 与经典型AML 相比可见更多的细胞核分裂像,有丝分裂更加活跃,P53 的表达率更高,高表达P53 可能与EAML 的恶性行为相关[12]。由于Ki-67 参与细胞的增殖,它被认为是肿瘤增殖活性的指标。有研究表明,Ki-67 可能是诊断恶性EAML的标志物[13]。然而,本研究Ki-67 的诊断敏感性较低,因为10例中只有5例行Ki-67 染色,且范围只有约1%~10%。
3.4 治疗方法 手术是EAML 的首选治疗方法。对于手术方式的选择主要是根据肿瘤的大小、肿瘤是否侵袭到肾盂以及双侧的肾功能受损情况。手术方式分为肾切除术和肾部分切除术。根据本研究的经验,对于>4.0 cm 的肿瘤,肾切除术是理想的治疗方法;对于≤4.0 cm 的肿瘤,应采用保留肾单位的肾部分切除术。在选择进行肾部分切除术的病例时,必须考虑肿瘤在肾脏的位置。手术治疗的原则是在完整切除肿瘤的基础上,尽可能的保留肾脏的功能。本研究中10例患者,8例行肾脏部分切除术,2例行肾脏切除术。由于EAML 具有恶性潜能,术后可能产生局部复发或远处转移,需要综合治疗,除手术外,其他的辅助治疗方式包括化疗、mTOR 抑制剂和靶向药物治疗。目前对于化疗药物的敏感性仍然是有争议的。EAML 被认为是血管周围上皮样细胞肿瘤(perivascular epithelioid cell neoplasms,PEComa)家族,可能对化疗药物敏感。但是也有报道称EAML对多柔比星和顺铂化疗药物没有反应[14]。研究发现部分EAML 患者存在TSC2 基因突变,导致mTOR受体通路激活,可辅助应用mTOR 抑制剂如雷帕霉素、依维莫司治疗EAML[15]。有文献报道,对于转移性EAML,使用mTOR 抑制剂治疗具有临床效果[16]。国内有文献报道1例EAML 伴远处转移的患者使用舒尼替尼靶向药物治疗,初始可见转移病灶缩小,但后期肿瘤仍进一步发展[17]。目前仍然缺乏关于化疗、mTOR 抑制剂和靶向药物治疗效果的大样本临床研究验证和随访。本研究10例患者均未采取化疗、mTOR 抑制剂和靶向药物治疗。
3.5 预后 EAML 主要由上皮样细胞组成,被认为是具有恶性潜能的肿瘤,为了更好的预测患者的预后,一些研究介绍了恶性EAML 的预测模型。Brimo等[18]总结了40例EAML,认为:(1)≥70%非典型上皮样细胞;(2)每10 个高倍镜视野中可发现至少有2 个有丝分裂数;(3)出现非典型有丝分裂;(4)坏死;出现以上3 个或所有特征者具有恶性潜能。也有研究总结了8 个潜在恶性指征包括:肿瘤直径≥5.0 cm、存在远处转移、周围浸润、坏死、非典型上皮样细胞≥50%、异型性细胞、非典型有丝分裂和血管侵袭;上述≥5 个特征共存提示恶性EAML 可能性大[19]。目前对于影响预后的因素尚没有统一的标准,考虑EAML 的恶性潜能,建议对EAML 的患者进行长时间密切随访。虽然EAML 可能是恶性的,偶尔会有相邻的组织侵袭和转移,但也有研究表明,EAML 的预后是良好的,术后随访数年未见复发或转移[20-21]。本研究术后随访8例患者,术前影像学检查均未发现远处转移,术后病理检查有3例肿瘤可见异型细胞成分,核分裂象可见。术后随访时间为7~50 个月,平均随访时间28 个月。随访期间均未发现有远处转移和复发者。
本研究有一定的局限性:首先,这是一项回顾性的研究,由于该疾病的罕见性,前瞻性研究设计难以进行;其次,鉴于本研究病例数量少,平均随访时间较短,本研究随访的患者术后均未发生转移和复发可能不具有代表性。因此,来自前瞻性、大样本、多中心的研究数据可能更有说服力,更能揭示该疾病的临床特点。
综上所述,EAML 是具有恶性潜能的肿瘤,临床上少见,其恶性潜能可能与肿瘤大小、细胞异型性和异常的有丝分裂等因素相关,少数患者可出现远处转移。EAML 早期症状不明显,主要通过影像学检查进行术前诊断,但容易与肾癌等其他肾脏肿瘤相混淆,需注意鉴别。术后病理HE 染色和免疫组化染色可进一步明确诊断。治疗方法包括手术和辅助治疗(化疗、mTOR 抑制剂和靶向药物),目前仍缺乏关于辅助治疗效果的大样本临床研究验证和随访,治疗上主要以手术切除为主,在尽可能的保留肾脏功能的基础上完整地切除肿瘤。目前预后尚无统一认识,需要对患者进行长时间密切随访。
