小儿急性坏死性肠炎致消化道多发穿孔1 例
2020-07-15王鑫慧董亮郭志平
王鑫慧,董亮,郭志平
(1.天津医科大学研究生院,天津300070;2.天津市儿童医院微创外科,天津300134;3.天津市儿童医院急创外科,天津300134)
急性坏死性肠炎(acute necrotizing enteritis,ANE)是以小肠急性广泛性、出血性、坏死性炎症为特征的消化系统急症,各年龄组小儿均可发病,以3~12岁学龄儿童多见,男孩多于女孩,农村多于城市。起病急骤,病情变化快,重症患儿可出现败血症和中毒性休克,经积极抢救,死亡率仍可达30%[1]。2016年3 月天津市儿童医院外科收治1 例ANE 致消化道多发(25 处)穿孔患儿,现将诊治经过报道如下。
1 临床资料
患儿,女,5 个月,因“发热,精神弱6 d,腹泻5 d,呼吸促1d”入院。患儿入院前6 d 出现发热,体温最高40℃,予退热药后可降至正常,每日予4次退热药,不伴寒战、抽搐、皮疹,精神较弱,睡眠多,入院前5 d 出现腹泻,大便4~5 次/d,黄绿色稀便,入院前2 d 出现进食后呕吐,为胃内容物,无咖啡色样物及胆汁,入院前1 d 出现呼吸促,哭闹后面色发青。于当地医院就诊,查腹部B 超示:肠系膜淋巴结肿大,腹腔积液,治疗1 d 后,无明显好转,为进一步诊治收入我院内科ICU 病房。
查体:神清、精神反应弱、呼吸促、无发绀。前囟平软,双肺呼吸音促,可闻及痰鸣音,心音有力,律齐,心率170 次/min。腹软不胀,未及包块,肝肋下3 cm 可及,双侧巴氏征(-)。体温37.3℃,血压80/50 mmHg,脉搏170 次/min,呼吸45 次/min。血常规:HGB 89 g/L,WBC 7.63×109/L,PLT 76×109/L,CRP>200 mg/L;静脉血气:pH7.38,HCO3-14.8 mmol/L,BE-9.2 mmol/L;电解质:钠138.9 mmol/L,钾3.46 mmol/L,氯103 mmol/L,CO215.2 mmol/L,葡萄糖4.6 mmol/L;便常规:黄稀便,OB(+),镜检RBC 2~4个/HPF,WBC 6~8 个/HPF;胸腹联合X-ray:心肺膈无著变,腹部致密,腹腔积液不除外;B 超:肝脏增大,腹水(少量)。心电图:窦性心动过速,大致正常心电图。入院初步诊断:(1)脓毒症;(2)心力衰竭;(3)感染性腹泻;(4)发热精神弱原因待查:颅内感染?入院当日,予头孢曲松抗感染,纠酸,多巴胺升压,地高辛强心对症治疗;入院第1 天,患儿体温正常,饲奶水未吐,大便10 余次,为黄稀便。查体:心率130~150 次/min,腹软不胀。腰穿及脑脊液检查基本正常。复查血常规:HGB 93 g/L,WBC 9.47×109/L,中性58%,PLT 28×109/L,CRP 151 mg/L,PCT 35.58 ng/mL;复查血气基本正常。继续头孢曲松抗感染治疗,口服斯沃联合抗感染治疗,予血小板对症支持治疗。第2 天,体温正常,饲奶水未吐,大便6 次,性状较前成形。复查肝功能正常,CRP 124.7 mg/L,PCT 25.58 ng/mL,便病原体:CB-Ag、RtV、AdV(-)。治疗同前。第3 天,体温最高38.5℃(傍晚出现),饲奶水未吐,大便3 次且成形。查体:腹软不胀,无明显压痛及肌紧张。便培养未检出致病菌。腹平片未见异常,腹部B 超未见腹水征。第4 天,患儿体温晨起38℃,午后最高39.4℃,饲奶水有呕吐。查体:腹膨隆,触诊质韧,腹胀,肌紧张(+),心率160 次/min。复查血常规:HGB105 g/L,WBC40.87×109/L,中性75.8%,淋巴14.6%,PLT 154×109/L,CRP 57 mg/L。外科会诊:禁食,胃肠减压,查立位腹平片示膈下有气体,肠穿孔可能(图1)。
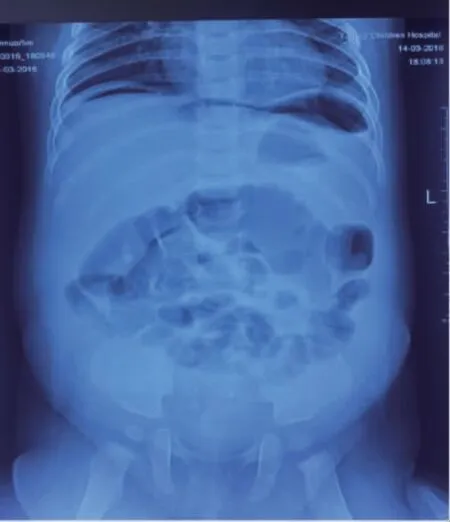
图1 立位腹平片示膈下有气体,肠穿孔可能
转外科后行剖腹探查术,术中见腹腔内大量黄绿色渗液,量约300 mL,含大量粪质。探查胃及十二指肠未见异常,探查小肠自空肠起始部3 cm 至远端小肠约100 cm 范围可见25 处穿孔,直径2~5 mm(图2),肠壁及肠系膜均肿胀,穿孔处肠壁糜烂、水肿、僵硬,穿孔周围肠管血运良好。远端小肠至回盲部尚余90 cm 肠管血运良好,未见穿孔。术中考虑坏死性小肠炎,多发小肠穿孔,病变肠管过长,完全切除后易致短肠综合征。遂逐个修补穿孔肠管,于最远端穿孔肠管处行单孔造瘘术,清理腹腔渗液,于左右结肠旁沟及盆腔各置引流胶管1 根。
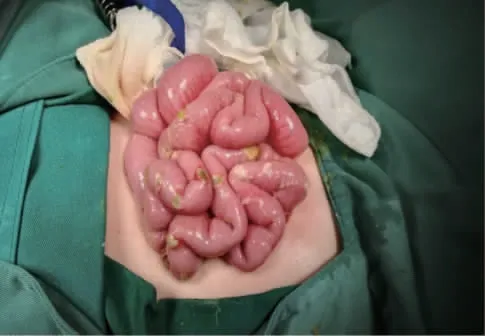
图2 小肠25 处穿孔
术后禁食13 d,胃肠减压,静脉补足液量及热量,补充胶体液,止血、抗感染、静脉高营养等对症支持治疗,术后31 d 患儿病情平稳出院,术后45 d行造瘘闭合术,术中见之前穿孔修补处肠管血运良好,关瘘术后患儿恢复良好,进食排便均无异常,顺利出院。随访3 年,患儿恢复良好(图3)。

图3 腹部伤口愈合良好
2 讨论
ANE 最初报道于战后的德国和新几内亚,低蛋白饮食引起的肠道内胰蛋白酶水平降低(分泌一种胰蛋白酶抑制剂)造成Clostridium Welchii(C 型产气荚膜杆菌)感染是主要发病原因,该菌是一种耐热细菌,Welchii 杆菌产生的β-毒素(Clostridium perfringens β,CPB)能引起肠黏膜组织坏死,导致ANE[2-4]。1980 年,Arseculeratne 等[5]提出ANE 的发病机制与肠道过敏反应有关。Chandrasekharam 等[6]也发现切除的小肠组织存在Ⅰ型和Ⅲ型过敏反应,表明免疫介导的损伤会导致严重的血管炎,进而导致肠壁缺血性损伤。但该研究中,不论是肠壁还是受感染的肠内容物,并未分离出Welchii 杆菌,有力地证明了ANE 存在除Welchii 杆菌感染以外的其他病因。北京友谊医院儿科对80 例ANE 患儿的粪便做了细菌培养,结果病原菌多种多样,未发现任何特异病原。他们认为任何细菌引起肠道不能控制的严重感染,最终都有可能导致ANE[7]。而本例患儿也并未培养出Welchii 杆菌。2014 年,Ma 等[8]通过家兔小肠循环实验,发现许多ANE 菌株也表达产气荚膜杆菌肠毒素(Clostridium perfringens enterotoxin,CPE),提示CPE 可能是ANE 的另一个致病因子。另外,新生儿期窒息缺氧、饮食因素或肠道急性微循环障碍都可诱发ANE。因此,目前多数学者认为ANE 的病因是多病原、多因素造成的,是非特异性的。ANE 是各种病原或因素发展到严重阶段的结果[7]。
ANE 是一种好发于小肠的急性出血坏死性炎症,病变主要累及空肠下段和回肠上段,故也称急性出血坏死性小肠炎。偶尔也可累及十二指肠和结肠,甚至全消化道。常见于发展中国家,但在发达国家很少见,其发生仅限于患有慢性疾病的成年人[9]。全年均可发病,以夏秋季高发。任何年龄均可发病,儿童为主要发病对象,青少年次之,男性多于女性,农村多于城市。ANE 的爆发流行常发生于蛋白质缺乏、食品条件差的地区。20 世纪,国外有两次本病的爆发流行,除此之外多为散发[7]。患儿急性起病,一般无前驱症状。发病前多有不洁饮食史,如摄入变质肉类、腐烂水果、生甘薯等,或有暴饮暴食史。可有受冷、劳累、肠道蛔虫感染及营养不良等诱发因素。主要表现为腹胀、腹痛、血便、呕吐、发热及全身中毒症状[10]。腹部压痛点不固定,有发热,伴有全身中毒症状,重者并发休克。起病初为稀便,然后出现血丝便、血水便、果酱样便或脓血便,亦可呕吐咖啡样物质。随着病情恶化,腹胀逐渐加重,严重者表现为麻痹性肠梗阻。严重病例常合并DIC,可合并肠穿孔、腹膜炎、中毒性肝炎及中枢性呼吸衰竭。腹部体征相对较少。早期可有不固定的压痛点,腹稍胀,但仍柔软,肠鸣音亢进。麻痹性肠梗阻时,腹胀明显,肠鸣音消失。腹膜炎时可有腹肌紧张、压痛、反跳痛。肝浊音界消失,提示已发生肠穿孔。由于肠壁各层病变程度不同,临床上将小儿ANE 分为腹泻便血型、肠梗阻型、腹膜炎型和中毒休克型[7]。依据临床表现,应注意与中毒型菌痢、肠梗阻、肠套叠、急性胃肠炎、伪膜性肠炎、溃疡性结肠炎等疾病相鉴别。溃疡性结肠炎痉挛性腹痛常于便前及便时发生,便后缓解。左下腹触痛明显,可有肌紧张或触及硬管状结肠。克罗恩病多局限于乙状结肠和降结肠,腹绞痛和压痛部位多见于左下腹,并有明显里急后重感,便血较少,一般无毒血症症状。小肠扭转多有暴饮暴食或饱餐后立即剧烈运动等诱因;肠套叠多见于婴儿,腹部可触及肠套肿物。肠道特异性感染,常见的有细菌性或阿米巴性痢疾。细菌性痢疾常急性起病,表现为腹痛、腹泻、发热,大便为黏液脓血便,镜检见红细胞、白细胞和脓球等,常伴有明显的里急后重,很少有大量血便;阿米巴痢疾急性期可表现为血性腹泻,镜检很容易找到阿米巴滋养体[11]。
本例患儿5 月龄,临床症状和体征不典型。由于缺乏特异性诊断手段,早期易误诊,入院后未禁食,导致病情加重,造成小肠多发穿孔的发生。目前,诊断ANE 主要依据临床表现,结合实验室检查和辅助检查。血常规可见白细胞增多,甚至超过40×109/L,以中性粒细胞增多为主,常有核左移。凝血功能异常,常合并DIC 表现,血电解质紊乱。便常规呈暗红或鲜红色,或潜血试验阳性,镜下可见大量红细胞、少量或中量白细胞或脓细胞,偶可见脱落的肠黏膜。便培养多无细菌生长,少数可培养出梭状芽胞杆菌、大肠埃希菌、变形杆菌等。便培养需时较长,一般要7~10 d,不能及时为临床提供细菌学诊断根据[10]。最常用的辅助检查是腹部X 线平片,通过分析肠管形态改变、肠间隙改变、肠管内积液情况、肠壁积气及门静脉系统积气、腹腔积液及气腹,对ANE 做出诊断。主要特征是肠腔扩大,但大小不一;肠壁增厚,但厚薄不一;皱襞变粗,但粗细不一[12-14]。本例患儿入院第3 天复查腹部平片仍未见异常,可能是小肠病变程度轻,穿孔直径小,甚至穿孔后局部网膜包裹、肠黏连封闭穿孔,从而阻止了肠内气体经由穿孔部位进人腹腔,因此腹部平片膈下游离气体不明显,甚至无游离气体,容易漏诊,延误手术时机[15]。因此,没有气腹不能除外消化道穿孔,但存在气腹不一定全是穿孔,可能是纵隔气肿或腹腔产气菌感染所致,胸腹部联合摄片有特殊意义[16-17]。另外,腹部X 线平片发现游离气体诊断消化道穿孔的阳性率只有63%,为提高诊断率,可以借助其他广泛的影像技术[18-21]。超声检查可见病变部位小肠肠壁有不同程度局限性增厚、肿胀、回声减低,呈“双层”壁,多呈节段性跳跃式分布。该段肠腔相对狭窄、变细,肠壁蠕动明显减弱,腹腔内肠系膜淋巴结明显肿大,呈集群串珠样分布。同时超声可重复多次追踪复查,动态观察患者病情变化和治疗效果,及时把握手术时机[22-23]。腹部CT 诊断肠穿孔准确率高达82%~90%,特别是与胃肠道壁有关的感染性或炎性、肿瘤性或创伤性的患儿,加碘静脉造影剂可以帮助检测病理[19]。多层螺旋CT 通过特定的空气分布(门静脉周围空气和膈下空气)和强预测因子(灶壁缺损和腹水)准确预测肠穿孔部位,从而改变治疗计划[24]。因此,影像学研究对早期诊断ANE 和发现肠穿孔至关重要,并可提供有关穿孔部位和损伤程度的重要信息。通过仔细评估肠壁的增强模式、所涉及的肠管长度、肠壁增厚的程度和损伤部位,为缩小鉴别诊断提供重要线索[19]。
目前ANE 治疗以非手术抗休克为主,配合全身支持治疗,早期联合使用抗生素,纠正水电解质平衡紊乱,解除中毒症状,积极防止其他并发症的发生。有学者采用Welchii 杆菌抗毒血清4 200~8 500 U 滴注治疗本病,取得较好疗效[10]。未来可对此方法展开进一步研究,以尽早对该病做出预防。剖腹探查术治疗ANE 的目的包括控制感染,切除坏死肠管及尽可能保留足够长度的肠管。根据肠管病变程度和范围,专家共识是局灶型病例应首选坏死肠管切除+肠造瘘术,个别全身情况稳定的局灶型病例可行坏死肠管切除+Ⅰ期肠吻合术;对于多发病灶型病例首选单纯性近端小肠造瘘术[12]。该病例中,探查发现小肠自空肠起始部3 cm 至远端小肠约100 cm 范围可见25 处穿孔,远端小肠至回盲部尚余90 cm肠管血运良好,未见穿孔。由于病变肠管过长,考虑完全切除易致短肠综合征,遂逐个修补穿孔肠管,且远端肠管血运良好,于最远端穿孔肠管处行单孔造瘘术。对于回肠末端造瘘,经2~3 个月的适应期,回肠末端可部分结肠化,患儿可耐受长期造瘘,一般3~6 个月后行关瘘术[13]。但该患儿在造瘘术后39 d,因食欲差2 d 伴尿少再次入院。可能与小肠造瘘造成患儿营养不良,免疫力降低有关,出现了术后并发症[25]。因此在造瘘术后45 d 被迫进行了关瘘术。术后6 d 给予逐步进食,22 d 后患儿顺利出院。总之,手术方式的选择应针对不同患儿制定个性化的治疗方案,在保证治疗效果的基础上最大程度降低并发症的发生。
ANE 是一种可能与Welchii 杆菌感染有关的肠道急性炎症,因肠管范围、病变部位不同,临床症状和体征轻重不一,又缺乏特异性诊断手段,故早期易误诊。由于早期治疗不力,后期病情变化多样,当有明显腹膜炎或腹部X 线平片有阳性表现及腹腔穿刺有陈旧性液体或血性液体时,患者已多有肠坏死和中毒性休克。中毒性休克不但掩盖了腹腔内急性病变的存在,而且易导致多脏器衰竭和DIC 的发生,增加了诊断和治疗的困难。事实上,如不经过手术治疗,正确诊断该病是极其困难的,尤其对于没有血便者。尽管如此,在临床工作中注意以下几点有助于早期诊断:(1)对突然腹痛、腹泻、血便、发热症状者,首先应考虑ANE 的可能性。(2)白细胞总数显著升高,而又难以以目前的症状、体征解释。(3)腹腔穿刺不应满足一次穿刺的结果,应密切观察腹部体征的变化,必要时反复、多点穿刺。(4)无手术史的肠梗阻症状伴稀水样便或脓血便。(5)应作常规肛诊检查,了解有无血便情况。(6)综合分析辅助检查结果与临床症状及体征,动态观察病情变化,扩展诊断思路,特别是治疗后症状改善不明显者。对诊断不明确而又有手术指征者,及时行手术探查在诊治中具有指导意义。
