褐飞虱乙酰胆碱酯酶启动子的克隆及表观遗传分析
2020-07-15方君杨潇朱利航陈俊杨之帆
方君,杨潇,朱利航,陈俊,杨之帆
(1.湖北大学生命科学学院,省部共建生物催化与酶工程国家重点实验室,湖北 武汉 430062; 2.武汉科技大学化学与化工学院,湖北 武汉 430081)
0 引言
乙酰胆碱酯酶(acetylcholinesterase,AChE)是一种胞外糖蛋白,具有核酸酶、氨肽酶和羧肽酶活性,是维持神经递质正常传递的重要成分[1].AChE也可以在动物体内除神经系统以外的其他部位合成,这些酶分子参与细胞生长、迁移、粘附和凋亡的过程[2-3].此外,抑制AChE活性将导致动物的麻痹甚至死亡[4].在昆虫体内,AChE是使用最广的氨基甲酸脂类和有机磷杀虫剂的靶标酶,AChE突变或异常表达可能是产生抗药性的原因之一,与害虫的抗药性治理密不可分[5-8].2006年克隆得到褐飞虱AChE基因,这为进一步深入研究该基因的结构、表达及功能奠定了基础[9].昆虫由于其明显的表型分化以及较小的基因组,逐渐成为研究DNA甲基化功能的重要生物学材料.在昆虫进化过程中,处于高甲基化状态的基因比低甲基化或未发生甲基化的基因更为保守,尤其是氨基酸序列,这也被认为是昆虫基因组进化中的共有特征[10].DNA甲基化为表观遗传修饰的一种主要形式,广泛存在于基因启动子区的CpG位点上,对基因的表达调控具有重要作用[11].对蜜蜂[12-13]、褐飞虱[14]、果蝇和家蚕[15]等昆虫的研究发现,昆虫中不仅存在大量DNA甲基化现象,而且参与调控众多生物学过程.以往对导致昆虫产生多型性(多种生物型)因素的研究主要集中在环境因素影响上,昆虫的表型因适应环境变化而改变,即产生昆虫的多型性[16].但是对于昆虫产生多型性的分子机制的研究仍鲜有报道.目前表观遗传被认为是导致昆虫产生多型性的重要因素之一,特别是已证实DNA 甲基化参与某些昆虫多型性的调控[17].
我们克隆了褐飞虱AChE基因的启动子,并研究了生物型Ⅰ和生物型Ⅱ褐飞虱中AChE启动子的甲基化程度差异,且对比检测了AChE的表达水平,研究结果为进一步探讨AChE在褐飞虱适应环境及其生物型形成机制中的作用提供一定的参考依据,同时为防治褐飞虱提供新思路.
1 材料与方法
1.1 材料、试剂与仪器试验所用生物型Ⅰ褐飞虱饲养在感虫水稻TN1上,生物型Ⅱ饲养在抗虫水稻Mudgo上,温度为(25±2) ℃,光照周期16 L:8 D,相对湿度80%.收集4龄若虫用于提取基因组DNA和分离总RNA.
Genome walking kit、TaqDNA聚合酶、SYBRRPremixExTaqTM、EpiTaqTMHS (for bisulfite-treated DNA)和pMD18-T均为TaKaRa公司产品;甲基化DNA检测试剂盒DNA Methylation Kit为康为世纪公司产品;EpiTect® Methylight PCR Kit购于QIAGEN公司;PCR引物由武汉金开瑞生物工程有限公司合成;PCR扩增仪(WD-94020D Thermal Cycler)为北京六一生物科技有限公司产品;DNA纯化回收试剂盒为TIANGEN公司产品;全能型凝胶成像分析系统为美国Bio-Rad公司产品;其他试剂为国产分析纯.
1.2 方法
1.2.1 基因组DNA提取 取20头4龄褐飞虱若虫,采用改良的酚氯仿抽提法提取基因组DNA,溶于适量的TE buffer中,用NanoDrop 2000测其纯度,取OD260/OD280处于1.8~2.0的DNA样品置于-20 ℃储存待用.
1.2.2AChE启动子克隆 根据褐飞虱AChE的cDNA(N.lugensacetylcholinesterase type 2,accession number:XM_022332470.1)序列设计3条嵌套引物(SP1:5′-TGTAATAAGCGAGGATGCCGGTGCC-3′;SP2:5′-CTTGGTAAGGCATCTGTTGCGGACG-3′;SP3:5′-TAGCTAGGCGTACGGTTTCACTGTT-3′)按照Genome walking kit说明书依次进行3轮巢式PCR,第1轮PCR反应25 μL体系:基因组DNA 2 μL;dNTP 2.5 μL;LA DNA聚合酶buffer 2.5 μL;引物SP1 0.5 μL;引物AD 0.5 μL;LATaqDNA聚合酶0.5 μL;ddH2O 16.5 μL;反应程序:94 ℃ 1 min;98 ℃ 1 min;(94 ℃ 30 s,65 ℃ 1 min,72 ℃ 3 min)5个循环;94 ℃ 30 s;25 ℃ 3 min;72 ℃ 3 min;(94 ℃ 30 s,65 ℃ 1 min,72 ℃ 3 min,94 ℃ 30 s,65 ℃ 1 min,72 ℃ 3 min,94 ℃ 30 s,44 ℃ 1 min,72 ℃ 3 min)15个循环;72 ℃ 10 min;4 ℃ 保存.第2轮PCR反应:取第1轮PCR产物稀释50倍作为模板进行第2轮PCR;25 μL反应体系:模板2 μL;dNTP 2.5 μL;LA DNA聚合酶buffer 2.5 μL;引物SP2 0.5 μL;引物AD 0.5 μL;LATaqDNA聚合酶 0.5 μL;ddH2O 16.5 μL;反应程序:(94 ℃ 30 s,65 ℃ 1 min,72 ℃ 3 min,94 ℃ 30 s,65 ℃ 1 min,72 ℃ 3 min,94 ℃ 30 s,44 ℃ 1 min,72 ℃ 3 min)15个循环;72 ℃ 10 min;4 ℃ 保存.第3轮PCR反应取第2轮PCR产物稀释50倍作为模板进行第3轮PCR;25 μL反应体系:模板 2 μL;dNTP 2.5 μL;LA DNA聚合酶buffer 2.5 μL;引物SP3 0.5 μL;引物AD 0.5 μL;LATaqDNA聚合酶0.5 μL;ddH2O 16.5 μL;反应程序:(94 ℃ 30 s,65 ℃ 1 min,72 ℃ 3 min,94 ℃ 30 s,65 ℃ 1 min,72 ℃ 3 min,94 ℃ 30 s,44 ℃ 1 min,72 ℃ 3 min)15个循环;72 ℃ 10 min;4 ℃ 保存;产物经1.0%琼脂糖凝胶电泳检测,从凝胶中切取明亮清晰的DNA条带进行回收,与pMD18-T连接获得重组DNA分子,转化大肠杆菌感受态细胞,提质粒后测序验证.
1.2.3 MS-PCR检测启动子区域DNA甲基化 取1 μg的褐飞虱基因组DNA用甲基化DNA检测试剂盒处理,使未甲基化的胞嘧啶脱氨基转变为尿嘧啶,而甲基化的胞嘧啶不变.
根据Methprimer网站(http://www.urogene.org/cgi-bin/methprimer/methprimer.cgi)设计两对启动子区域甲基化特异性PCR引物(发生甲基化引物F-M:5′-TTTATCGAGTTAGTTGTGGAAAGTC-3′;R-M:5′-AACGATAATAAATTATACGCAAACG-3′;未发生甲基化引物F-U:5′-TATTGAGTTAGTTGTGGAAA GTTGG-3′;R-U:5′-ACAATAATAAATTATACACAAACACA-3′),在PCR管中依次加入:22 μL ddH2O;25 μL 2×Master Mix;2 μL亚硫酸氢盐处理的基因组DNA;上下游引物(发生甲基化引物/未发生甲基化引物)各0.5 μL.PCR程序如下:95 ℃ 10 min;(94 ℃ 15 s,55 ℃ 30 s,72 ℃ 30 s)循环40次;72 ℃ 10 min;4 ℃保存.反应产物用2.0%琼脂糖凝胶电泳检测.
1.2.4 BSP分析两种生物型甲基化水平 根据Methprimer网站设计AChE启动子区域甲基化BSP-PCR引物(BSP-F:GGAAAAATTATTTTTTTATTTTAT;BSP-R:TTTCACTATTTTAATAAATCTATACAAT CT).
在PCR管中依次加入:13.75 μL ddH2O;3 μL dNTP Mixture;2 μL Mg2+;2 μL 10×EpiTaqPCR buffer(Mg2+free);0.25 μL EpiTaqHS;2 μL亚硫酸氢盐处理的基因组DNA;上下游引物各0.5 μL.PCR程序如下:95 ℃ 10 min;(94 ℃ 15 s,55 ℃ 30 s,72 ℃ 30 s)循环40次;72 ℃ 10 min;4 ℃保存.反应产物用2.0%琼脂糖凝胶电泳检测.切取明亮清晰的条带进行胶回收,连接T载体pClone-007(擎科生物)后送至武汉擎科生物公司测序.
将克隆测序得到的序列与原DNA序列进行比对,用网站(http://quma.cdb.riken.jp/)进行AChE基因启动子区CpG岛的甲基化模式分析,并绘制出黑白点图.在黑白点图中,每1行代表1个克隆序列,共10个克隆序列,符合重亚硫酸盐测序的精确度要求.每1列代表1个CpG位点,黑色圈代表试验中CG 被重亚硫酸盐改变碱基即原序列中发生甲基化的位点,白色圈代表经重亚硫酸盐处理后发生碱基变化即原序列未发生甲基化的位点,×表示测序时该位点缺失.
1.2.5 RT-PCR检测两种生物型AChE基因的表达水平 分别捉取10头Ⅰ型和Ⅱ型褐飞虱4龄若虫按照Trizol (Reagent,USA)说明书进行褐飞虱总RNA的提取.NanoDrop 2000测定总RNA的纯度及含量,将OD260/OD280处于1.9~2.1及OD260/OD230为2.0的RNA 样品按照反转录试剂盒(PrimeScripe RT reagent kit,TaKaRa)说明书合成cDNA,-80 ℃保存待用.
利用Beacon Designer 8设计荧光定量PCR引物,用于检测褐飞虱AChE以及肌动蛋白β-actin(GenBank登录号:EU179847.1)在两种生物型褐飞虱中的表达水平.其中AChE的引物为AChE-F:5′-GGAAAGGGACCTCAGTCTGC-3′,AChE-R:5′-CTGTTGCTCTGGGTCCTCTG-3′;β-actin的引物为actin-F:5′-CCCGTCCACAATGAAGATCAAG-3′,actin-R:5′-GTTGGAAGGTGGAGAGGGAAG-3′.反应体系为25 μL:RNase Free H2O 8.5 μL、SYBR 12.5 μL、上下游引物各1 μL、cDNA 2 μL.反应程序:95 ℃ 30 s;(95 ℃ 5 s,60 ℃ 30 s)循环40次.记录溶解曲线,并采用相对定量法计算AChE表达量的变化,每个样本重复3次.

图1 TAIL PCR扩增结果
2 结果与分析
2.1 褐飞虱乙酰胆碱酯酶基因启动子的克隆及序列分析用染色体步移方法扩增褐飞虱AChE的启动子,电泳检测结果如图1,1~3泳道分别为3次TAIL PCR结果.
将最终扩增得到的1 919 bp的DNA片段连入pMD18-T载体,用M13和M13(-)通用引物进行双向测序.测序结果显示,所扩增片段的3′序列与AChE cDNA的5′序列部分重叠,因此所克隆的序列为褐飞虱AChE的启动子序列.该序列已录入GenBank中,在GenBank中的登录号为MK611810.
将克隆的序列利用在线网站(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/和https://sogo.dna.affrc.go.jp/cgi-bin/sogo.cgi?lang=en&pj=640&action=page&page=newplace)进行启动子元件及其位置分析发现,AChE启动子内含多个与MYB、WRKY、ARE等抗性相关转录因子的结合位点(元件)如表1,表明该启动子可能与逆境胁迫相关.
2.2 两种褐飞虱生物型AChE启动子区域甲基化差异分析以亚硫酸氢盐处理后的生物型Ⅰ和生物型Ⅱ基因组DNA为模板进行MS-PCR扩增,结果如图2所示.泳道1和2分别为生物型Ⅰ和生物型Ⅱ的AChE启动子区未发生甲基化位点扩增条带;3和4分别为生物型Ⅰ和生物型Ⅱ的AChE启动子区发生甲基化-位点扩增条带.
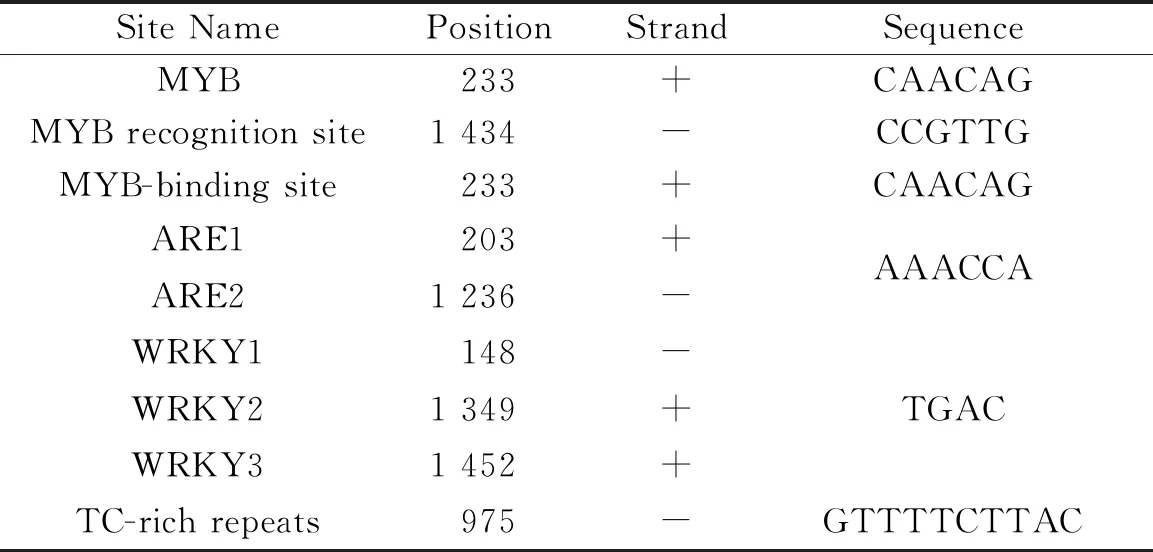
表1 部分应激相关启动子元件

图2 MS-PCR扩增结果
从图中1和2看出生物型Ⅱ能扩增出明显的非甲基化条带而生物型Ⅰ中扩增出非甲基化条带较浅,从3和4看出生物型Ⅰ能扩增出明显的甲基化条带而生物型Ⅱ中扩增出甲基化条带不明显,说明在生物型Ⅰ和生物型Ⅱ的AChE启动子中甲基化程度存在差异,且生物型Ⅰ的甲基化程度明显高于生物型Ⅱ.两种生物型两对引物均扩增出条带,表明该CpG位点只部分发生甲基化.扩增得到的启动子序列通过网站(http://www.takara-bio.co.jp/enzyme/enzyme_search.php) 进行启动子区域受甲基化影响的限制酶酶切位点分析,结果显示褐飞虱AChE启动子区域主要甲基化酶切位点为CpG methylase(5 mCG),表明褐飞虱AChE启动子区域DNA甲基化主要发生在胞嘧啶的C-5位.
2.3 BSP分析两种生物型AChE启动子甲基化模式分析以亚硫酸氢盐处理后的生物型Ⅰ和生物型Ⅱ基因组DNA为模板进行BS-PCR扩增,1~4均为Ⅰ型褐飞虱BSP扩增产物;5~8均为Ⅱ型褐飞虱BSP扩增产物.结果如图3所示:
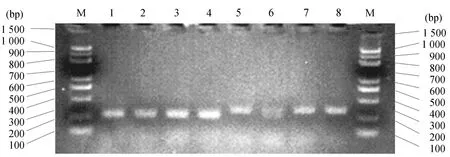
图3 褐飞虱BSP电泳结果
目的片段经胶回收纯化,连接pClone007-T载体,菌落PCR验证后每种生物型均挑取10个阳性克隆子送至武汉擎科生物公司测序.根据测序结果利用在线网站(http://quma.cdb.riken.jp/)分析获得两种生物型AChE启动子区CpG岛的甲基化情况,并绘制黑白点图(图4和图5).
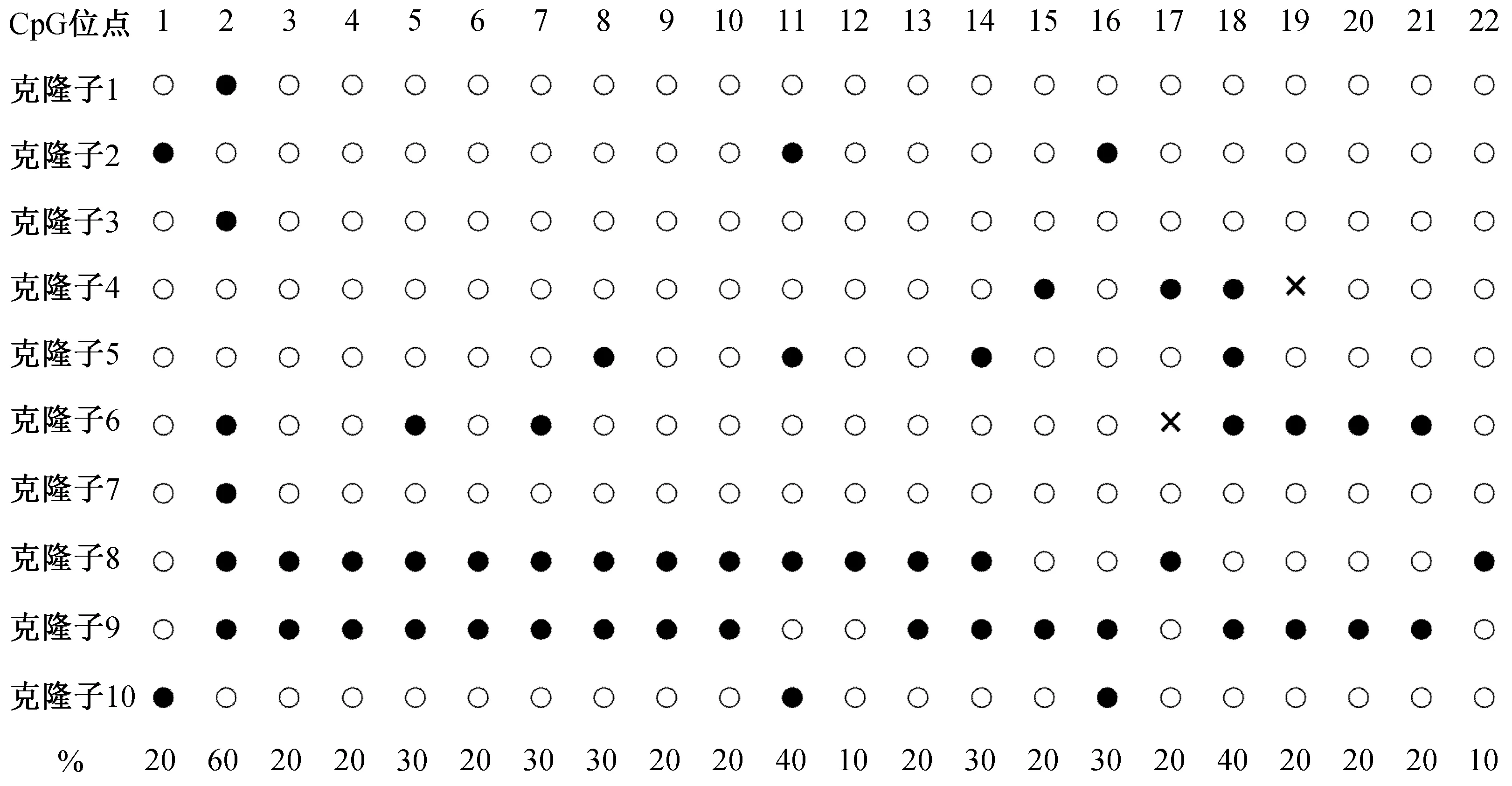
图4 Ⅰ型褐飞虱AChE启动子区CpG岛甲基化模式

图5 Ⅱ型褐飞虱AChE启动子区CpG岛甲基化模式
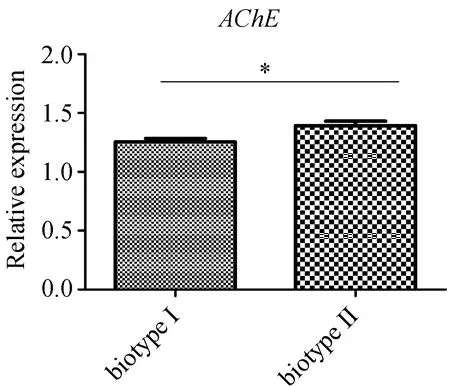
图6 荧光定量PCR检测褐飞虱生物型Ⅰ和生物型Ⅱ中AChE表达水平
由黑白点图可知:Ⅰ型褐飞虱总体平均甲基化频率为24.09%,其中10个克隆子中有2个克隆子发生高甲基化,频率分别为77.27%和68.18%;第2个CpG位点发生甲基化的频率最高为60%.Ⅱ型褐飞虱总体平均甲基化频率为7.27%,其中10个克隆子中甲基化频率最高仅为18.18%,有两个克隆子未发生甲基化,第11个CpG位点发生甲基化的频率最高为40%.
2.4 两种生物型AChE基因的表达量分析通过荧光定量PCR检测两种生物型中AChE的表达水平,参照2-△△Ct[18]方法进行基因表达水平的相对定量分析并绘制图6.结果表明AChE在两种生物型间表达存在差异,且在生物型Ⅱ中的表达量高于生物型Ⅰ,为其1.11倍.两种生物型间AChE的表达量差异不明显,推测有可能是两生物型间mRNA的稳定性存在差异.
3 讨论
褐飞虱是一种单食性水稻害虫,主要通过刺吸式口器取食水稻韧皮部汁液.这不仅干扰了水稻同化物质的运输,而且其排泄物易传播或诱导水稻病害,严重影响了水稻的正常生长发育,造成粮食大量减产[19].目前防治褐飞虱主要是通过喷洒农药.乙酰胆碱酯酶是使用最广的氨基甲酸酯类和有机磷杀虫剂的靶标酶,但农药的长时间大范围施用,不仅污染了环境,而且会导致褐飞虱产生抗药性,使其防治更加困难[20].褐飞虱存在多型性现象,根据对不同抗性水稻品种表现不同的危害性,以及对寄主取食和产卵表现不同的嗜好性分为6种生物型,其中生物型Ⅰ经过抗性水稻Mudgo的筛选能演变为生物型Ⅱ[21].近期研究发现AChE具有促进褐飞虱中肠细胞凋亡的功能,且受抗性水稻的诱导[1].但是AChE在褐飞虱与水稻互作中的具体机理尚不清晰.
越来越多的研究表明,昆虫中DNA甲基化通过改变基因的表达方式可以直接影响胚胎发育、基因组印迹、级型分化、翅型分化、性别分化和抗药性等生长发育进程的调控[22].在哺乳动物中,DNA甲基化主要发生在CpG二核苷酸的背景下,剩余未发生甲基化的CpG位点则主要密集分布于基因的启动子区域和第一外显子区域,被称为CpG岛(CpG island).多基因转录起始位点分析结果表明,CpG岛是参与基因表达调控的核心元件.Methprimer网站分析发现,AChE启动子序列中存在一个282 bp的CpG岛.因此我们从表观遗传的角度分析褐飞虱Ⅰ、Ⅱ生物型间AChE的CpG位点甲基化程度的差异.甲基化限制性酶切位点分析结果显示,褐飞虱AChE启动子区域主要甲基化酶切位点为CpG methylase(5 mCG),5-甲基胞嘧啶 (5mC) 甲基位于DNA双螺旋大沟内,是众多蛋白质因子与DNA结合的部位,且含丰富的能被转录因子识别的GC序列,但CpG发生甲基化后,转录因子就不能结合到DNA上,从而影响转录因子与启动子区 DNA 的结合效率,影响转录水平[23].荧光定量结果表明甲基化程度高的生物型Ⅰ褐飞虱的表达量低于生物型Ⅱ.
本研究通过染色体步移技术克隆了褐飞虱AChE的启动子,该片段长度为1 919 bp.利用在线网站进行启动子元件及其位置分析发现,AChE启动子内含多个与MYB、WRKY、ARE等抗性相关转录因子的结合位点(元件),表明该启动子可能与氧化应激反应相关.采用MS-PCR和实时荧光定量PCR检测结果显示,生物型ⅠAChE启动子区域的甲基化程度高于生物型Ⅱ,这一结果也与生物型Ⅰ的高遗传易变性相吻合;同时生物型Ⅱ中的AChE的表达量为生物型Ⅰ的1.11倍.DNA甲基化影响褐飞虱AChE的表达.AChE表达量的增加会使昆虫维持一定的ACh水解速率,从而缓解杀虫剂的抑制作用,增强昆虫对农药的耐受性[24].推测AChE转录的增加或者mRNA稳定性的增加可能是使Ⅱ型褐飞虱较Ⅰ型褐飞虱对农药敏感性降低的原因.启动子区CpG岛的甲基化水平不同,可能是导致两种褐飞虱对于宿主抗性具有不同耐受程度的原因.AChE启动子的甲基化检测对于褐飞虱生物型识别提供新的手段.本研究中所扩增的AChE启动子序列为进一步探讨AChE在褐飞虱与水稻互作中的作用及研发新的生物杀虫剂奠定了基础.
