湿法磷酸生产工业级磷酸氢镁研究
2020-07-14陈丽萍
陈丽萍,周 堃
(成都理工大学 材料与化学化工学院,四川 成都 610059)
磷酸氢镁在污水处理、食品、医药等方面应用广泛。在城市及工业污水处理中磷酸氢镁被用作化学沉淀剂[1-3],与NH4+反应生成磷酸铵镁[4],可以去除水体富营养化污染源——氨氮。磷酸氢镁化学沉淀脱氮[5]因工艺简单、反应迅速、净化率高,已经成为高氨氮废水处理的主流工艺[6-8]。
目前国内外磷酸氢镁主要是用热法磷酸和氧化镁(或氢氧化镁)反应制取,用其他原料制备磷酸氢镁的方法尚未见报道。采用湿法磷酸生产磷酸氢镁,充分发挥了矿产资源综合利用的优势,即将价格低廉的湿法磷酸中的磷资源和镁资源用新工艺生产成为高附加值的高氨氮废水吸附剂。
1 实验部分
1.1 实验原料、药品及仪器
实验所用低浓度磷酸来自四川某磷化工厂,其化学组成见表1。经过测定,湿法磷酸的密度为1.612 3 g/mL。其余药品均为分析纯。

表1 原料湿法磷酸的化学组成 %
主要仪器设备有超级恒温水浴、酸度计、倒置显微镜、集热式恒温加热磁力搅拌器等。
1.2 实验原理
湿法磷酸经过脱硫、脱氟、中和除杂、沉淀结晶得到含磷酸氢镁晶体的混合液,离心和干燥得到工业级磷酸氢镁晶体,再把分离磷酸氢镁后的母液与氢氧化钠进行中和反应,冷却结晶,离心分离得磷酸氢二钠副产品。
1.3 工艺流程
实验的工艺流程如图1所示。

图1 湿法磷酸生产磷酸氢镁工艺流程
1.4 实验方法
1) 湿法磷酸脱硫 取湿法磷酸,按n(Ca2+)/n(SO42-)为0.7 ~1.2加入碳酸钙,在25 ~75 ℃水浴中反应30 ~150 min进行脱硫,脱硫后分离。
2) 磷酸脱氟 取脱硫湿法磷酸,按n(Na+)/n(F-)为0.7 ~1.3加入碳酸钠,在40 ~60 ℃水浴中反应1 ~2 h进行脱氟,然后再陈化1 ~2 h。
3) 中和除杂 取脱氟磷酸,用氢氧化钠中和至pH 为3.0 ~5.0,继续反应0.5 h 过滤分离,得到净化磷酸溶液。
4) 磷酸反应结晶 向净化后的湿法磷酸中加入氧化镁,调节pH 至4.5 ~6.5,在25 ~80 ℃反应30 ~120 min,离心分离、干燥得到工业级磷酸氢镁。将分离的母液与氢氧化钠溶液继续反应,调节pH 至9.1,在55 ℃反应30 ~150 min,再冷却结晶、离心分离、干燥得到磷酸氢二钠副产品。
1.5 分析方法
硫酸根,采用硫酸钡比浊法测定[9];氟含量,采用离子选择电极法测定[10];镁含量,采用EDTA(乙二胺四乙酸)络合滴定法测定[11];五氧化二磷,采用喹钼柠酮重量法测定[12];其他组分,采用电感耦合等离子体发射光谱法(ICP-OES)测定[13];三水磷酸氢镁纯度,采用EDTA络合滴定法测定[11]。
2 结果与讨论
2.1 湿法磷酸脱硫
选择碳酸钙作为脱硫剂时,n(Ca2+)/n(SO42-)为1.0,反应温度为30 ℃,反应时间为30 min,硫酸根脱除率达到89%,在该溶液中按n(Ba2+)/n(SO42-)为1.0 加 入BaCO3,在70 ℃反应30 min 进行深度脱硫,所得溶液中w(SO42-)约为0.068 0%(硫酸根的总脱除率达到99%以上)。在该脱硫过程中磷损失为0.254%,脱硫后的磷酸指标见表2。

表2 湿法磷酸、脱硫磷酸、脱氟磷酸各项指标 %
2.2 湿法磷酸脱氟
按照n(Na+)/n(F-)为1.0向脱硫磷酸中加入碳酸钠,反应温度30 ℃,反应时间90 min,得到的脱氟后的磷酸指标见表2。
2.3 中和除杂
用氢氧化钠溶液中和磷酸除去铁、铝、钙等离子,防止其影响磷酸氢镁结晶。不同pH 对各离子脱除率,以及镁、磷损失的影响见图2。

图2 不同中和pH下的脱除率
从图2 可以看出,当pH <3.0 时,Fe、Al 离子形成沉淀大量析出,pH 达到3.0 以后基本不再产生沉淀,二者的脱除率均达到98%以上。当pH<4.5时Ca、Ba 离子大量析出,pH 达到4.5 左右时,二者含量基本不变,Ca 离子脱除率在95%左右,Ba离子脱除率在90%左右。在pH大于4.5之后,磷酸中Mg 离子生成磷酸氢镁沉淀的速率加快,镁和P2O5损失也逐渐增大。为减小镁和P2O5的损失,中和pH应选择在3.5。
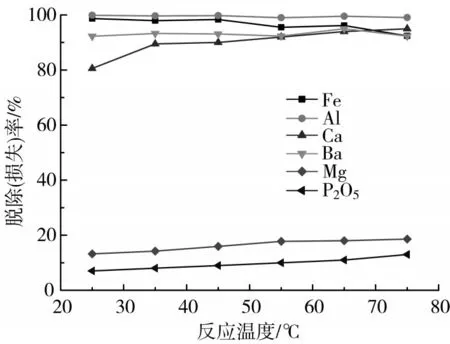
图3 不同中和温度下的脱除率
不同中和温度条件下各离子的脱除率见图3。由图3可知,中和温度对杂质(除Ca离子随温度的升高而脱除率增大外)脱除的影响不大,但是随着温度的升高,Mg 和P2O5的损失呈现上升趋势。考虑到除杂率及减少Mg 和P2O5的损失,本实验选定40 ℃作为中和除杂温度。
不同中和时间条件下各离子的脱除率见图4。由图4可知,中和反应时间对Fe、Al、Ba离子去除影响不大,但是Ca 离子随着反应时间的延长脱除率逐渐增大;Mg 和P2O5的损失率也随着时间的延长而增大,在反应时间达到60 min时,二者的损失变化得更明显,此时会沉淀出更多的MgHPO4。综合考虑,中和反应时间选择在30 ~60 min 比较合适,本实验选择反应时间在60 min。

图4 不同中和时间下的脱除率
结合上述3 个条件,最终确定中和条件为pH 3.5、反应温度40 ℃、反应时间60 min,在此条件下中和除杂后所得溶液的化学组成如表3所示。

表3 中和除杂后溶液的主要化学组成 %
2.4 磷酸氢镁结晶
查阅相关文献得知,在温度低于36 ℃时,氧化镁与磷酸反应得到的是MgHPO4·7H2O 晶体,温度不低于36 ℃时,得到的是MgHPO4·3H2O 晶体。实验探究氧化镁浓度、反应温度、搅拌转速、pH和停留时间等条件对磷酸氢镁结晶的影响。
2.4.1 氧化镁浓度的影响
在温度为45 ℃、搅拌转速为250 r/min 条件下,将不同浓度的氧化镁(100 g 水中氧化镁质量为5 ~50 g)加入到中和除杂后w(P2O5)为16%的磷酸中,当pH 达到4.5 时停止加料,停留时间为60 min,考察氧化镁浓度对磷酸氢镁产品性能的影响,结果见表4。
由表4 可知,氧化镁浓度对磷酸氢镁产品性能有重要影响。磷酸氢镁的平均粒径随着氧化镁浓度的减小而增大,当100 g水中氧化镁质量为5 g时样品的平均粒径达到最大,为112.3 μm,继续降低氧化镁的浓度,磷酸氢镁的粒径减小,这是由于随着氧化镁的浓度降低,反应的过饱和度降低,成核速率减慢,生长速率增大,继续降低氧化镁的浓度使得反应的过饱和度过低,反而不利于晶体的生长。经过洗涤后产品的纯度都达到了96%以上,满足工业级磷酸氢镁的要求。

表4 氧化镁浓度对磷酸氢镁产品性能的影响
不同氧化镁浓度所制得的磷酸氢镁的粒径分布见图5,从图5 中可以看出制得了粒径分布均一的磷酸氢镁产品,而且当100 g 水中氧化镁质量为5 g时(即w(MgO)为4.76%)所制得的产品粒径最大。

图5 不同氧化镁浓度下磷酸氢镁粒径分布
2.4.2 反应温度的影响
温度是磷酸氢镁合成过程中的一个重要影响因素。在磷酸氢镁制备过程中,温度对最终产品的粒径与形貌都有一定的影响,但前人未对此进行研究。本实验在氧化镁质量分数为4.76%、搅拌转速为250 r/min、停留时间为60 min、反应终点pH 为4.5 的条件下,探究反应温度(在25 ~75 ℃)对磷酸氢镁产品性能的影响,结果见表5。

表5 反应温度对磷酸氢镁产品性能的影响
由表5可知,从45 ℃开始,产品的平均粒径随着温度的升高而增大。在温度较低时,反应的过饱和度较高,成核速率增大,生长速率减慢,这就使得一次结晶产生较多的晶核,不利于晶体的生长,从而影响到最终产品的过滤性能;相反,温度较高时,反应的过饱和度较低,有利于小晶体的溶解和大晶体的生长,能够明显改善磷酸氢镁产品的结构、形貌以及颗粒的分散性,合成的产品在常温阶段的过滤洗涤性能也较好。但是在温度75 ℃时,产品粒度增大比较明显,原因是温度过高导致产品出现了团聚现象,如图6所示。
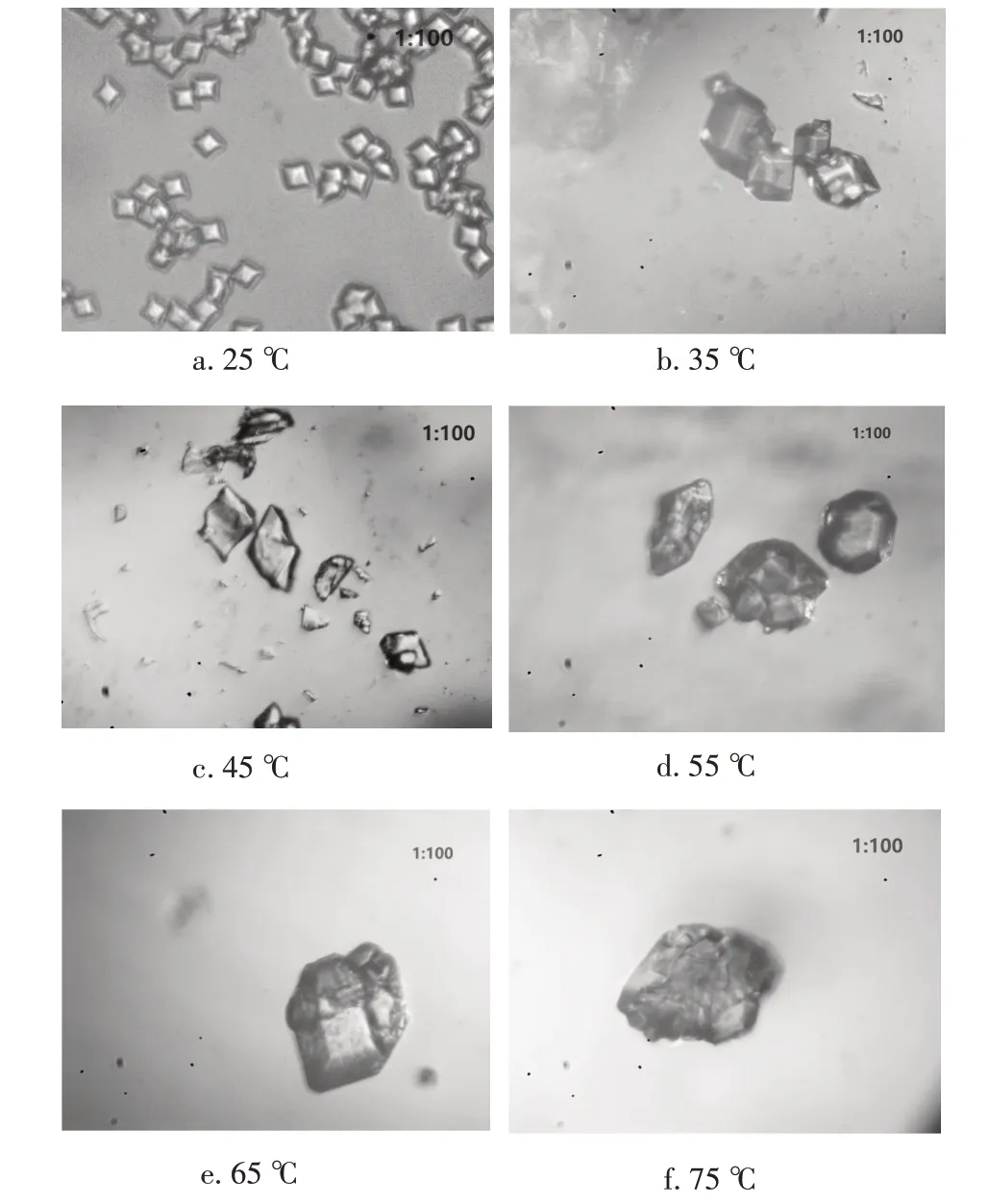
图6 25 ~75 ℃下磷酸氢镁产品的径照片
图7 是不同温度下所制得产品的粒径分布。从图7 可以看出,75 ℃下产品粒径明显大于其他温度,65 ℃下的产品粒度分布较均匀,且粒度相对较大。

图7 不同温度下的磷酸氢镁粒径分布
2.4.3 搅拌转速的影响
搅拌在结晶过程中的作用不容忽视。在w(MgO)为4.76%、温度为65 ℃、反应终点pH 为4.5、停留时间为60 min条件下,探究不同搅拌转速对磷酸氢镁产品性能的影响,结果见表6和图8。
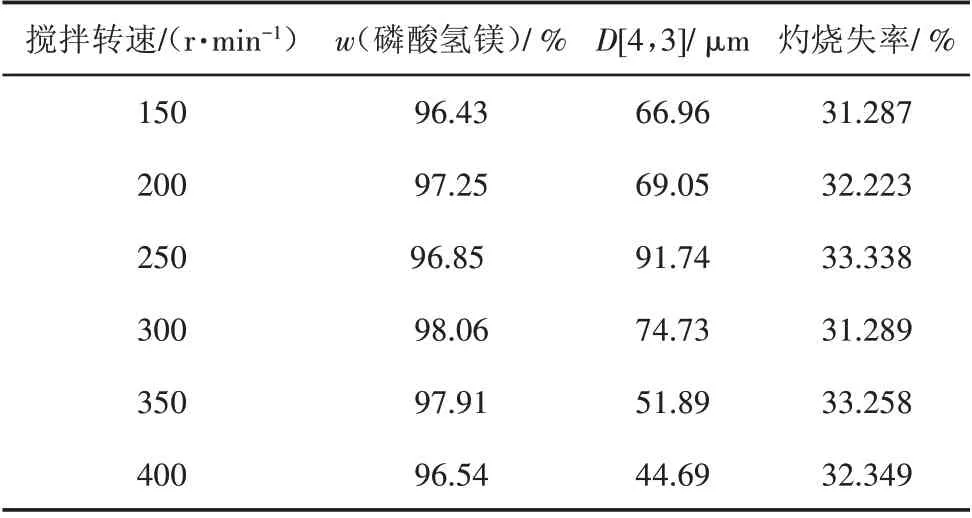
表6 搅拌转速对产品性能的影响

图8 不同搅拌转速的磷酸氢镁粒径分布
由表6 可以看出,磷酸氢镁的粒径大小随着搅拌转速的增大,变化趋势是先增大后减小,在搅拌转速为250 r/min 时产品粒径最大。搅拌转速过低时,由于反应器内混合不均匀,会出现局部过浓现象,促使溶液中产生大量的小颗粒物质,不利于晶体的长大;搅拌转速增大时,溶液中各个组分之间的传质过程得到改善,搅拌桨也会消耗一定的能量,这时成核速率减小,生长速率增大,从而促进了晶体的生长;当搅拌转速过大时,又会破坏原有晶体从而造成二次成核,不利于晶体的长大。
从图8可以看出,搅拌转速为250 r/min 时产品磷酸氢镁的粒径最大,但是其粒径分布不如300 r/min时的产品集中,二者分布都比较均匀,综合考虑该反应的最佳搅拌转速在250 ~300 r/min。
2.4.4 pH的影响
在pH 小于3.5时,磷酸氢镁基本不会析出,但是当pH 大于3.5 时大量磷酸氢镁析出,而在pH 大于8.5 时,会产生磷酸镁。本实验研究pH 在3.5 ~7.0时对磷酸氢镁产品性能的影响,如表7和图9所示。

表7 pH对磷酸氢镁产品性能的影响

图9 不同pH的磷酸氢镁粒径分布
由表7 和图9 可以看出,pH 对磷酸氢镁粒度的影响较小,各个pH 条件下磷酸氢镁粒度的变化不大,在考虑纯度和收率的前提下,选择pH 在4.0 ~5.5比较合适。
2.4.5 反应时间的影响
根据化学反应原理可知,随着反应时间的延长,化学反应进行得更彻底,反应得更完全。考察反应时间为10 ~150 min 时,反应时间对磷酸氢镁产品性能的影响,结果见表8和图10。

表8 反应时间对磷酸氢镁产品性能的影响

图10 不同反应时间的磷酸氢镁粒径分布
从表8 可以看出,在反应进行的前30 min,产品磷酸氢镁的纯度较低,达不到产品要求,反应50 min后,磷酸氢镁的纯度达到97%以上,随着反应时间继续延长,磷酸氢镁纯度降低,但不低于97%。
从表8 和图10 都可以看出,随着反应时间的延长,磷酸氢镁的粒度先增大后减小,在50 min时达到最大,明显大于其他几组的粒度,而且粒度主要集中在50 ~100 μm,故本实验选择反应时间为50 min较合适。
2.4.6 优化条件实验结果
综合以上条件,用湿法磷酸和质量分数为4.76%的氧化镁溶液在65 ℃下,搅拌转速为250 r/min,反应时间50 min,控制加料速度,使反应溶液的pH在4.0 ~5.5,过滤、干燥得到磷酸氢镁产品,对其进行表征和含量测定,结果见图11、图12、图13。

图11 产品的XRD图

图12 同步热分析(TG)结果
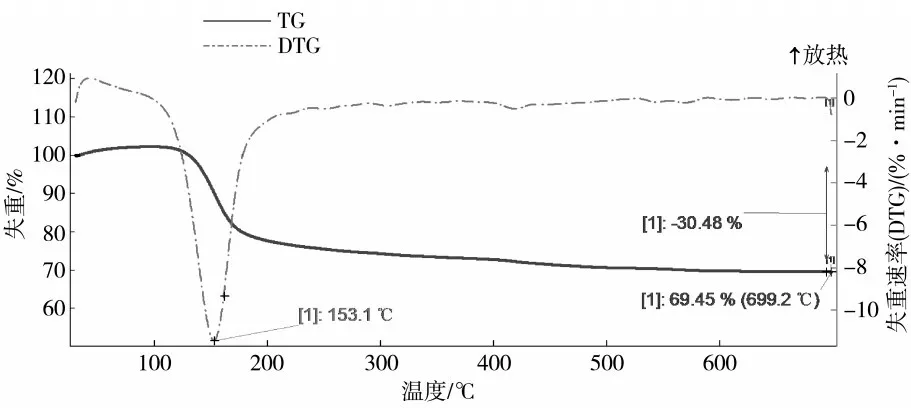
图13 同步热分析(DTG)结果
从图11 中产品XRD 图谱和标准图谱(PDF#19-0762)的对比可知,产品主要物相成分为三水磷酸氢镁。
从图12、图13 热分析结果可以看出,在0 ~700 ℃失重主要发生了两个过程:一是失去结晶水的过程;二是磷酸氢镁失水生成焦磷酸镁(Mg2P2O7)的过程。从热重分析结果来看,DTG(表示失重速率)在650 ℃时趋近于0 ,表明失水反应已经结束。通过计算可得,产品有3 个结晶水,纯度大概是98.4%。
采用电感耦合等离子体光谱仪(ICP-OES)对产品纯度进行分析,其结果见表9。

表9 产品ICP-OES测定结果 %
由表9 产品ICP-OES 的测定结果可知,金属杂质总质量分数在0.1%以下,得到产品MgHPO4·3H2O的纯度大于98%,产品的体积平均粒径为93.61 μm,达到产品要求(最终产品检测结果如表10 所示)。通过氧化镁和除杂后的湿法磷酸来制备磷酸氢镁可以达到综合利用湿法磷酸中镁资源的目的,避免了镁资源的浪费。

表10 产品检测结果 %
2.5 磷酸氢二钠结晶
将分离磷酸氢镁后得到的母液与氢氧化钠溶液在55 ℃反应,当pH达到9.1左右时停止加入氢氧化钠溶液,再恒温反应30 min。然后将溶液进行缓慢升温,待液面出现晶膜时停止加热,慢慢冷却结晶,分离晶体即可得到磷酸氢二钠产品。
产品磷酸氢二钠及主要杂质情况如表11所示。

表11 磷酸氢二钠及主要杂质测定结果 %
2.6 五氧化二磷、氧化镁和氢氧化钠收率
五氧化二磷、氧化镁和氢氧化钠收率如表12所示。
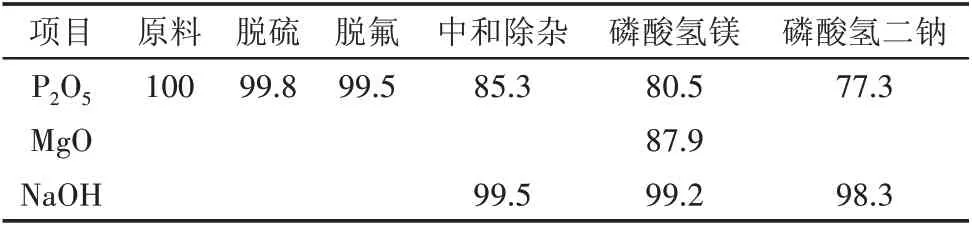
表12 P2O5、MgO和NaOH的收率 %
3 结论
原料湿法磷酸进行脱硫、脱氟和中和除杂后,使溶液的总杂质质量分数降低到1%以下,然后进行磷酸氢镁沉淀结晶。实验结果表明湿法磷酸和w(MgO)4.76%的氧化镁溶液在65 ℃下,搅拌转速为250 r/min,反应时间50 min,控制加料速度,使反应溶液的pH在4.0 ~5.5,得到杂质总质量分数在0.1%以下,纯度大于98%的主产品MgHPO4·3H2O,产品的体积平均粒径为93.61 μm,副产品磷酸氢二钠纯度大于99%。该工艺过程湿法磷酸中五氧化二磷的收率为77.3%,氧化镁收率为87.9%,氢氧化钠收率为98.3%。
通过氧化镁和除杂后的湿法磷酸来制备磷酸氢镁可以综合利用湿法磷酸中的镁资源,避免了镁资源的浪费。
