弥漫性大B细胞淋巴瘤C-MYC、BCL2基因异常的临床病理分析
2020-07-14何银珠陈宝珍王晓江陈芳芳陈燕坪
何银珠,陈宝珍,王晓江,师 怡,陈芳芳,陈燕坪
(1.福建省肿瘤医院,福建医科大学附属肿瘤医院分子病理室,福建 福州 350104;2.福建省肿瘤医院,福建医科大学附属肿瘤医院病理科,福建 福州 350104)
弥漫性大B细胞淋巴瘤(DLBCL,diffuse large b-cell lymphoma)是非霍奇金淋巴瘤(NHL,non-Hodgkin lymphoma)最常见的类型之一,占所有淋巴瘤的30%~40%,在我国的发病率高达50%,其侵袭性高、预后差、不同遗传和分子特征影响DLBCL临床预后和治疗反应[1]。2016年的WHO淋巴肿瘤分类中将伴有C-MYC和BCL2或(和)bcl6重排的高级别B细胞淋巴瘤定义为双重打击淋巴瘤(DHL,double-hit lymphoma)或三重打击淋巴瘤(THL, Triple-hit lymphoma)作为一个独立的分类。此外,C-MYC和BCL2蛋白高表达的双表达淋巴瘤(DEL, double-expression lymphoma)[2],C-MYC和BCL2基因的拷贝数变化(CNA,copy number aberration)也可以作为DLBCL的重要预后指标[3]。本研究分析了42例DLBCL患者中C-MYC、BCL2基因表达与临床病理资料关系,为指导治疗和评估预后提供理论依据。
1 资料与方法
1.1一般资料:收集2015年10月~2019年1月福建省肿瘤医院病理科确诊的、有研究价值的DLBCL患者42例,所有的病例均符合2008版WHO造血和淋巴组织肿瘤分类的诊断标准,有完整的病理资料。本研究工作经本医院伦理委员会审批同意。
1.2采用罗氏Benchmark XT Ventanna全自动免疫组织化学染色仪严格按照说明书设置:染色程序,进行C-MYC、BCL2自动免疫组织化学检测。C-MYC、BCL2 为 Dako公司产品,染色按照要求在每张组织芯片中设阳性对照片。阳性率以阳性细胞占肿瘤细胞百分比表示,C-MYC蛋白阳性率≥40%为高表达,BCL2阳性率≥70%为高表达[4],所有评判均由2名高年资病理医师完成。

图1 C-MYC细胞核阳性(40倍)

图2 BCL2细胞膜阳性(40倍)

图3 C-MYC基因易位阳性示细胞核内可见1个红色信号,1个绿色信号,1个红绿融合的信号FISH法×1000

图4 C-MYC基因多拷贝示细胞核内可见>2个红绿融合的信号 FISH法×1000
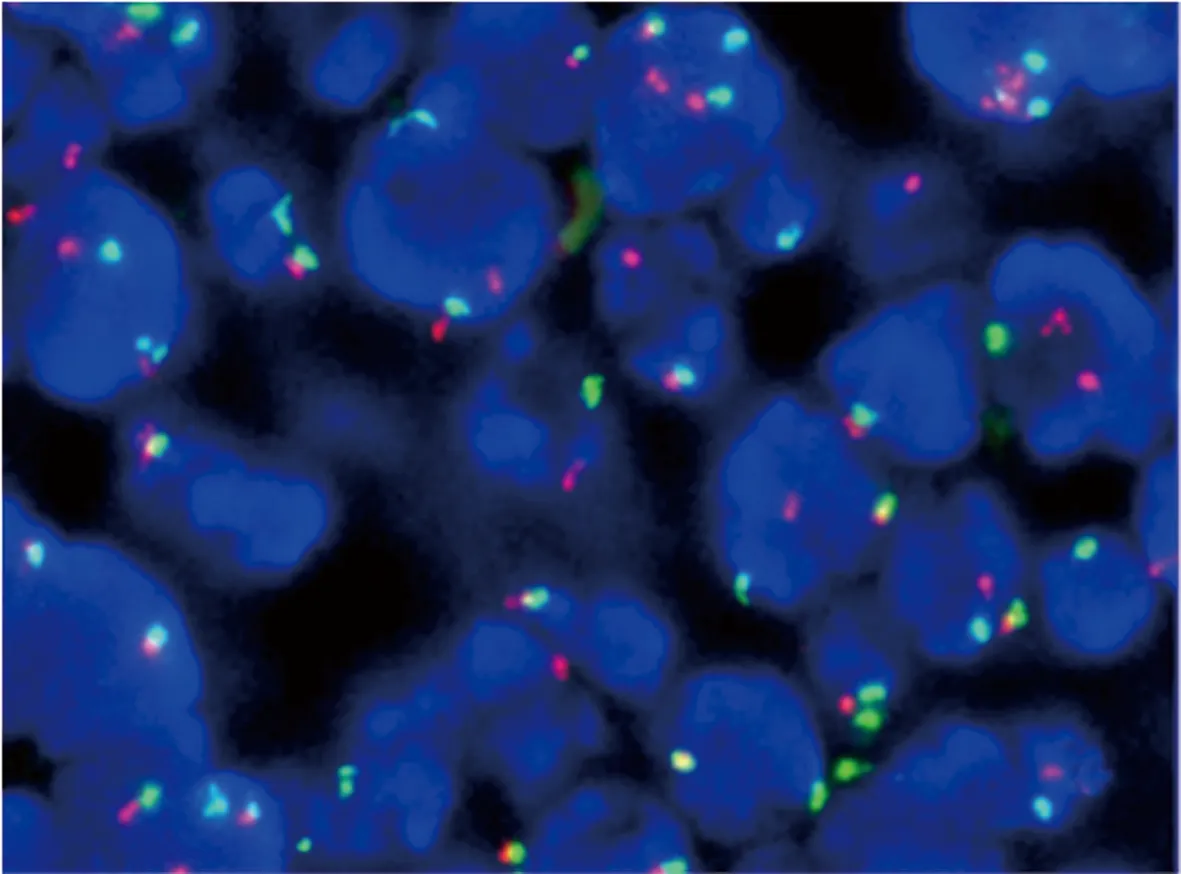
图5 BCL2基因易位阳性示细胞核内可见1个红色X信号,1个绿色信号,1个红绿融合的信号 FISH法×1000

图6 BCL2基因多拷贝示细胞核内可见>2个红绿融合的信号 FISH法×1000
1.3荧光原位杂交:根据HE染色,选择肿瘤细胞丰富区域作为杂交区域;C-MYC双色分离 探针(QP-30-191096)及BCL-2双色分离探针(QP-30-231029)均购自美国Vysis公司,实验严格按照说明书进行。高倍视野记录100个肿瘤细胞核信号,分离探针正常细胞显示两个黄色融合信号紧邻的两个红绿信号,基因易位显示1个黄色信号,1红1绿两个分离信号;拷贝数增加显示≥3个融合信号。
1.4国际预后指数(IPI)包括5个危险因素:年龄>60岁,乳酸脱氢酶升高,临床分期Ⅲ~Ⅳ期,体力状态ECOG 2~4分(体力状态 ECOG:活动能力正常,与起病前活动能力无差异0分;能自由的走动、从事轻体力活,但不能从事较重的体力活1分;能自由的走动,能生活自理,但已丧失工作能力2分;生活尚能部分自理,且一半以上时间卧床3分;生活不能自理,卧床不起4分),>1个部位结外累及。每项危险因素各记1分,总分0~1分为低危,2分为低中危,3分为中高危,4~5分为高危。
1.5统计学方法:本研究采用SPSS 20.0 软件进行统计学分析。各因素组间差异采用χ2检验,当不满足χ2检验条件时采用 Fisher确切概率法。C-MYC、BCL2蛋白表达与基因重排及多拷贝的关系通过分类变量间关联性分析的χ2检验来评估,以P<0.05为差异有统计学意义。
2 结果
2.1一般情况:42例DLBCL中男29例,女13例,男女比例2.23∶1;发病年龄27~78岁,中位年龄53岁,平均年龄54.5岁;其中GCB型28例,non-GCB型14例;16例乳酸脱氢酶(LDH)升高,26例正常;根据国际预后指数(IPI)进行危险度分组:低危组(0~2分)25例,中高危组(3~5分)17例。
2.2蛋白表达结果:42例患者均经过免疫组织化学检测C-MYC、BCL2蛋白表达。C-MYC、BCL2阳性表达于细胞核(图1),BCL2阳性表达于胞膜(图2),阳性部位呈棕褐色、棕黄色或浅黄色。C-MYC蛋白高表达34例(80.95%),BCL2蛋白高表达30例(71.43%),26例 (61.90%)同时表达C-MYC和BCL2蛋白,除去2例DHL,共有24例(57.14%)DEL病例。
2.3基因异常结果:42例DLBCL中,C-MYC、BCL2基因异常情况见表1。C-MYC基因分离阳性及多拷贝见图3和图4,BCL2基因分离阳性及多拷贝见图5和图6。共检出C-MYC基因易位8例(19.04%),多拷贝5例(11.90%);BCL2基因易位5例(11.90%),多拷贝8例(19.04%)。2例(4.76%)检测到C-MYC基因重排合并BCL2基因重排为DHL。2例DHL均起源于生发中心B细胞(GCB),临床分期均是IV期,IPI指数均>3,年龄分别为50岁、59岁。1例(2.38%)C-MYC基因多拷贝合并BCL2基因多拷贝,男性,38岁,为非生发中心B细胞(non-GCB),IPI评分2分。
表1 42例弥漫性大B细胞淋巴瘤患者C-MYC、BCL2基因易位、多拷贝与各指标的关系

指标C-MYC易位(例)是否P值C-MYC多拷贝(例)是否P值BCL2易位(例)是否P值BCL2多拷贝(例)是否P值蛋白表达0.130 0.950 0.140 0.046 阳性826430525822 阴性0817012012年龄0.322 0.982 0.060 0.397 <60岁619322525620 ≥60岁215215019214性别0.686 0.572 0.641 0.686 男623425326623 女211112211211Hans分型0.578 0.178 0.092 0.781 GCB622226523523 NON-GCB212311014311临床分期0.734 0.039 0.969 Ⅰ~Ⅱ3151170.271 018313 Ⅲ~Ⅳ519420519521ECOG0.140 0.013 0.140 <25294300.954 232529 ≥235173535LDH0.441 0.040 0.969 升高4122140.741 412313 正常422323125521IPI0.542 0.320 0.055 0.116 <3421421124615 ≥3413116413219
2.4基因异常与各指标的关系:BCL2蛋白阳性组中共有8例BCL2基因多拷贝,两者间差异具有统计学意义(P=0.046);BCL2基因易位与临床分期、ECOG、LDH的差异具有统计学意义(P值分别为0.039、0.013、0.040)。而C-MYC基因是否易位,是否多拷贝与蛋白表达、年龄、性别等其他指标的差异无统计学意义(P>0.05)。
3 讨论
DLBCL在病理形态、治疗反应、预后和分子遗传学等方面异质性明显,约三分之二的患者接受初步治疗后得到缓解,而其余三分之一的患者复发或变得难治性,预后极差[5]。随着分子病理的飞速发展,越来越多与DLBCL的发生、发展、预后及治疗密切相关分子异常被发现。近年来,双重打击淋巴瘤成为关注的热点,并于2016年WHO中将其作为一个独立分类,而相当比例的复发或难治性DLBCL就属于这一分类。鉴于双重打击淋巴瘤具有相对独特的临床特点和不良预后,故深入研究C-MYC、BCL2基因在DHL的作用对指导临床治疗和预后评估具有重要意义。
本研究显示DLBCL存在着多种分子异常,其中C-MYC基因异常13例(8例基因易位,5例拷贝数增加),BCL2基因异常12例(4例基因易位,7例拷贝数增加,1例易位伴拷贝数增加)。研究报道C-MYC基因异常在DLBCL所占比例在4%~14%不等,C-MYC基因易位通常导致C-MYC蛋白的过表达,进而影响细胞代谢、增殖、分化、迁移,促进肿瘤的发生发展[5]。而BCL2重排在DLBCL的检出率在3.4%-24%,基因重排导致BCL2蛋白表达,激活BCL2基因的抗凋亡活性[6]。国际预后指数(IPI) 被认为是衡量患者生存率最重要的预后因子,也是判断高危患者(接受标准化学疗法不能获得长期缓解)最好的方法。因此,本研究比较 “双打击或三打击”淋巴瘤患者和双表达淋巴瘤患者的 IPI 值,间接衡量其预后区别。本研究发现BCL2基因易位与临床分期、ECOG、LDH相关,临床分期越晚ECOG评分越高,LDH升高,BCL2重排率高,提示BCL2基因易位可能与DLBCL的预后相关。侵略性B细胞淋巴瘤中C-MYC和BCL2基因异常主要表现为易位、突变,拷贝数变化和转录上调,偶见两者合并发生。本研究检出2例DHL占4.76%,与国外研究报道的0%~12%基本一致。2例DHL年龄分别为50岁和59岁,均起源于生发中心B细胞(GCB),临床分期均是Ⅳ期,IPI指数均>3,ki67指数都在80%,LDH指数均升高。这与Zeng D等人综述[5]中DHL患者的中位年龄为51~67岁、有较高临床分期、乳酸脱氢酶(LDH)升高、国际预后指数(IPI)评分升高、ki67升高一致。上述结果表明,DLBCL中存在着复杂的分子异常改变,从而导致DLBCL异质性。
本研究结果还显示,42例DLBCL中约有61.90%的DEL病例。多项研究表明, C-MYC和BCL2蛋白共表达的DLBCL(DEL)预后差,但优于DHL,比DHL更为常见,约占DLBCL的18%~44%不等,以非生发肿瘤来源的B细胞淋巴瘤(non-GCB)居多[2,7-8]。本研究DEL检出率偏高,可能与选择性筛选DHL有关。同时,本研究发现的2例DHL的C-MYC、BCL2蛋白阳性率在80%~100%,说明蛋白高表达对基因异常有一定预测,但并不是所有的基因异常均存在蛋白的高表达,Petrich等人的研究[9]发现部分DHLs中C-MYC或BCL2蛋白表达缺失,而此部分患者预后优于DHL。蛋白表达的缺失可能与C-MYC、BCL2基因重排后进一步的变异事件,如C-MYC或BCL2基因易位位点附近发生了插入或重排,或C-MYC和BCL2基因突变,以及C-MYC非Ig伴侣基因的易位[10-13],使得现有克隆号的抗体不能检出,造成假阴性的结果。Roth等人利用不同的BCL2抗体在以往检测BCL2阴性的标本检出阳性[14]就验证了这一点。目前比较公认的C-MYC和BCL2蛋白高表达的阈值(40%和70%)主要是根据其预后价值选择的,不是作为筛选基因异常阈值[15],而本研究结果显示C-MYC和BCL2的蛋白高表达与基因易位差异无统计学意义(P>0.05),表明C-MYC和BCL2蛋白高表达的阈值(40%和70%)难以对DHL进行筛查。同时本研究发现,BCL2蛋白表达与基因多拷贝差异具有统计学意义(P<0.05),表明基因多拷贝是造成蛋白表达的另一个重要因素。Kendrick等研究[16]也表明BCL2基因的扩增导致BCL2蛋白表达。本研究还分析了C-MYC和BCL2基因多拷贝的临床病理关系,但并未找到显著的相关性。
综上所述,DLBCL是一类异质性明显的疾病,存在着复杂的分子遗传学行为。FISH是诊断DHL的金标准,而目前对于DHL的最佳治疗方案仍未达成共识,需要进一步深入研究探讨其机理,为临床治疗指明方向。
