水分浸泡过夜对刺槐枝条最大水分导度测定的影响及年龄差异
2020-07-14魏凯璐杨冬梅彭国全
梁 昭 魏凯璐 杨冬梅 彭国全,2*
(1.浙江师范大学化学与生命科学院,金华 321004; 2.秦岭国家植物园,西安 710061)
木质部水分导度是反映植物水分传输效率的核心指标,与木质部导管(管胞)及导管间结构特性有关,并受植物所处环境的水分状况、温度等环境因素的影响。准确测定植物木质部的水分导度既可以反映植物的水分运输效率,又是评估植物受胁迫程度和耐胁迫能力的有效途径,在植物对全球气候变化响应的相关研究中具有广阔的应用前景[1~2]。
木质部水分导度的测定是在木质部管道的流体力学[3~4]、水分运输系统中的阻力分布[5~7]等研究的基础上发展起来的。通常用单位压强下流经样品的溶液流速来定量描述水分导度,并以单位长度或单位横截面积上的导水率对木质部水分导度进行标准化,以便于不同物种间的比较研究。但这种压强—流速关系只反映了植物在自然状态下的水分输导能力,并不能反映植物最大的水分输导能力和栓塞化程度。Sperry等[1]认为用于测水分导度的样品材料中可能本来就存在一些充气的导管所形成的自然栓塞,在水分导度测定中,如果不能对这部分自然栓塞进行准确的量化,那么基于水分导度的测定结果就不能说明太多问题。于是他们提出通过人为方法将充气导管中的气体完全排出后所测得的导水率为样品材料的最大导水率,并将自然导水率与最大导水率进行比较来量化栓塞化程度,从而使得不同样本间的水分传输效率和栓塞化程度更具有可比性。Sperry等[1]方法的主要原理是先将一个没有分枝的离体茎段材料连接到水分导度测定系统上(见图1),通过液面高度差所形成的重力作用在茎的两端形成1~6 kPa的压强差来诱导水流穿过样品茎段,根据单位时间通过离体茎段的液体流量与相应压强梯度的比值计算出木质部水分导度,即木质部的初始导水率。其计算公式:
(1)
式中:F是水流速度(kg·s-1),是单位时间T内流过枝条两端液体的质量差;L是枝条的精确长度(cm);ΔP是水势势差;ΔP/L是水势梯度(dp/dx,MPa·s-1)。
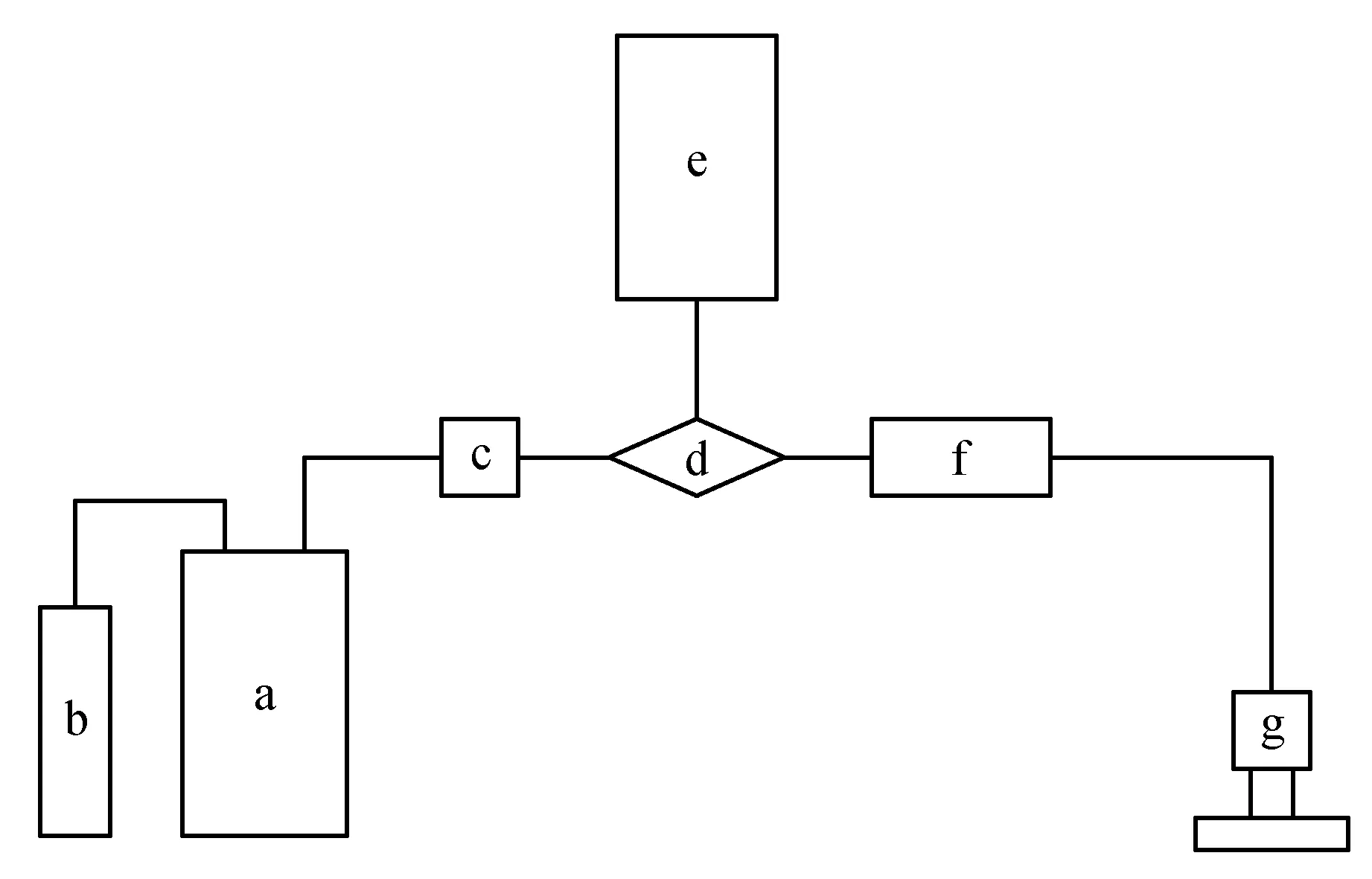
图1 枝条水分导度测定装置示意图 a.装有冲洗液的供水罐;b.带控制阀的空气压缩机;c.过滤器;d.三通旋塞阀;e.二级供水容器;f.茎段;g.放在分析天平上中的水容器 气体和液体容器之间的连线是抗压软管;其他连线表示注满溶液的干净管子;天平与计算机相连,通过定制的软件计算水分导度Fig.1 Schematic representation of the apparatus for measuring hydraulic conductivity in xylem of stem segments a.Supply tank containing perfusing solution; b.Compressed air tank with regulator; c.Filter; d.Three-way stopcock; e.Secondary supply reservoir; f.Stem segments; g.Drain reservoir on electronic balance Line connecting air and solution tank is a pressure hose;Other joining lines represent solution-filled clear tubing;Balance is interfaced with a computer program to calculate hydraulic conductivity
测完初始导水率后,用外部高压(150~200 kPa)驱使冲洗液穿过样品来冲洗木质部导管,溶解或替换样品木质部管道中原有的气泡或其他栓塞子,使木质部的水分传输能力达到最大,再用测初始导水率同样的方法测样品的最大导水率。根据初始水分导度占最大水分导度的百分比对枝条的栓塞化程度进行量化。这种方法简单、快捷,可以有效避免栓塞或空穴化因素对测定结果的影响,并能给出栓塞所导致的最直接的生理性结果,即水流阻力增加的量。因此,这种方法自发明以来,在植物水分生理学领域被广泛用来测定植物的栓塞化程度和抗栓塞能力,并一直沿用至今。如Atkinson等利用重力自动流动系统(gravity-fed flow system)测定苹果树枝条和根系导水率[8]。
由于Sperry等[1]方法是根据初始水分导度占最大水分导度的百分比的形式来表示植物的栓塞化程度,所以要准确测定植物的栓塞化程度和抗栓塞能力,首先必须要准确地测定植物的最大水分导度。在测枝条木质部最大水分导度时,常用的方法是先用高压(150~200 kPa)驱使冲洗液冲洗样品材料来消除木质部管道中原有的栓塞,然后利用液面高度差形成的重力差(通常为1~6 kPa)诱导液流(用超纯水配制并经过孔径为0.2 μm过滤器过滤的0.1 mol·L-1KCl溶液)流过样品材料的方法测水分导度,每次加压冲洗的时间2~4 min,来回循环操作,直至前后2次测得的水分导度没有显著性差异,或继续延长冲洗时间水分导度恒定或变化很小,此时的水分导度被认为是该样品材料的最大木质部水分导度,并把达到最大水分导度所用的冲洗时间认为是消除该物种木质部栓塞所需要的最佳冲洗时间,在后续的测定中直接把该时间作为样品材料的冲洗时间[9]。由此我们可以看出,在用冲洗法测枝条的最大水分导度时,必须是在相同的压力和其他测定条件下,前后连续出现的多个水分导度测定值之间没有显著差异,才能被认为是枝条的水分导度达到了最大值。此时的最大水分导度值才被认为是真实可靠的,才能被用作测定植物栓塞程度和构建植物栓塞脆弱性曲线的基准值。所以,在实验过程中,如何做到让枝条的水分导度达到最大后能继续保持平稳就显得尤为重要。
尽管用上述方法测定枝条最大水分导度的过程非常简单,但对同一物种不同的人测定的结果往往会相差很大,其中的一个主要原因是样品材料的最大水分导度往往会随着测定时间的延长而下降。在很早以前就有多个实验观察到这种下降会在测定开始的前几分钟内就会出现[5],对此的解释包括从样品材料内部液体中排出的气泡堵塞了木质部导管[10],周围组织膨胀导致导管直径变窄[11],导管之间的纹孔膜膨胀[5]等。另外,水分导度的下降也可能与所用实验材料的木质化程度有关,尤其是在春季当年生枝条还没有完全木质化之前,在采样和样品材料的前期处理过程中,我们经常可以看到在切口处会有一些乳白色或褐色的分泌物,在水分导度测定过程中这些分泌物是否会影响到测定结果仍未可知。假如这些分泌物在水分导度测定过程中会随着液流进入到木质部导管腔内,并在导管内逐渐累积的话,它们将会堵塞导管,使木质部的水分输导能力下降,那么我们将很难真正测得准确的木质部最大水分导度值,并最终影响到植物栓塞化程度和抗栓塞能力的测定。所以,在本研究中,我们以刺槐(RobiniapseudoacaciaL.)不同年龄的枝条为实验材料,探讨一种可以提高枝条水分导度测定结果稳定性的有效方法。我们利用低压液流计(Low Pressure Flow Meter with multi-channels,LPFM)水分导度测定系统,首先按冲洗法的传统做法,将枝条从室外带回到实验室进一步修剪处理好后,立即用于初始水分导度和最大水分导度相关测定,检测枝条的最大水分导度是否会随冲洗次数的增加和测定时间的延长而变化。如果枝条最大水分导度随测定时间的延长而下降,我们则进一步假设最大水分导度的下降是由于在冲洗和测定过程中有一些分泌物随液流被带入到木质部管道中,堵塞了管道引起的。我们假设,在水分导度测定之前,如果将枝条在超纯水中室温下浸泡过夜,让分泌物从枝条内“吐出”,或者将样品材料内部液体中的气泡完全逸出,则有可能以提高最大水分导度测定结果的稳定性和准确性。
1 材料与方法
1.1 样地状况
取样地点分别位于陕西省杨凌示范区和浙江省金华市浙江师范大学校园内。杨凌示范区渭河河岸位于陕西关中平原中部(34°16′N,108°4′E),海拔457 m,属于季风气候半干旱地区,具有温暖带大陆性季风气候,主要土壤类型为塿土。冬季寒冷干燥,夏季高温多雨,年均气温12.9℃,极端最高气温42℃,最低气温零下19.4℃。其年均降雨量651 mm,年均蒸发量884 mm,生长季节(4~9月)的降雨量占全年降雨量的79%[12]。
金华市位于浙江省中部腹地(29°31′N,118°38′E),海拔50~300 m,属浙中丘陵盆地,地势南北高而中间低,气候属亚热带季风气候,四季分明,雨量充沛,光照充足。该地区土壤分布面积最广为红壤,占土壤总面积的34.7%,年均气温10.9~17.2℃。其年降水量为800~1 500 mm,植物资源十分丰富,地带性植被主要属亚热带常绿阔叶林[13]。
1.2 样品采集和处理
本实验的样品材料分别来自陕西省杨凌示范区渭河边上自然状态生长良好的高大(5 m以上)刺槐植株(2017年4~5月)和浙江师范大学校园内健康、成熟并且高度基本一致的几株刺槐个体(2019年4~5月)。采样时,选取植株树冠2/3以上向阳处部位的枝条,用高枝剪剪取一段长1.0~1.5 m的枝条(刺槐的最大导管长度约60 cm)[9],用喷水壶将枝条喷湿后,快速装入内部装有湿纸球的黑色塑料袋中立即带回实验室。样品枝条带回实验室后,在水下用枝剪从基部剪去一段长约5 cm的茎段,以消除采样过程中因人为引入气泡而在基部末端形成的栓塞,并在水下用锋利单面刀片切除枝条上的叶片和多余侧枝,然后按植物枝条水分导度测定的标准取样方法,选取其中长度274~277 mm,两端直径6.5~8.0 mm的当年生或二年生茎段作为实验样品,并用刀片将茎两末端修平。使用502快速凝固胶密封枝条侧面的开放切口或伤口,确保在水分导度测定时水流不会从枝条侧面流出。待凝胶在室温下自然晾干凝固后,将枝条编号置于超纯水中备用。
本实验分为超纯水浸泡样品茎段过夜(简称浸泡过夜)和样品茎段不经浸泡过夜直接测定(简称未浸泡过夜)两组实验处理。不浸泡过夜组样品的采集时间为早晨太阳出来之前(此时枝条水势最高),样品枝条按上述方法处理好后,立即用于水分导度的测定。浸泡过夜组样品的采集时间是在傍晚太阳落山之后,样品茎段按上述相同方法处理好后,在室温25℃环境中用超纯水(GYJ1-10L-S超纯水系统,重庆华创公司,微粒直径小于10 nm)浸泡过夜,次日早晨开始枝条水分导度测定。
1.3 实验方法
1.3.1 枝条水分导度测定
枝条木质部水分导度的测定采用“多通道低压液流计”技术(Low pressure flow meter with multi-channels,LPFM),该方法由Sperry等[1]提出的冲洗法改良而来,实验装置示意图见图1。冲洗液贮存在两端带有PVC管帽的供水罐中(见图1a),冲洗液为真空抽滤泵除气2 h并经由0.2 μm微孔过滤的0.1 mol·L-1的KCl溶液。用空压机(BB24V,美国BAMBI公司)加压空气使冲洗液穿过医用过滤器(孔径0.2 μm)(见图1c)。溶液经过三通旋塞阀(见图1d)进入二级供水容器(带盖的干净试剂瓶)(见图1e)。调节三通旋塞阀将二级供水容器与加压的溶液隔离,溶液在重力作用下从二级供水容器流过茎段(见图1f)进入分析天平内的水容器(见图1g)中。分析天平连接计算机,并通过定制的程序,根据单位时间内排出溶液的重量变化、二级供水容器与天平内的水容器中的液面高度差换算得到的压力差(P),以及测定时温度等参数计算枝条木质部的水分导度。
按上述方法测定枝条的初始导水率(即未经加压冲洗液冲洗过的枝条导水率)作为冲洗0 min的实验对照。接着在150 kPa左右的压力下,用0.1 mol·L-1的KCl溶液冲洗茎段2 min,再测定枝条木质部的导水率。同样压力再冲洗茎段2 min(与上次冲洗的2 min相加,累计冲洗4 min)并测导水率,据此循环依次检测枝条在冲洗4、6、8和12 min后的导水率,并记录每次测得的枝条导水率值。
1.3.2 枝条两端木质部面积比例测定
枝条测定导水率后在超纯水中浸泡至饱和状态,去除树皮和韧皮部,截取枝条两端各3 cm茎段,用轮转式切片机(HistoCore BIOCUT,德国徕卡)切片(厚度为15~20 μm),用1%的甲苯胺蓝酒精溶液染色制片,在显微镜(DM6B,德国徕卡)下拍摄100X图片保存,用Image-Pro Plus软件中测定茎段两端的横截面面积和木质部面积,计算木质部面积占茎横截面面积的比例。
1.3.3 茎木质密度测定
完成导水率测定的枝条去除两端用于木质部面积比例测定部分的3 cm茎段后,剩余部分参考Oliva Carrasco L.[14]的排水法测定茎木质密度(ρ)。将一个装有去离子水的量筒放置在精度为0.001 g的电子天平上,样品茎段去除表皮后,用一个1 mL注射器针头插入茎的一端,然后将茎段插入量筒中直至整个茎段被淹没,且茎段不接触量筒壁,记录天平数值的变化即为茎段的体积(V)。将茎段放入70℃烘箱内烘48 h至恒重,用精度为0.001 g的电子天平称量茎段干重(M),根据ρ=M/V计算茎段木质密度。
1.4 数据处理与分析
对每个枝条加压冲洗不同时间所测得的导水率进行比较分析,每延长一次冲洗时间测得的导水率与上一冲洗时间测定的导水率连续进行独立样本的t检验,以确定导水率的最大值,以及达到最大值后继续延长冲洗时间,导水率是否与上一次冲洗时间测得的数值有差异;同时不同年龄枝条木质密度和木质部占横切面比例亦采用独立样本t检验进行比较。不同样品组的数据随冲洗时间延长,导水率下降幅度间的比较采用单因素方差分析。所有数据分析均采用SPSS 21.0(SPSS,Chicago,USA)进行,并用OriginPro作图。
2 结果与分析
2.1 未浸泡过夜处理组不同年龄枝条最大导水率与冲洗时间的关系
结果显示:①晴天早晨采样未浸泡过夜的枝条,无论是来自金华样地还是来自杨凌样地,其当年生枝条在150 kPa压力冲洗2 min后导水率均达到最大值(见图2a~b,实心符号及表1中加粗的数值),极显著高于自然导水率(即冲洗0 min的导水率,P<0.01);而雨天早晨采样时,来自金华样地的当年生枝条自然导水率已达最大值(见图2c,表1)。结果表明,在晴天采样时,即便是在早晨植株水势最高时采样,枝条也会有一定程度的自然栓塞,在测定最大导水率之前需要对样品枝条进行冲洗。②枝条达到最大导水率后,来自杨凌和金华两地样品的当年生枝条,无论是晴天采样还是雨天采样,导水率均随冲洗时间的延长而显著下降(见图2a~c,表1)。与最大导水率相比,继续延长2 min冲洗时间后,晴天金华、雨天金华及晴天杨凌当年生枝条导水率平均下降幅度分别为10.69%±2.35%、9.26%±2.49%和11.60%±4.19%,且不同天气及不同地域间无显著差异(P>0.05);冲洗时间由4 min延长至8 min后,晴天金华、雨天金华及晴天杨凌当年枝条平均下降幅度分别为15.02%±3.05%、12.40%±1.86%和16.38%±4.53%,且不同天气及不同地域间无显著差异(P>0.05);继续延长冲洗时间,下降幅度明显减小,部分枝条下降至冲洗10 min后,继续延长冲洗时间导水率不再发生变化;与最大导水率相比,冲洗10 min后,3组未浸泡处理的当年生枝条导水率平均下降幅度分别为30.63%±4.08%、23.54%±3.34%和33.09%±9.30%,且不同天气及不同地域间无显著差异(P>0.05)(见图2a~c,表1)。结果表明,刺槐当年生枝条在未经超纯水浸泡过夜,直接用来测最大导水率时,测定结果会随着冲洗时间的延长而明显低于真实最大导水率值,即冲洗过程中引入了人为栓塞。③来自金华样地的二年生枝条,在同样的压力冲洗下,其导水率均需在冲洗8 min后才达到最大值,且冲洗8 min后继续延长冲洗时间,最大导水率基本维持稳定(见图1d,表1,P>0.05)。结果表明,二年生枝条的自然栓塞程度明显比当年生枝条严重,但达到最大导水率后,冲洗过程导致二年生枝条导水率下降的可能性很小。
2.2 超纯水浸泡过夜不同年龄枝条最大导水率与冲洗时间的关系
枝条在前一天傍晚采回实验室处理好后,在室温25℃条件下超纯水中浸泡一晚上,第二天早上连接到LPFM水分导度测定系统上测枝条木质部导水率,检测经超纯水浸泡过夜后枝条导水率随冲洗时间的变化。结果显示:①来自金华与杨凌两地的刺槐当年生枝条经超纯水浸泡过夜后再进行水分导度测定时,90%以上的枝条在150 kPa压力下冲洗2~4 min内导水率可达到最大值,且继续延长冲洗时间导水率没有显著变化,基本维持

表1 未经浸泡过夜的刺槐枝条不同冲洗时间的枝条导水率(Kh)
注:显著水平P为随着冲洗时间延长,前后2次冲洗时间下的导水率t检验的比较结果。S.金华晴天当年生枝条;Y.杨凌当年生枝条;R.金华雨天当年生枝条;D.金华二年生枝条
Note:The significant levelPis the comparison result oft-test of hydraulic conductivity with the extension of flushing time. S.Current-year stems collected on the sunny day in Jinhua; Y.Current-year stems collected in Yangling; R.Current-year stems collected on the rainy day in Jinhua; D.Two-year-old stems collected in Jinhua

表2 超纯水浸泡过夜刺槐枝条不同冲洗时间下的枝条导水率(Kh)
注:显著水平P为随着冲洗时间延长,后一时间与前一冲洗时间下的导水率t检验的比较结果。s.金华晴天当年生枝条;y.杨凌当年生枝条;r.金华雨天当年生枝条;d.金华二年生枝条
Note:The significant levelPis the comparison result oft-test of hydraulic conductivity with the extension of flushing time. S.Current-year stems collected on the sunny day in Jinhua; Y.Current-year stems collected in Yangling; R.Current-year stems collected on the rainy day in Jinhua; D.Two-year-old stems collected in Jinhua

图2 未浸泡过夜的刺槐枝条导水率随着冲洗时间的变化(实心符号表示最大导水率) a.金华晴天当年生枝条(S1~6.晴天采样的6个样品枝条重复);b.杨凌当年生枝条(Y1~4.来自杨凌样地的4个样品枝条重复);c.金华雨天当年生枝条(R1~6.雨天采样的6个样品枝条重复);d.金华二年生枝条(D1~6.来自金华样地的6个二年生样品枝条重复)Fig.2 The change of hydraulic conductivity of R.pseudoacacia L.stems without soaked overnight in the deionized water with increasing flushing time(Solid symbols indicate the maximum hydraulic conductivity) a.Current-year stems collectedon the sunny day in Jinhua; b.Current-year stems collectedin Yangling; c.Current-year stems collectedon the rainy day in Jinhua; d.Two-year-oldstems collected in Jinhua

图3 经浸泡过夜的刺槐枝条导水率随着冲洗时间的变化(实心符号表示最大导水率) a.金华晴天当年生枝条(s1~5.晴天采样的5个样品枝条重复);b.杨凌晴天当年生枝条(y1~5.来自杨凌样地的5个样品枝条重复);c.金华雨天当年生枝条(r1~5.雨天采样的5个样品枝条重复);d.金华二年生枝条(d1~5.来自金华样地的5个二年生样品枝条重复)Fig.3 The change of hydraulic conductivity of R.pseudoacacia L. stems soaked overnight in deionized water with flushing time(Solid symbols stand for maximum hydraulic conductivity) a.Current-year stems collected on the sunny day in Jinhua; b.Current-year stems collected in Yangling; c.Current-year stems collected on the rainy day in Jinhua; d.Two-year-old stems collected in Jinhua
稳定(P>0.05)(见图3a~c,表2)。仅有2个来自杨凌样地的当年生枝条,y4和y5在冲洗8 min后的导水率显著低于冲洗4 min后的导水率,但与未浸泡过夜的枝条相比,其导水率下降的幅度很小(分别下降了2.37%和2.23%)。结果表明,超纯水浸泡枝条过夜可显著降低当年生枝条冲洗过程中引入人为栓塞的可能性,提高测定结果的准确性和稳定性。②来自金华样地的二年生枝条经超纯水浸泡过夜后,在同样的压力下冲洗2 min导水率即可达到最大值,且继续延长冲洗时间导水率也基本维持稳定,与同样处理的当年生枝条相比波动性更小(见图3d,表1,P>0.05)。结果表明,二年生枝条在冲洗过程中引入人为栓塞的可能性很小。
2.3 未经超纯水浸泡的与经过超纯水浸泡的2个处理间最大水分导度间的比较
来自金华样地所有未经超纯水浸泡的12个当年生枝条(即6个晴天样品枝条和6个雨天样品枝条)的平均比导率(即单位茎横截面积上的最大水分导度)为4.349 2±1.149 kg·s-1·m-1MPa-1·cm-2,金华样地所有经超纯水浸泡过夜的10个当年生枝条(即5个晴天样品枝条和5个雨天样品枝条)的平均比导率为3.821 9±1.498 1 kg·s-1·m-1MPa-1·cm-2。独立样本t检验结果显示,2个不同处理组的比导率之间没有显著性差异(P>0.05)。

图4 刺槐枝条两端木质部面积比例Fig.4 The proportion of xylem area of R.pseudoacacia L. stemsends to the cross-sectional area

图5 刺槐枝条平均密度和基部2 cm密度Fig.5 The meandensity and density of 2 cm in base of R.pseudoacacia L. stems
2.4 枝条两端木质部面积比例
本研究采用植物解剖学方法和显微镜观察测定了来自金华样地的所有刺槐当年生(共22个枝条)和二年生(共11枝条)样品的基部和顶部横截面面积以及茎横截面上的木质部面积百分比。结果显示,当年生样品枝条基部木质部面积占整个茎横截面的面积比例为88.21%±3.1%,顶部为79.36%±4.4%,顶部木质部面积比例显著小于基部(P<0.01);二年生样品枝条基部为92.09%±3.0%,顶部为86.07%±2.4%,顶部木质部面积比例显著小于基部(P<0.01)(见图4)。结果表明,完全发育成熟的刺槐枝条木质部面积比例在90%左右,实验期间(4~5份)当年生刺槐样品枝条基部已基本发育成熟,而中上部仍处在进一步发育过程中。
2.5 枝条木质密度
本研究采用排水法测定了来自金华样地的所有刺槐当年生(共22个枝条)和二年生(共11枝条)样品的木质密度。结果显示,当年生枝条的基部2 cm茎段的木质密度为0.343 1±0.03 g·cm-3,整枝平均木质密度为0.338 6±0.03 g·cm-3;二年生枝条的基部2 cm茎段木质密度为0.444 2±0.07 g·cm-3,整枝平均木质密度为0.433 5±0.08 g·cm-3,两者均显著大于当年生枝条(P<0.01)(见图5)。结果表明,实验期间当年生枝条的木质化程度还没有达到最大值。
3 讨论
本研究结果显示,来自金华与杨凌两地的刺槐当年生枝条采集后立即用于枝条水分导度测定时,在150 kPa压力下冲洗2 min左右就可以达到最大水分导度,金华雨天当年生枝条则未经冲洗已到最大导水率,二年生枝条需要冲洗8 min,说明雨天枝条的自然栓塞程度较少,二年生枝条自然栓塞程度大于当年生枝条;继续延长冲洗时间,所有当年生枝条的导水率均会随着冲洗时间的延长而下降。达到最大导水率后,再冲洗8 min,下降的幅度高达30%左右。之后继续延长冲洗时间导水率不再有显著变化。与此不同的是,枝条经超纯水浸泡过夜后,当年生枝条的导水率在达到最大值后,继续延长冲洗时间也能基本保持稳定,即使有下降,幅度也不足1%,显著低于未浸泡过夜枝条的下降幅度。同时,二年生枝条无论是否经过浸泡过夜,在达到最大导水率后,延长冲洗时间导水率都基本保持稳定。由此说明,冲洗过程本身不是引起茎木质部导水率下降的主要原因,未浸泡过夜的当年生枝条的导水率随冲洗时间的延长而下降是由于枝条自身的一些变化所引起的,超纯水浸泡枝条过夜可以有效缓解当年生枝条在冲洗过程中导水率下降的问题,提高测定结果的稳定性和可靠性。
很早以前就有科研人员发现在恒定的压力梯度下,木材中的液体流速随着时间的延长而下降的问题[15~16]。在开始时流速很快,但在30~120 min后趋于平稳,渐渐流速接近0。也有研究人员遇到的另一个现象是,当压力增加时,木材中的液体流速并不是成比例的增加,表明在压力增加之前,流速是随着时间的延长而下降的[15~16]。有人把这种现象归因于纹孔膜的膨胀[11],从而增加了液体流过的毛细管的大小。然而,Anderson等[15]根据Poiseuille方程原理推导认为,要解释增加的流速所需的拉伸程度在物理学上是不可能达到的。他们认为是纹孔膜上的纤维结构随着压力的增加而发生横向移动,从而以一种较小的代价来增大毛细管的大小,导致流速下降。Krier[17]用红枫作为实验材料,使用新鲜并经多孔玻璃过滤器过滤的蒸馏水作为液体,测得的流速虽然是平衡流速,但它仅占样品最大速率的1/5~1/8。Krier通过进一步的实验发现,在流速降低到低水平之后,通过刮削样品流入端的表面,流速再次升高。这表明闭塞区域主要位于流入表面处或附近。从该相同区域截取的切片显微照片显示细胞中有一些外来物质。因此,他得出结论,通过木材的液体流速降低的基本原因是导管分子被一种与木材和液体都能有机结合的不知名的复合物颗粒堵塞了。从我们现有的实验结果显然更支持Krier的观点,因为如果纹孔膜的膨胀或者纤维结构的位移导致毛细管大小的改变是引起液流速率下降的原因的话,那么经超纯水浸泡过夜的当年生枝条的流速也应该是随着冲洗时间的延长而下降,二年生枝条也存在同样的情况。但事实上我们的当年生枝条经超纯水浸泡过夜后,二年生枝条无论是否经浸泡,它们的导水率在经冲洗达到最大值后都基本保持稳定。我们推断未经浸泡过夜的枝条出现水分导度下降是由于在冲洗和测定水分导度过程中,可能有一些其他物质被引入到木质部管道中,堵塞了管道,导致水分导度下降。
在本研究中,用来测水分导度的样品材料都是离体枝条,当枝条从活体植株下剪下的那一刻,就相当于人为地给枝条一个外部机械性损伤。面对这种突然的机械性损伤,作为一种应激反应,植物通常会通过改变生理生化代谢途径增加体内的次生代谢产物,形成大量的萜烯类、酚类和生物碱等分泌物,增加自身的化学防御能力[18]。例如,有研究表明植物组织的匀浆和线粒体等细胞器在受到伤害时能同时产生乙烯和乙烷[19~21]。而乙烯是诱导形成创伤性分泌道的信号分子,并在创伤性分泌道中形成含有大量的萜类、酚类、脂类及多糖类物质的分泌物,用于封闭伤口,抵御昆虫、病原微生物入侵和阻止水分的散失[22]。在水分导度测定之前,如果没有将这些分泌物排除干净,那么在测定过程中,它们就有可能随水流通过纹孔进入导管腔内形成片状、团体或结晶状的侵填体。侵填体的形成和逐渐积累,导致导管输导功能逐渐降低,并最终丧失水分传输功能成为闭塞导管[23]。
尽管植物组织在正常情况下都能产生微量的乙烯作为内源激素调节植物的生长发育,但已有很多研究都发现植物组织遭受机械伤害时,乙烯的排放量会显著增加,但增生高峰期一般都有一段后滞期。根据植物种类、组织年龄、生理状态以及温度等不同,后滞期可以是十几分钟、几十分钟、几小时甚至更长[24~26]。刘愚等[27]用绿豆幼苗和小麦黄化苗作实验材料,检测植物组织受伤后乙烯产生的时间进程时发现,植物组织在受到机械伤害后,乙烯的增生有2个高峰期,第一个是伤害乙烯峰,它在受伤后立即出现,达到最大值的时间约为7 min,这部分乙烯主要来自受伤当时释放的乙烯加上组织间隙中原来积聚而在组织破坏时释放出来的乙烯。另一个为伤害诱导乙烯峰,它经过一定的后滞期(约25 min)才开始增加,约1 h达到最大值。这部分乙烯主要来自没有破坏的邻近细胞受到影响(直接的或间接的)后诱导形成的[26]。而Saltveit和Dilley[28]的研究结果也表明,豌豆除了在受伤后56 min有一个乙烯峰外,在131 min时还有另一个峰。本研究使用的实验材料刺槐与绿豆和豌豆同属于豆科植物,如果它们在受到机械性损伤后的乙烯增生高峰期相似的话,那么当我们把刺槐枝条带回实验室处理好后立即用于测水分导度时,水分导度的测定过程中可能正处于伤害诱导乙烯形成的高峰期。在乙烯的诱导下,枝条内形成含有大量的萜类、酚类、脂类及多糖类物质的分泌物,这些物质随测定水分导度的液流进入导管,并在导管腔内的逐渐积累导致木质部导管的输导能力逐渐下降,使得我们测得的枝条最大水分导度随着测定时间的延长而逐渐下降。而当我们把枝条采回来,在超纯水中室温下浸泡过夜后,从枝条中排放的乙烯则可能被及时地溶解于水中,不能进一步诱导分泌物的形成。当我们第二天做水分导度测定时,分泌物形成的量大大降低,对导管造成堵塞的可能性也就大大减小,从而使水分导度测定值保持基本稳定。此外,我们通过对当年生枝条与二年生枝条的比较实验,以及茎横截面上木质部面积所占百分比和木质密度的分析发现,木质化程度更高的二年生枝条经过高压将导管内原有的自然栓塞气泡冲出后,其最大导水率基本能保持稳定,这可能是由于木质化程度更高的老枝在遭受机械损伤后所产生的分泌物较少,所以无论是否浸泡过夜都不会出现导水率随冲洗时间的延长而下降的现象。这也从侧面证实木质化程度更低的当年生幼嫩枝条中可能具有更多的分泌物,所以需要更长的浸泡时间将分泌物排出。
总之,尽管冲洗法是用来测定植物的栓塞化程度和抗栓塞能力比较成熟的方法,但所用实验材料的木质化程度或采样时间的差异都有可能会影响到最大水分导度测定结果的准确性和稳定性,特别是当采用木质化程度较低的嫩枝进行植物最大导水率测定时,样品材料从室外采回来后,在超纯水中浸泡一段时间后再测,可以提高水测定结果的稳定性。
