9种唇形科芳香植物挥发性萜类成分的比较分析
2020-07-14朱小洁周翔宇高喜凤
朱小洁 周翔宇 范 航 高喜凤 杨 蕾*
(1.上海辰山植物园,中国科学院上海辰山植物科学研究中心,上海市资源植物功能基因组学重点实验室,上海 201602; 2.上海师范大学生命科学学院,上海 200234; 3.中国科学院上海生命科学研究院,中国科学院上海植物逆境生物学研究中心,上海 201602)

图1 9种唇形科芳香植物 A.百里香;B.凤梨鼠尾草;C.藿香;D.美国薄荷;E.迷迭香;F.南欧丹参;G.牛至;H.香蜂花;I.药用鼠尾草Fig.1 Nine species of aromatic plants of Lamiaceae A.T.mongolicus Ronn.; B.S.elegans Vahl.; C.A.rugosa(Fisch.et Mey.) O.Kuntze.; D.M.didyma L.; E.R.officinalis L.; F.S.sclarea L.; G.O.vulgare L.; H.M.officinalis L.; I.S.officinalis L.
挥发性萜类普遍存在于植物防御反应中,因其具有抗氧化和抗菌的功能,可保护植物免受病菌的侵害,同时挥发性萜类也可通过吸引害虫的天敌实现间接防御反应[1]。此外,挥发性萜类还可以通过增强花和果实的香味吸引动物促进植物的授粉和种子传播。芳香植物,含有大量的挥发性萜类成分,因此被广泛用于食品、化妆品、医药、保健及风景园林等各个行业[2~5]。
目前全世界已报道的芳香植物约有3 600余种,但其中仅有300种被开发[6],因此,如何更好地开发和利用芳香植物是一项具有重大经济效益的研究内容。唇形科是芳香植物聚集的一个大科[7],许多常见的芳香植物,如百里香(ThymusmongolicusRonn.)、凤梨鼠尾草(SalviaelegansVahl.)、藿香(Agastacherugosa(Fisch. et Mey.) O.Kuntze.)、美国薄荷(MonardadidymaL.)、迷迭香(RosmarinusofficinalisL.)、南欧丹参(SalviasclareaL.)、牛至(OriganumvulgareL.)、香蜂花(MelissaofficinalisL.)和药用鼠尾草(SalviaofficinalisL.)均属于唇形科(见图1)。芳香植物除了被广泛用作食品调料外,在临床上也可用于治疗多种疾病,如百里香具有抗菌、镇咳和祛痰的功效[8];牛至常用于解表、理气和化湿[9~10];藿香被用于治疗消化不良、皮肤真菌感染等疾病[11~12];迷迭香在降低心脏和大脑的脂质过氧化[13]、预防和治疗癌症[14]、抑郁[15]等均有应用。
挥发性萜类是芳香植物重要的次生代谢产物,来源于两条相对独立的生物合成途径,这两条途径分别是定位于质体的甲基赤藓醇-4-磷酸(MEP)途径和定位于胞质的甲羟戊酸(MVA)途径,其中单萜类化合物主要来源于MEP途径,倍半萜类化合物主要来源于MVA途径[16]。以往对芳香植物的研究多集中在精油成分的鉴定、抑菌、抗氧化等活性方面,以及挥发性萜类成分的分类比较研究,而对物种间代谢合成的比较研究较少。本研究以9种唇形科芳香植物叶片为材料,采用GC-MS的方法测定各植物叶片挥发性萜类成分,通过对挥发性萜类的多角度比较分析,不仅为芳香植物的高效利用、合理开发提供参考,还为植物萜类的代谢研究提供依据。
1 材料与方法
1.1 材料、仪器与试剂
百里香(ThymusmongolicusRonn)、凤梨鼠尾草(SalviaelegansVahl)、藿香(Agastacherugosa(Fisch.et Mey.) O.Ktze.)、美国薄荷(MonardadidymaL.)、迷迭香(RosmarinusofficinalisL.)、南欧丹参(SalviasclareaL.)、牛至(OriganumvulgareL.)、香蜂花(MelissaofficinalisL.)和药用鼠尾草(SalviaofficinalisL.)等植物材料培养于上海辰山植物园园艺苗圃,植物长势良好、无病虫害。GC-MS气质联用仪(7890A-5975C,美国安捷伦公司);HP-5MS毛细管柱(30 m×0.25 mm,0.25 μm,安捷伦科技公司);BSA 224S型分析天平,赛多利斯(上海)贸易有限公司。实验所用正己烷和乙酸壬酯购于Sigma-Aldrich公司,C7~C40正构烷购于上海安谱实验科技股份有限公司。
1.2 9种芳香植物挥发性萜类的提取
分别取9种芳香植物的新鲜叶片,切成小块后,在液氮中研磨成粉末,精确称取0.3 g于2 mL离心管中,加入1 mL正己烷(含有10 ng·μL-1的乙酸壬酯),将样品粉末过夜浸提,每种植物设置3个生物学重复。提取后的样品以12 000 r·min-1离心10 min,过滤收集上清液用于GC-MS检测。
1.3 9种芳香植物挥发性萜类的GC-MS分析
采用安捷伦7890A气相色谱仪和安捷伦5973A联用质谱仪。在毛细管柱HP-5MS上分离,升温程序:起始温度60℃保留2 min,以10℃·min-1升温到260℃,保留10 min。载气为高纯氦气(99.99%),流速为1 mL·min-1,无分流进样。电离方式EI,设定离子源温度为230℃,四级杆温度为150℃,电子能量70 eV,扫描范围(m/z)50~550。
1.4 保留指数RI值的测定
取正构烷烃混合对照品,按照1.3实验条件分析,记录每个正构烷烃的出峰时间,采用保留指数的线性升温公式计算各组分的RI值,计算公式为:
RI=100Z+100[RT(x)-RT(z)]/[RT(z+1)-RT(z)]
(1)
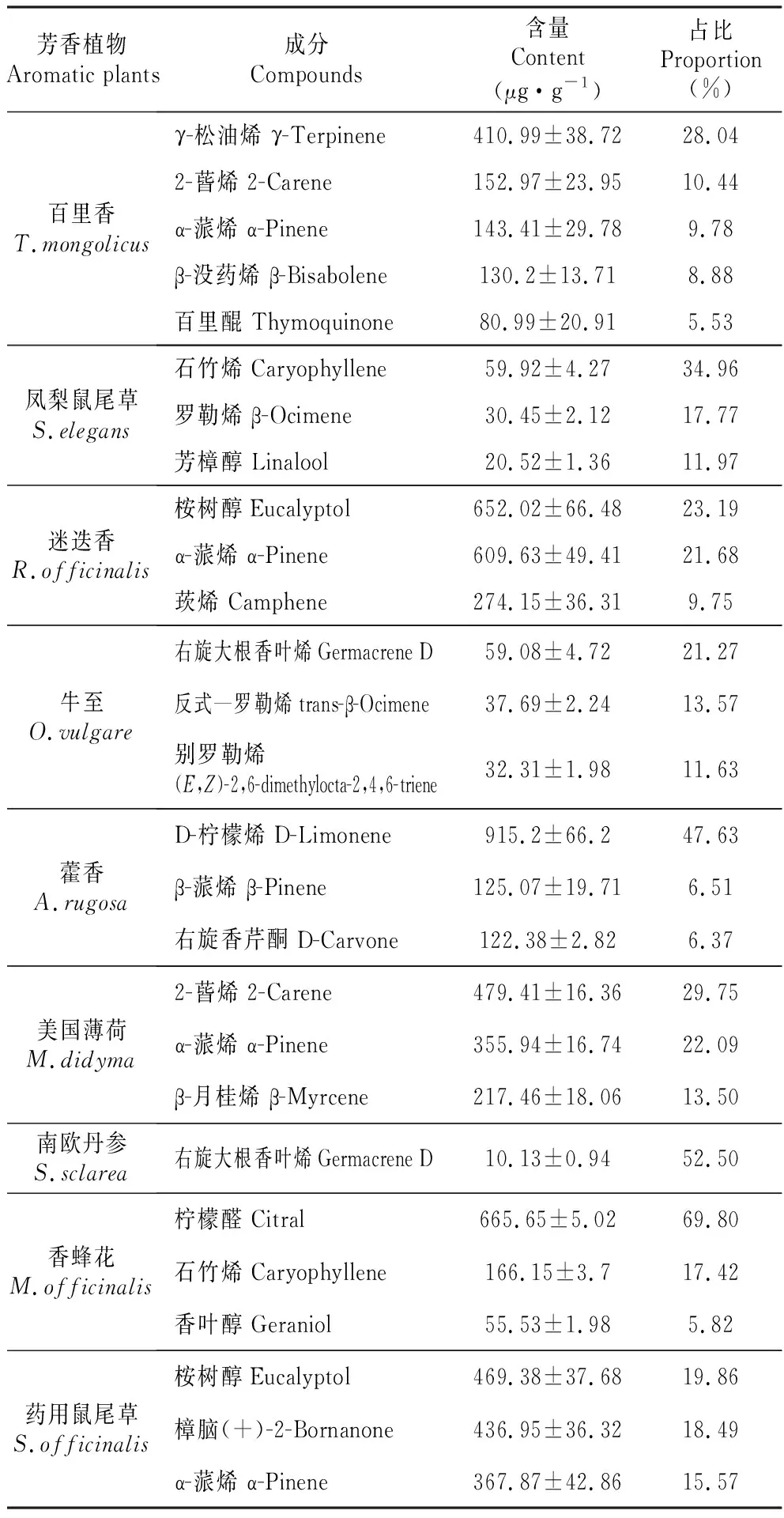
式中:RT(x),RT(z),RT(z+1)分别代表组分及碳数为z,z+1正构烷的保留时间,且RT(z) 本实验采用3个生物学重复,结果以平均值±标准差呈现,P<0.05被认为是具有显著性差异,数据分析在SPSS 19.0软件上进行。 9种芳香植物叶片共检测到77种挥发性萜类物质(见表1),使用NIST(National Institute of Standards and Technology)数据库,依据质谱特征和保留指数并结合相关文献,对9种植物各挥发性萜类成分进行定性分析[17],以乙酸壬酯作为对照品,对挥发性萜类成分进行定量分析。将挥发性萜类根据含有的异戊二烯单元的数目及是否含氧分为4大类:单萜化合物17种、单萜氧化物28种、倍半萜化合物22种,以及倍半萜氧化物10种。其中藿香含有的种类最多(46种),其次是迷迭香(35种)、百里香(33种)、药用鼠尾草(33种)和美国薄荷(31种);牛至(29种)中也含有丰富的种类;凤梨鼠尾草(18种)、香蜂花(13种)和南欧丹参(9种)中种类相对较少。 我们共检测到24种萜类物质是特异存在于单一植物中(见表1)。其中藿香和迷迭香中特异性萜类种数最多,都为7种,而南欧丹参和牛至中没有其物种特异的萜类。百里香中特异存在反式-α-香柑油烯,在部分文献中没有检测到该物质[18~19];凤梨鼠尾草中特异存在别香橙烯和Bicyclogermacrene,但含量较低;藿香中特异存在柠檬烯、顺式氧化柠檬烯、(-)-(E)-氧化柠檬烯、(+)-二氢香芹酮、葛缕醇、反式氧化香芹酮和优葛缕酮,其中柠檬烯在不同产地藿香中均有报道[20~22],而其他成分未见报道;反式-橙花叔醇特异存在于美国薄荷中,但在部分文献中未见报道[23~24];迷迭香中有7种特异存在的化合物,分别是3-蒈烯、龙脑烯醛、异胡薄荷醇、马鞭草烯酮、香茅醇、β-姜黄烯和α-红没药醇,其中异胡薄荷醇、香茅醇在滇产迷迭香中有报道[25],3-蒈烯、马鞭草烯酮、α-红没药醇也被检测到[26],而龙脑烯醛、β-姜黄烯并未见报道;trans-Chrysanthemal、橙花醇和柠檬醛特异存在于香蜂花,其中柠檬醛在香蜂花中普遍存在且含量极高[27~28],因此可以作为鉴定香蜂花品质的标志化合物;侧柏酮、喇叭菜萜醇、葎草烯环氧化物Ⅱ特异存在于药用鼠尾草中,与目前已报道的药用鼠尾草的检测成分一致,但并不是所有报道的药用鼠尾草均显示同时存在这3种成分,大部分的药用鼠尾草均含有侧柏酮,部分药用鼠尾草检测到喇叭菜萜醇或葎草烯环氧化物Ⅱ[29]。 表1 9种芳香植物挥发性萜类成分 续表1 Continued table 1 化学成分Component分子式Formula分子量Molecule保留指数Relentin index百里香T.mongolicus凤梨鼠尾草S.elegans藿香A.rugosa美国薄荷M.didyma迷迭香R.officinalis南欧丹参S.sclarea牛至O.vulgare香蜂花M.officinalis药用鼠尾草S.officinalis(+)-二氢香芹酮 DihydrocarvoneC10H16O1521199--+*------马鞭草烯酮VerbenoneC10H14O1501215----+*----反式—葛缕醇trans-CarveolC10H16O1521220--+++---+香茅醇CitronellolC10H20O1561225----+*----橙花醇NerolC10H18O1541227-------+*-葛缕醇CarveolC10H16O1521232--+*-----+右旋香芹酮D-CarvoneC10H14O1501248--+-+---+香叶醇GeraniolC10H18O1541252----+--+-百里醌ThymoquinoneC10H12O21641254+--+-----反式氧化香芹酮 trans-Carvone oxideC10H14O21661268--+*------柠檬醛CitralC10H16O1521276-------+*-百里香酚ThymolC10H14O1501300+---+-+--优葛缕酮EucarvoneC10H14O1501346--+*------丁子香酚EugenolC10H12O21641359++++-++++合计Total921681614613倍半萜化合物Sesquiterpeneγ-榄香烯 γ-ElemeneC15H242041342-++--++--α-古巴烯 α-CopaeneC15H242041382--++-++-+β-波旁烯 (-)-beta-BourboneneC15H242041393--++--+--(-)-β-榄香烯 (-)-β-ElemeneC15H242041396--++--+--(-)-α-古芸烯 (-)-α-GurjuneneC15H242041418-++------β-依兰烯 β-ylangeneC15H242041427+-++-++--石竹烯CaryophylleneC15H242041429+++++++++bata-古巴西烯 β-copaeneC15H242041438++++-++++γ-依兰油烯 γ-MuuroleneC15H242041453++++--+--蛇麻烯 HumuleneC15H242041463+++++++++别香橙烯 AlloaromadendreneC15H242041471-+*-------(+)-表二环倍半水芹烯(+)-epi-BicyclosesquiphellandreneC15H242041472+-++--+-+右旋大根香叶烯Germacrene DC15H242041490+-++-++--BicyclogermacreneC15H242041504-+*-------α-金合欢烯 α-FarneseneC15H242041505+-----+--β-没药烯 β-BisaboleneC15H242041510+---+----β-姜黄烯 β-CurcumeneC15H242041512----+*----异喇叭烯 IsoledeneC15H242041521-++---+-+cis-β-金合欢烯 cis-β-FarneseneC15H242041526+---+----d-杜松烯 d-CadineneC15H242041529-+++--+--反式-α-香柑油烯 trans-α-BergamoteneC15H242041543+*--------α-依兰油烯 α-MuuroleneC15H242041545-++------合计 Total11111511571436倍半萜氧化物Sesquiterpene oxide反式—橙花叔醇 trans-Nerolidol 2C15H26O2221562---+*-----表蓝桉醇EpiglobulolC15H26O2221585+-++--++-(-)-桉油烯醇 (-)-SpathulenolC15H26O2221588-++---+-+丁香烯氧化物 Caryophyllene oxideC15H24O2201596-+----+++喇叭菜萜醇LedolC15H26O2221605--------+*葎草烯环氧化物ⅡHumulene epoxide ⅡC15H24O2201623--------+*CubedolC15H24O2201626--+---+--杜松醇α-CadinolC15H26O2221666--+---+--α-红没药醇 α-BisabololC15H26O2221691----+*----喇叭烯氧化物 Ledene oxide-(Ⅱ)C15H24O2201700--+---+--合计Total125210624总计 Total33184631359291333 注:“+”代表这种物质在该植物中有检测到;“-”代表这种物质在该植物中未检测到;*表示该化合物在这一植物种特异存在 Note:“+” indicates that this compound was detected in the plant; “-” indicates that this compound was not detected in the plant;*indicates that the compound was specific to this plant species 图2 9种芳香植物挥发性萜类总量 不同小写字母表示9种芳香植物挥发性萜类含量存在显著差异(P<0.05)Fig.2 Total volatile terpenes of nine aromatic plantsDifferent lowercase letters indicate that there are significant differences in volatile terpenes of nine aromatic plants(P<0.05) 利用SPSS软件进行单因素方差分析发现,9种芳香植物间挥发性萜类总含量存在显著差异。结果如图2所示,迷迭香和药用鼠尾草含量较高,均高于2 000 μg·g-1FW;藿香、美国薄荷、百里香和香蜂花挥发性萜类总含量在900~2 000 μg·g-1FW,且百里香与美国薄荷含量无显著差异;牛至和凤梨鼠尾草挥发性萜类总含量较低且无显著差异;南欧丹参含量最低,仅为迷迭香总量的1%。依据本次检测结果,我们认为牛至、凤梨鼠尾草和南欧丹参因其挥发性萜类总量较低,不适宜作为提取挥发性萜类的材料。 石竹烯和蛇麻烯是9种芳香植物的共有挥发性萜类(见图3)。石竹烯也叫β-石竹烯,蛇麻烯也叫ɑ-石竹烯,石竹烯和蛇麻烯是同分异构体,石竹烯含量除在凤梨鼠尾草(34.96%)和香蜂花(17.42%)中比例较高外,其余7种芳香植物中其比例均小于3%。蛇麻烯在9种植物中相对含量普遍较低,均小于6%,在药用鼠尾草中绝对含量明显高于其他几种植物。 图3 9种植物的共有挥发性萜类成分的含量Fig.3 The content of common volatile terpenoids in nine plants 9种芳香植物的主要挥发性萜类成分见表2,百里香中含量最高的化合物是γ-松油烯,为410.99±38.72 μg·g-1,占挥发性萜类总量的28.04%,其次是2-蒈烯、α-蒎烯、β-没药烯和百里醌。这些主要成分与马莉等[18]报道的百里香精油中主要挥发性成分差异较大,可能是不同的提取方式和不同的提取时间导致的差异。 凤梨鼠尾草的主要挥发性萜类成分是石竹烯、罗勒烯和芳樟醇。石竹烯已被证实对金黄色葡萄球菌有抑制作用,广泛存在于多种芳香植物中[30]。迷迭香和药用鼠尾草中含量最高的萜类均为桉树醇,同时含有较多的α-蒎烯和莰烯。樟脑是药用鼠尾草中含量第二高的成分,具有通窍、除湿、杀虫止痛等功能[31];α-蒎烯有抗肿瘤抗真菌等多种活性[32];莰烯又称樟脑萜,是合成樟脑和龙脑的原料,也可以用于合成杀虫剂和防腐剂[33]。 牛至和南欧丹参中含量最高的化合物均为右旋大根香叶烯,除此之外牛至中还含有较多的反式—罗勒烯和别罗勒烯。右旋大根香叶烯被报道对蚊子、扁虱和蚜虫等具有毒性[34]。 藿香中含量最高的化合物是D-柠檬烯,为(915.2±66.2) μg·g-1,占挥发性萜类成分的47.63%,其次是β-蒎烯和右旋香芹酮。3种萜类成分占总挥发性萜类的60%以上。D-柠檬烯在预防和治疗癌症方面具有明显的活性[35],因此近年引起了人们的广泛关注。 美国薄荷中含量最高的化合物为2-蒈烯,其次是α-蒎烯和β-月桂烯。2-蒈烯、α-蒎烯和β-月桂烯均有较高的抗菌作用,因此也被广泛利用。 香蜂花中含量最高的化合物是柠檬醛,为(665.65±5.02) μg·g-1,占挥发性萜类成分的69.80%,其次是石竹烯和香叶醇,3种成分占总挥发性萜类的93.05%。柠檬醛又名香叶醛,特异存在于香蜂花中,具有抗菌活性[36]和柠檬香味,作为食品香料广泛用于需要柠檬香气的各个方面。 表2 9种芳香植物的主要挥发性萜类成分 9种芳香植物不同类型的挥发性萜类组分比例及含量有所不同。如图4所示,所有测定的芳香植物中,倍半萜氧化物含量所占比例普遍较低。每种植物都具有优势成分,其中百里香、藿香、美国薄荷和迷迭香等4种植物的优势萜类组分是单萜化合物,凤梨鼠尾草和南欧丹的优势萜类组分是倍半萜化合物,香蜂花和药用鼠尾草的优势萜类组分是单萜氧化物。牛至中含有的单萜化合物和倍半萜化合物含量相近,单萜氧化物和倍半萜氧化物所占比例较低。 从绝对含量上看,如图5所示,测定的芳香植物中挥发性萜类多集中在单萜化合物及氧化物,倍半萜氧化物含量最少。总体来看,除凤梨鼠尾草、南欧丹参和香蜂花外,其他6种植物单萜类的含量明显高于倍半萜类的含量。 本实验结果得出迷迭香、药用鼠尾草、藿香、百里香和美国薄荷在萜类种类和含量上都相对较高,因此较适宜作为提取挥发性萜类的材料,而牛至、凤梨鼠尾草和南欧丹参中挥发性萜类种类较少、含量较低,因此不适宜作为提取挥发性萜类的材料。虽然检测到24种萜类成分特异存在于单一植物中,但是通过文献比较并不是所有化合物都能在已报道的文献中找到或同时找到,挥发性萜类化合物,作为次生代谢产物,其生物合成及代谢受外界环境的影响而变化,所以在不同生境下的同种植物很可能合成不同的次生代谢产物。因此,导致我们研究结果中部分物种的特异化合物与文献报道有所差异,原因可能是由不同采集时间、不同采集地点以及对挥发性成分的不同提取方式等多种因素所导致的[37]。 图4 9种芳香植物萜类组分比较Fig.4 Comparison of terpenoids in nine aromatic plants 9种植物的共有萜类成分是石竹烯和蛇麻烯,石竹烯和蛇麻烯常常同时出现在植物中,比如有报道在雪松松针和杜鹃叶中同时检测到了石竹烯和蛇麻烯[37~38]。而9种芳香植物的主要成分存在明显差异,相较而言迷迭香和药用鼠尾草的主要成分相近,都含有桉树醇,α-蒎烯,两种植物的主要挥发性气味相近,这与实际两种植物在气味上相近一致。 将9种芳香植物挥发性萜类成分,按照单萜类和倍半萜类分组后,我们发现,百里香、藿香、美国薄荷、迷迭香、香蜂花和药用鼠尾草等6种植物的单萜类成分明显高于倍半萜类。一般认为,植物萜类代谢途径中单萜类成分是通过定位于质体中的MEP途径合成,倍半萜类成分是通过定位于胞质的甲羟戊酸MVA途径合成[39]。MEP途径中提供牻牛儿基二磷酸GPP(C10),被单萜合酶催化生成单萜类化合物;MVA途径中提供法尼基二磷酸FPP(C15),在倍半萜合成酶催化下生成倍半萜类化合物[16]。萜类合酶的数量、单个萜类合酶产生多种萜类化合物的能力以及萜类合酶对底物的亲和力等都是造成植物挥发性萜类成分种类繁多丰富的原因[40],因此上述芳香植物在正常环境中生成单萜类化合物的能力高于生成倍半萜类化合物的能力,可能与其含有的萜类合酶有关,我们的研究结果为芳香植物萜类生物合成途径的解析,以及萜类合酶功能的鉴定提供了重要参考。 挥发性萜类物质是芳香植物的主要活性物质,也是重要的次生代谢产物。不同的芳香植物在萜类种类、含量及组分上存在一定的差异,通过对9种芳香植物萜类组分的分类比较和分析,不仅为芳香植物的合理开发和高效利用提供参考,同时也为植物萜类次生代谢研究提供依据。1.5 统计与分析
2 结果与分析
2.1 9种芳香植物叶片挥发性萜类成分的分析



2.2 9种芳香植物共有挥发性成分的比较

2.3 9种芳香植物的主要挥发性萜类成分的比较
2.4 9种芳香植物的不同类型萜类组分的比较
3 讨论

