基于GC-MS代谢组学技术委陵菜与星毛委陵菜的初生代谢比较研究
2020-07-14吴可心徐明远唐中华
智 慧 艾 丹 吴可心 郭 云 徐明远 唐中华
(1.呼伦贝尔职业技术学院,呼伦贝尔 021000; 2.东北林业大学化学化工与资源利用学院,哈尔滨 150040; 3.黑龙江中医药大学,哈尔滨 150040)
我国蒙药资源丰富,但随着人们的健康意识逐渐增强以及在经济利益的驱动下,一些野生蒙药资源被过度采挖和使用,致使很多药用植物产量持续下降,甚至一些名贵药材濒临灭绝,故对蒙药资源的保护迫在眉睫[1]。蔷薇科(Rosaceae)委陵菜属(Potentilla)植物一般为一年生或多年生草本,少有灌木,广泛分布于北温带,可在多种生境中生长,如在山地灌丛、砾石质坡地、沟谷、林下、林缘、草甸、草原、溪边、农田边及盐碱地均可发现该属植物,多为其他植物群落的伴生种[2]。委陵菜属植物资源丰富,《内蒙古植物志》中记载了28种委陵菜属植物[3]。委陵菜属植物具有非常高的药用、牧用、工业用、观赏以及水土保持价值[4]。
中药委陵菜为蔷薇科植物委陵菜(PotentillachinensisSer.)的干燥全草,具有清热解毒,凉血止痢。用于赤痢腹痛、久痢不止、痔疮出血、痈肿疮毒[5]。研究表明,委陵菜含有黄酮类成分、有机酸类成分、多糖类成分、三萜类等活性成分[6~10],同时,药理研究结果表明,委陵菜具有保护肝脏功能、抗肿瘤、降血糖、抗感染等作用,对胃肠炎、细菌性痢疾有较好的治疗作用[11~16]。星毛委陵菜(PotentillaacaulisL.),别名无茎委陵菜,是一种匍匐型多年生草本植物,生长在典型草原带的沙质草原、砾石质草原及放牧退化草原。通常形成直径30~40 cm的斑块状小群落,是草原放牧退化的标志性植物[17]。
近年来代谢组学尤其是气相色谱与质谱联用技术在民族医药的研究中得到了广泛运用,包括中药整体性评价、中药质量标志物、中药药效作用机制研究,中草药活性成分的研究,中药材基原鉴别,中药代谢及毒理评价等领域有着广泛应用[18~20]。其中,对于药材的基原鉴别报道很多,有研究利用气相色谱—质谱联用技术对3种姜黄属植物进行了质量控制和鉴别的代谢组学研究[21];也有研究利用该技术鉴别了川芎和当归在初生代谢上的差异,找到了两种中药材的差异代谢物[22];还有研究用该技术与其他技术联合使用区分了丁香属药用植物的代谢差异[23]。另外,还有研究利用GC-MS技术对委陵菜中的挥发性成分进行了分析,检定出32个挥发性化学成分,主要为α-法尼烯(17.68%)、2-乙基呋喃(14.48%)、叶醇(7.96%)、可巴烯(6.87%)、己醛(6.76%)、羟基丙酮(5.21%)和石竹烯(4.52%)[24]。
委陵菜作为一种常用的蒙药材,有较好的开发和利用价值,但其同属植物在外观性状上差异并不大,在临床上容易被混用。为了保证药用委陵菜的品质,同时为该属植物的鉴别提供理论依据。本研究利用GC-MS分析技术和代谢组学的研究策略对委陵菜属中药用植物委陵菜和饲用植物星毛委陵菜的全草中的小分子初生代谢物进行全面比较,从初生代谢层面分析比较两种委陵菜属植物的异同。本研究结果弥补了委陵菜属植物初生代谢产物研究的不足,为委陵菜属植物的鉴别药用资源开发和利用提供试验研究基础,对服务于蒙医药产业现代化具有重要的意义。
1 材料与方法
1.1 材料与试剂
植物样品于2018年7月份采自内蒙古鄂温克自治旗,每个植物分别采集3个生物学重复,每个重复包括6株植物全草,经呼伦贝尔学院黄学文教授鉴定分别为委陵菜(PotentillachinensisSer.)和星毛委陵菜(PotentillaacaulisL.),将其洗净后自然晾干,备用。
甲醇(色谱级,北京百灵威科技有限公司)、L-2-氯-苯丙氨酸(阿拉丁)、甲氧胺盐酸盐(上海笛柏生物科技有限公司)、BSTFA(含1%TMCS)衍生试剂(阿拉丁)、正己烷(分析纯,天津市富宇精细化工有限公司)、氯仿(济南汇丰达化工有限公司)、吡啶(阿拉丁)。
1.2 仪器与设备
7890A-5975C气相色谱质谱联用仪(安捷伦公司,美国),BSA224S-CW电子天平(赛多利斯公司,德国),KQ500-DB数控超声波清洗机(昆山超声仪器有限公司),TGL-16高速离心机(湖南湘仪实验室仪器开发有限公司),SHZ-82A气浴恒温振荡器(常州金坛良友仪器有限公司),DK-98-ⅡA电热恒温水浴锅(天津泰斯特仪器有限公司),Xinyi-24高通量组织研磨机(宁波新艺超声设备有限公司),ZLS-2真空离心浓缩仪(湖南赫西仪器装备有限公司)。
1.3 样品的制备
称取委陵菜和星毛委陵菜样品90 mg,放入1.5 mL的离心管中,依次加入2颗小钢珠,540 μL的冷甲醇和60 μL的内标(L-2-氯-苯丙氨酸,0.3 mg·mL-1,甲醇配置),在-80℃冰箱中放置2 min,放入研磨机中研磨(60 Hz)2 min后取出继续超声提取30 min,取出1颗小钢珠,加入300 μL的氯仿,研磨机中涡旋(20 Hz)2 min,加入600 μL的水,研磨机中涡旋(20 Hz)2 min,超声提取30 min,低温离心(14 000 r·min-1,4℃)10 min,取700 μL的上清液,装入玻璃衍生瓶中,快速离心浓缩仪挥干,向玻璃衍生小瓶中加入400 μL的甲氧胺盐酸吡啶溶液(15 mg·mL-1),涡旋震荡2 min后,于震荡培养箱中37℃肟化反应90 min,取出后再加入400 μL的BSTFA(含1%TMCS)衍生试剂和60 μL的正己烷,涡旋震荡2 min后,于70℃反应60 min,取出样品,室温放置30 min,进行GC-MS代谢组学分析。
1.4 数据处理和多元统计分析
使用R软件平台并采用XCMS软件包下进行数据的特征峰提取和预处理,将预处理完毕的数据矩阵归一化后导入SIMCA-P(version 13,Umetrics,Umeå,瑞典)软件进行PCA分析和OPLS-DA等多元统计分析[25],再以据变量对分组贡献得分(VIP得分)大于1和组间变化的差异检验(学生氏t检验)显著性(P<0.05)为差异性代谢产物的筛选标准。并将差异代谢物输入到kegg数据库和MetaboAnalyst(https://www.metaboanalyst.ca/)数据库进行代谢途径的富集和筛选[14]。
2 结果与分析
2.1 GC-MS原始数据的分析和处理
由图1可以看出,两个委陵菜属植物的GC-MS色谱峰基线较平稳,且色谱峰被有效的分离,该方法稳定、可靠,研究数据可进行后续统计分析和处理。另外,两种植物的色谱峰从数量和峰强度也显示出显著不同。对GC-MS原始数据进行预处理后,在两种委陵菜属植物样品中共扫描到134个色谱峰,根据色谱峰的保留时间等信息在NIST数据库和Wiley Registry代谢组数据库对检测到的色谱峰定性注释,共定性出了43个代谢产物。其中,12个代谢产物只存在于委陵菜中,8个代谢产物只存在于星毛委陵菜中,22个代谢物在两物种中都存在,如表1所示。
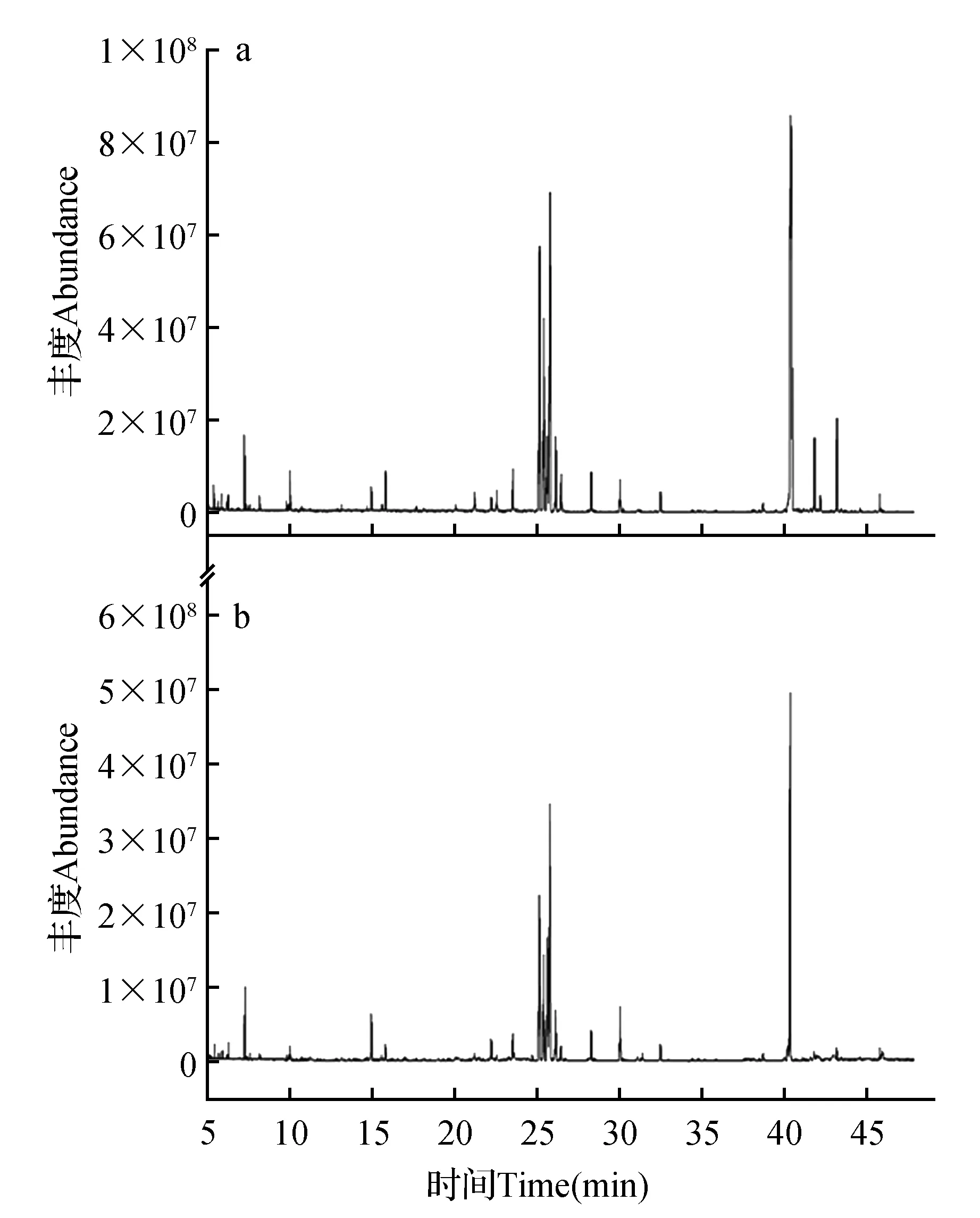
图1 两种为委陵菜属植物的总离子流气相色谱图 a.委陵菜;b.星毛委陵菜Fig.1 Ion flow gas chromatography of two species of Potentilla a.P.chinensis; b.P.acaulis
2.2 两委陵菜属植物的代谢组学差异分析
2.2.1 PCA分析
为判别委陵菜和星毛委陵菜两物种的代谢物累积差异,首先选择主成分分析方法进行分析,得到了一个拟合了2个主成分的PCA模型,累计R2X=0.948,Q2=0.843,2个模型参数数值均大于0.5,且二者数值相差不大,说明所建立的PCA模型稳定,可用于代谢差异分析。由图2可知,委陵菜样品均位于PC1负半轴,星毛委陵菜样品均位于PC1正半轴,二者被明显分开,说明两个物种样品在代谢物的组成上有明显不同。PCA分析的缺点是不能够忽略组内误差,并消除与研究目的无关的随机误差,因此它是一种无监督的分析方法。为更加准确地显示两种委陵菜属植物间的代谢差异,应使用有监督的OPLS-DA模型进行进一步分析。
2.2.2 OPLS-DA模型的分析结果2.2.2.1 OPLS-DA模型的建立
OPLS-DA模型分析的优势是它可以过滤掉代谢物中与分类变量不相关的正交变量,并对非正交变量和正交变量分别分析,可以更加准确的发现代谢物在不同物种中的差异情况。OPLS-DA分析以变量重要性为依据进行差异代谢物筛选,更能把握多位数据整体特征和变异规律[26]。如图3所示,委陵菜样品主要分布在置信区间的左侧,星毛委陵菜样品主要分布在置信区间的右侧,这说明该模型能够对两种委陵菜属植物的样品进行有效区分。建立的OPLS-DA模型共得到2个主成分,RX2=0.951,RY2=1,Q2=1,这3个模型参数均大于0.5,说明本研究中所建立的OPLS-DA模型可能够有效解释两物种间的代谢差异。
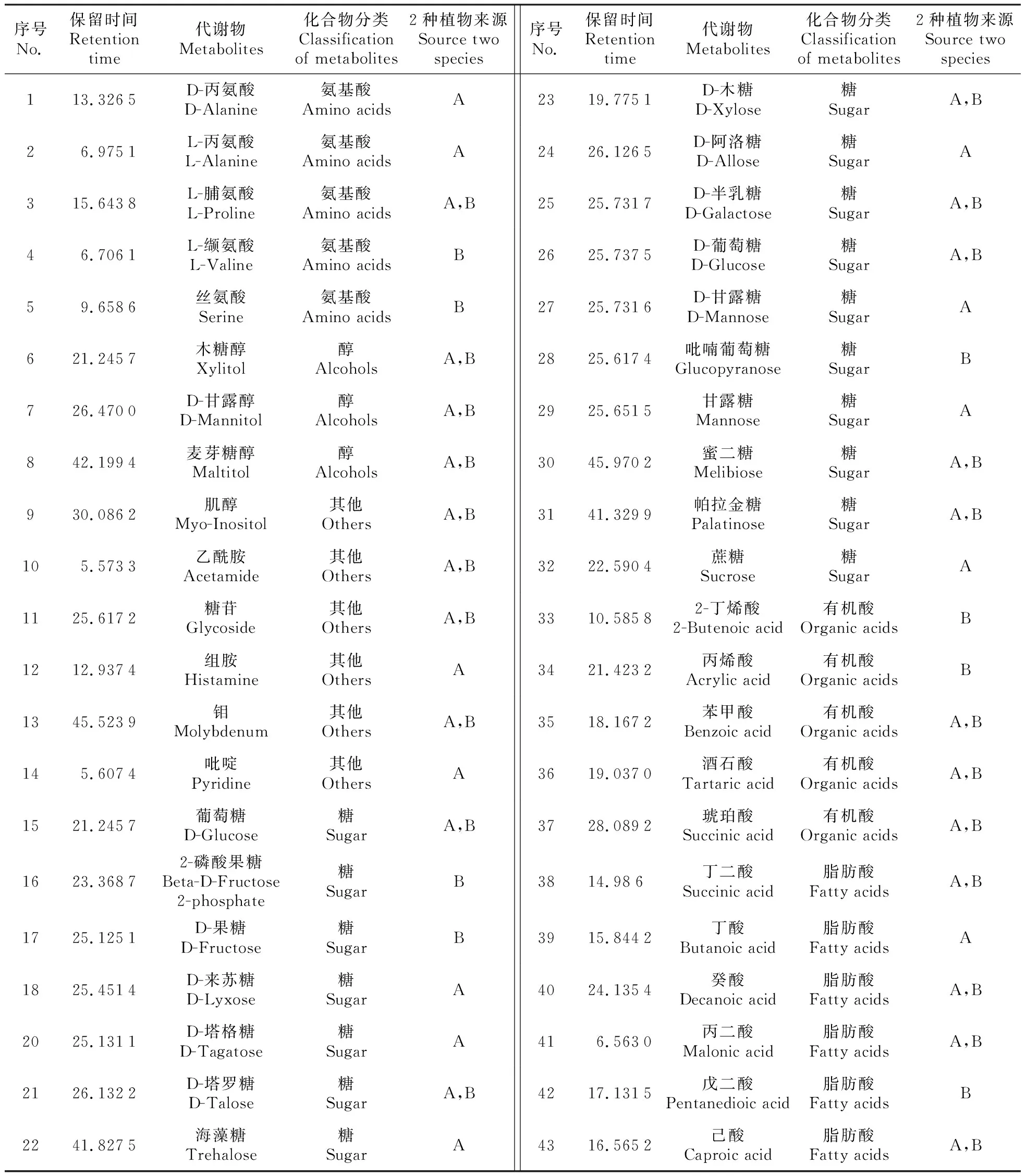
表1 委陵菜和星毛委陵菜样品代谢物的定性结果
注:A.委陵菜;B.星毛委陵菜
Note:A.P.chinensis; B.P.acaulis
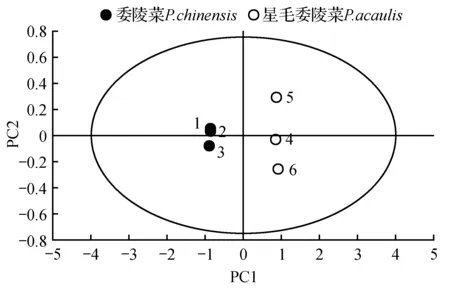
图2 2种样品的PCA得分图Fig.2 PCA scores plot of two samples

图3 2种样品的OPLS-DA得分图Fig.3 OPLS-DA scores plot of two samples
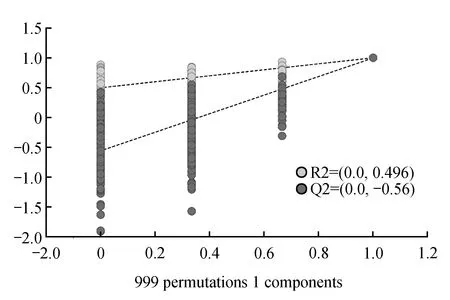
图4 2种样品的OPLS-DA模型置换检验结果Fig.4 Two samples OPLS-DA model permutation test results
2.2.2.2 OPLS-DA模型的置换验证
置换验证通过随机改变分类变量Y的排列顺序,多次建立对应的OPLS-DA模型以获取随机模型的R2和Q2值,可有效评估检验模型是否发生过拟合和评估模型的统计显著性。对OPLS-DA模型的置换检验结果如图4所示。最右侧原始的R2点始终高于左侧的R2点,右侧的原始Q2点始终高于左侧的Q2点,说明OPLS-DA模型不存在过拟合现象,模型稳定性较好,可以较好地解释两组样本之间的差异。
2.2.2.3 两种委陵菜属植物样品间的差异代谢物确定
以OPLS-DA模型的VIP得分(VIP>1),并结合t检验(t-test)的结果P值(P<0.05)来寻找两物种间的标志性差异性代谢物。由表2可知,两委陵菜样品共筛选出33种差异代谢产物,筛选出的33种差异代谢物中17种在委陵菜中的相对含量高于星毛委陵菜,且倍数在3.88~16.19,16种代谢物在星毛委陵菜中的相对含量较高,且倍数在-4.91~-16.176含量差异显著。说明两种植物虽属同属,由于物种不同,相同代谢产物的含量也有明显差异。
2.3 差异代谢物分析
2.3.1 差异性代谢产物通路分析
利用Kegg数据库找到所有差异代谢物KEGG ID,将这些ID输入到MetaboAnalyst数据库通过代谢富集,识别出两物种可能的差别代谢途径,并对这些代谢途径进行筛选,最终获得与代谢物差异相关性最高的途径,结果如表3所示。富集分析共标注到5个较为重要的代谢途径,包括半乳糖代谢、淀粉和蔗糖代谢、氨酰生物合成、氨基糖和核苷酸糖代谢和果糖、甘露糖代谢途径。
2.3.2 不同代谢通路两物种的代谢差异
在图5中显示的是参与代谢途径的主要代谢物在两种委陵菜属植物中相对含量的差异。其中,在半乳糖代谢途径中的代谢物塔格糖、蔗糖、甘露糖只在委陵菜中被检测到,葡萄糖在委陵菜中的相对含量较星毛委陵菜高63.41%,而肌醇和蜜二糖的含量则在星毛委陵菜中的含量较委陵菜中分别高160.40%和133.27%。在淀粉和蔗糖代谢途径中的代谢物蔗糖海藻糖只在委陵菜中被检测到,葡萄糖和木糖的相对含量在委陵菜中的相对含量较星毛委陵菜分别高63.41%和73.37%,而果糖只在星毛委陵菜中被检测到。在氨酰生物合成代谢途径中,丙氨酸只在委陵菜中被检测到,缬氨酸只在星毛委陵菜中被检测到,脯氨酸的相对含量在委陵菜中较星毛委陵菜中高25.28%。在氨基糖和核苷酸糖代谢途径中,甘露糖只在委陵菜中被检测到,果糖只在星毛委陵菜中被检测到,葡萄糖和木糖的相对含量在委陵菜中的相对含量较星毛委陵菜分别高63.41%和73.37%。在果糖和甘露糖代谢途径中,代谢物甘露糖只在委陵菜中被检测到,2-磷酸果糖只在星毛委陵菜中被检测到,甘露醇在星毛委陵菜中的相对含量较委陵菜中高1625.94%。

表2 两物种样品差异代谢物的结果
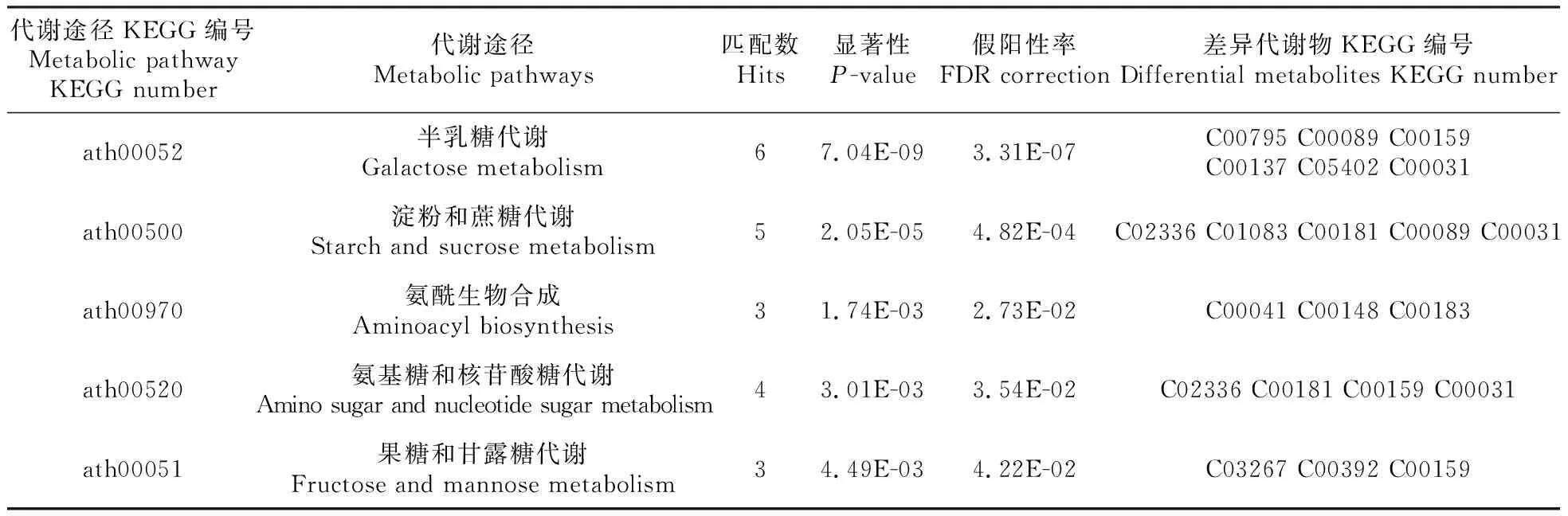
表3 差异代谢物参与的代谢途径明细
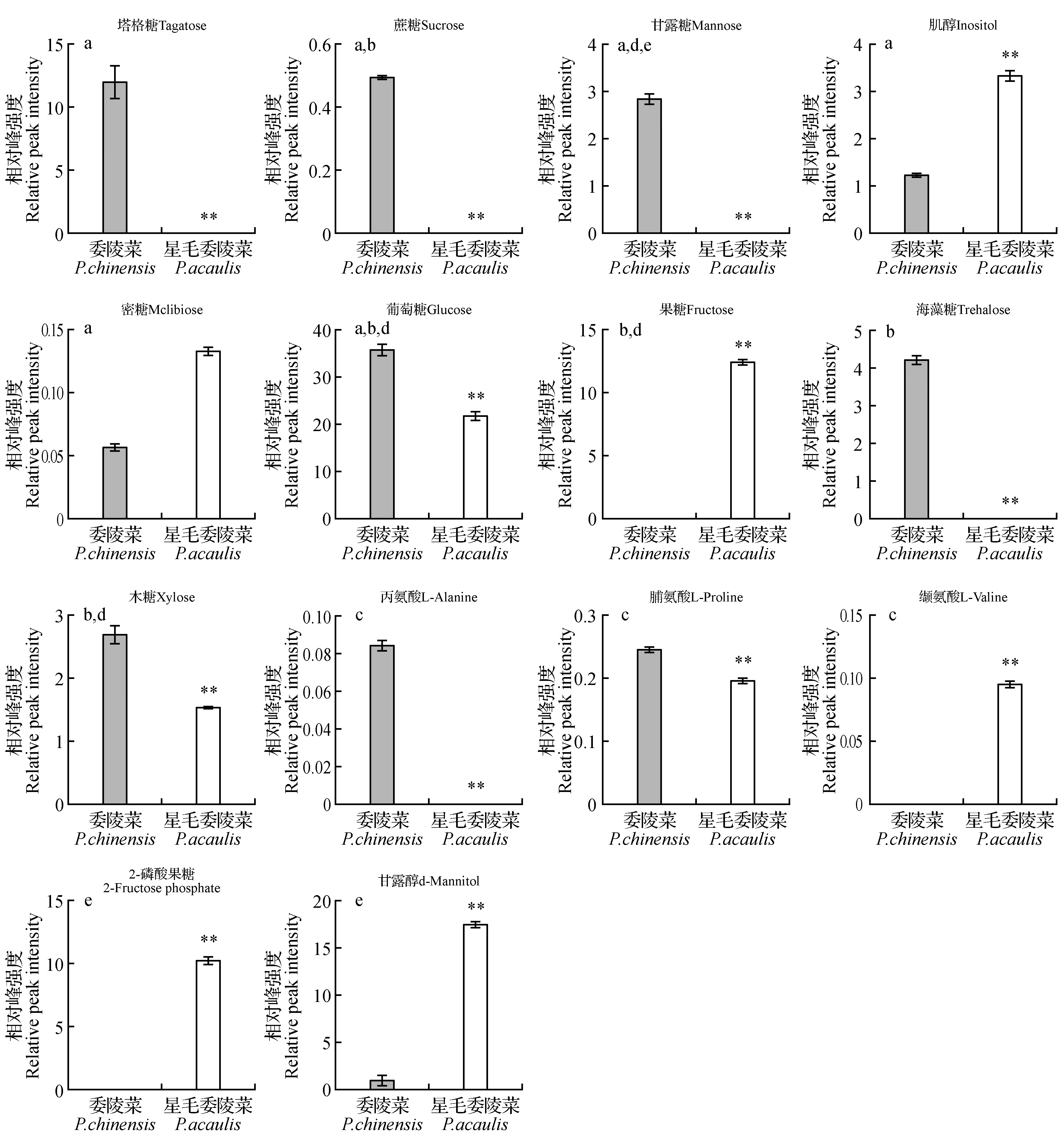
图5 不同代谢途径中主要代谢物在两物种的相对含量差异 a.半乳糖代谢;b.淀粉和蔗糖代谢;c.氨酰生物合成;d.氨基糖和核苷酸糖代谢;e.果糖和甘露糖代谢 字母不同代表该代谢物在两物种间的差异显著(P<0.05)Fig.5 The relative content of major metabolites in different metabolic pathways in the two species is different a.Galactose metabolism; b.Starch and sucrose metabolism; c.Aminoacyl-tRNA biosynthesis; d.Amino sugar and nucleotide sugar metabolism; e.Fructose and mannose metabolism Different letters indicate that the metabolite is significantly different between the two species(P<0.05)
3 讨论
在本研究中,我们利用GC-MS技术及非靶向代谢组学的研究策略研究了在两种委陵菜属植物样品的初生代谢差异,由图1及表1可以看出,在两种植物样品中共扫描到134个色谱峰,鉴定出43个代谢物,代谢物的种类包括糖类、醇类、氨基酸类、有机酸类及脂肪酸类代谢物,前人也就此做了大量的研究。如Aizat等[27]用气相色谱法对辣椒进行代谢组学分析,鉴定了辣椒中的糖、氨基酸、有机酸;也有人利用GC-MS联用技术在对姜科植物的小分子代谢物、初生代谢物进行了分析,鉴定了其中的氨基酸类,糖类、有机酸类和醇类物质[28]。以上研究和本研究的结果均显示,GC-MS技术作为一种成熟的检测手段可用于两个委陵菜属植物的代谢轮廓分析。
多元统计分析,作为一种常用的分析手段越来越多的应用到中药材代谢组数据分析中,有研究利用多元统计分析比较了东北林蛙油及其类似品、伪品的聚丙烯酰胺凝胶电泳图谱,结果显示,OPLS-DA的分析结果优于无监督的PCA分析和系统聚类分析[29]。从表1可以看出,在鉴定出的43种代谢物中,除了12种代谢物在委陵菜中特异性的积累,8种代谢物在星毛委陵菜中特异性的积累,另外有22种代谢物在两物种中同时积累,需要合适的方法来找到两物种的差异代谢物,进而区分两物种在代谢途径上的差别。本研究采用PCA和OPLS-DA的统计学方法显示来分析两种委陵菜属植物的代谢差异,图2中PCA得分图结果显示,鉴定的43种代谢物在两物种的累积显示出显著的差异,进一步利用OPLS-DA结合分析t检验找到了两物种的差异代谢物33个。以上结果表明,多元统计分析方法可显著区分本研究中的两个植物,且相关模型的建立稳定可靠。
本研究利用OPLS-DA分析找到的两个物种的33种差异代谢物输入到MetaboAnalyst数据库中进行通路富集,共富集到半乳糖代谢、淀粉和蔗糖代谢、氨基糖和核苷酸糖代谢、果糖和甘露糖代谢和氨酰生物合成5个主要的代谢途径,其中,前4个代谢途径在植物中均属植物碳代谢范畴,氨酰生物合成属植物氮代谢范畴。碳水化合物是植物光合作用的主要产物之一,可分为以木质素和纤维素为代表的结构性碳水化合物和以葡萄糖、蔗糖糖为代表的非结构性碳水化合物[30]。非结构性碳水化合物直接参与植物的许多重要的生命代谢过程,对植物的生长发育和植物物质对环境因子的响应有着重要的影响[31]。由图5结果显示,在参与代谢途径的9种糖类物质中,塔格糖、蔗糖、甘露糖、葡萄糖、海藻糖和木糖在委陵菜中的累积显著高于星毛委陵菜,而蜜二糖、果糖和2-磷酸果糖主要在星毛委陵菜中累积,这表明两物种从光合作用到初级能量转化的碳代谢有着显著的不同。本研究中在氨酰生物合成富集到的3个代谢物均属于氨基酸类代谢物,此类代谢物主要参与植物的氮素代谢[32~33]。它们在植物体内有多种生物功能,如提高植物的抗病能力[34],抵御生物胁迫与非生物胁迫的能力[35~36],调节植物的生长发育[37~38],同时该类物质通过次生代谢途径可合成多种次生代谢物质[39]。在本研究中,通过代谢通路富集到3个氨基酸类代谢物中,丙氨酸、脯氨酸在委陵菜中的累积高于星毛委陵菜,缬氨酸则主要存在于星毛委陵菜中。研究结果表明,两委陵菜属植物在植物碳、氮代谢均显示出显著的不同,这从初生代谢角度为星毛委陵菜没有和委陵菜一样被作为药用植物提供了一定的理论依据。
4 结论
本研究基于GC-MS的代谢组学技术对来自内蒙古药用植物委陵菜和内蒙古草原常见的牧草星毛委陵菜样品进行代谢组学分析,考察了委陵菜属两种常见物种的代谢差异。实验共鉴定出43个代谢产物,其中,8个代谢产物只存在于委陵菜中,12个代谢产物只存在于星毛委陵菜中,22个代谢产物在两个物种中都存在。对样品进行了主成分分析和正交偏最小二乘法分析,找到了两个物种间的33种差异代谢物,其中,17种代谢物在委陵菜中的相对含量高于星毛委陵菜,16种代谢物在星毛委陵菜中的相对含量较高。代谢通路富集结果表明,两物种的C、N代谢相关途径也显著不同。综上所述,基于GC-MS技术的代谢组学分析方法用于分析不同物种的委陵菜属植物代谢轮廓具有一定的可行性,可为不同物种药用植物的次生代谢物累积的差异以及药理药效的不同的研究提供理论依据。本研究的结果表明,利用气相色谱与质谱联用技术,结合代谢组学的研究方法和思路,分析和比较委陵菜属植物初生代谢产物的代谢差异,可为该属植物的药用资源开发提供理论基础。
