新型佐剂α-甘露聚糖肽对E75多肽肿瘤疫苗在转基因小鼠体内免疫效果的影响
2020-07-14王亚文李义平
王 威,许 薇,王亚文,李义平,王 冰
(1西安交通大学第一附属医院检验科,西安 710061;2西安交通大学医学部药学院药物化学系;3西安交通大学医学部基础医学院病理学系;*通讯作者,E-mail:Wangbing@mail.xjtu.edu.cn)
α-甘露聚糖肽又名多抗甲素(polyactin A,PA)是从正常人咽喉部分离的甲型溶血性链球菌33号菌株的深层培养液中经乙醇提取得到的一种糖肽类物质[1],是西安交通大学医学院自主研发的国内首创的生物反应修饰物,具有自主知识产权。PA是由糖链结构一致、分子量和氨基酸含量不同的几种均一糖肽构成的混合物,具有特殊的生物活性,对各类免疫细胞均存在正向调节的作用,具有成为免疫佐剂的潜能[1-3]。PA作为佐剂应用于基于体液免疫的EV71疫苗以及甲型流感疫苗取得了良好的效果[3-5]。然而,PA是否对基于细胞免疫的多肽类肿瘤疫苗具有佐剂作用还需确认。E75 P369-377(KIFGSLAFL)是HER2/neu蛋白胞外区的的一段具有免疫原性的多肽,也是HLA-A2限制性表位,可以被细胞毒性T细胞(cytotoxic T lymphocyte,CTL)识别[6,7]。经证实,E75肽疫苗对预防HER2/neu过表达的乳腺癌治疗后的复发转移是安全、有效的。本研究以目前效果明确的且基于细胞免疫的E75多肽配伍不同浓度的PA,主动免疫转基因小鼠,探讨PA作为基于细胞免疫的多肽类肿瘤疫苗佐剂的可行性。
1 材料与方法
1.1 实验动物
SPF级6-8周龄雌性C57BL/6-Tg(HLA-A2.1)1Enge/J小鼠(HLA-A2+转基因小鼠),体质量(20±2)g,购自南京大学模式动物研究所。
1.2 主要试剂与仪器
α-甘露聚糖肽(成都凯捷生物医药科技发展有限公司);E75多肽(成都凯捷生物医药科技发展有限公司);CCK-8试剂盒(碧云天生物技术研究所);IFN-γ ELISA试剂盒(美国R&D公司);兔抗鼠PerCP标记的CD3,PE标记的CD4,FITC标记的CD8流式试剂(美国BD Biosciences公司);RPMI-1640、胎牛血清(美国HyClone公司);植物血凝素(PHA,美国Sigma公司);小鼠淋巴细胞分离液(天津灏洋生物制品科技有限公司)。CO2培养箱(美国Thermo公司);流式细胞仪FACscanto Ⅱ(美国BD Biosciences公司)。
1.3 动物分组及免疫接种
C57BL/6-Tg(HLA-A2.1)1Enge/J雌性小鼠共51只,随机分为6组。4组佐剂疫苗组与单独E75疫苗免疫组,每组9只小鼠,其中3只小鼠仅免疫一次,用于急性毒性观察;同时设置空白对照组,含6只小鼠。佐剂疫苗组抗原E75定量为50 μg/0.1 ml,PA佐剂剂量采用对数等距设计,剂量设置包括30 μg/0.1 ml、100 μg/0.1 ml,300 μg/0.1 ml,1 000 μg/0.1 ml,标记为E75+30 μg PA组,E75+100 μg PA组,E75+300 μg PA组,E75+1 000 μg PA组;单独E75疫苗免疫组,E75定量为50 μg/0.1 ml,标记为E75组;空白对照组仅注射生理盐水。E75和PA采用生理盐水按上述浓度溶解,临用时按比例混合,总体积为0.2 ml。所有组小鼠进行颈背部与后腿部皮下两点接种,分别于第0,7,14天免疫,于第28天进行样本采集。
1.4 甘露聚糖肽佐剂多肽E75的局部刺激性与急性毒性观察
对所有小鼠的外观体征、行为活动、局部刺激性进行观察。局部刺激反应分级标准见表1。局部刺激强度评价标准为:无刺激性(0-0.49分),轻度刺激性(0.5-2.99分),中度刺激性(3.0-5.99分),强刺激性(6.0-8.0分)。E75+30 μg PA组,E75+100 μg PA组,E75+300 μg PA组,E75+1 000μg PA组及E75组各3只小鼠在首次给药后第2天行断椎处死,取心、肺、脾、肾和肝脏进行病理切片,观察各脏器是否存在急性毒性反应的病理变化。
表1 局部刺激反应分级标准
Table 1 Grading criteria for local stimulus response
1.5 体质量监测
分别在免疫第1天、第7天、第14天和第28天称量体质量。每次在同样时间段称取每只小鼠体质量,记录并绘制每组小鼠平均体质量的变化趋势。
1.6 E75肽特异性淋巴细胞增殖实验
免疫过程结束后,小鼠行断椎处死,立即取出脾脏。脾脏经碾磨后,悬液于200目钢网滤过。将滤液叠加于2 ml淋巴细胞分离液上,采用2 000 r/min,离心15 min。取中间细胞层,用2 ml PBS洗涤2次,弃上清。加入1 ml含10%胎牛血清的RPMI-1640制成脾细胞悬液,取10 μl进行台盼蓝染色,在显微镜下计数活细胞数,并调整脾细胞数为5×104个/ml备用。实验组为E75+30 μg PA组,E75+100 μg PA组,E75+300 μg PA组,E75+1 000 μg PA组及E75组小鼠脾细胞;空白对照组小鼠脾细胞分别用于设置细胞实验的阳性对照组及阴性对照组。实验组加入50 μg/ml E75再刺激;阳性对照组加入10 μg/ml PHA刺激;阴性对照组仅含脾细胞和培养液,100 μl/孔加入96孔板,每组设4个复孔。在37 ℃、5%CO2饱和湿度条件下培养3 d后,每孔加CCK-8试剂10 μl,继续孵育2 h,用酶标仪450 nm处检测吸光度,按下式计算淋巴细胞刺激指数(SI):SI=实验孔OD平均值/阴性对照孔OD平均值。
1.7 IFN-γ细胞因子检测
脾细胞处理如1.6所示。取浓度为5×104个/ml的脾细胞,E75+30 μg PA组,E75+100 μg PA组,E75+300 μg PA组,E75+1 000 μg PA组及E75组小鼠脾细胞加入50 μg/ml E75刺激;空白对照组小鼠脾细胞仅加入培养液,100 μl/孔加入96孔板,每组设4个复孔。细胞于37 ℃、5%CO2饱和湿度条件下培养3 d后,将培养板进行1 000 r/min,共离心10 min。离心后,分别取各组上清液按IFN-γ细胞因子ELISA试剂盒说明进行检测。样本于酶标仪450 nm处检测吸光度,计算各组特异性细胞因子IFN-γ的水平。
1.8 淋巴细胞亚群分析
小鼠行断椎处死前,于内眦静脉取血,采集约200 μl全血于EDTA抗凝管中,充分混匀使其抗凝备用。每只小鼠取EDTA抗凝全血50 μl,加入PerCP标记的CD3,PE标记的CD4,FITC标记的CD8荧光抗体各20 μl。标本室温避光孵育20 min后,加入500 μl PBS后进行流式细胞检测。
1.9 统计学分析
实验中所有数据均采用均数±标准差表示,实验结果采用SPSS18.0统计软件进行处理。实验结果组间比较采用单因素方差分析,各组间样本均数的两两比较采用q检验,P<0.05为差异具有统计学意义。
2 结果
2.1 PA佐剂多肽E75疫苗的局部刺激性和急性毒性观察
对小鼠的外观体征进行观察,在实验时间内各组小鼠毛色光滑,行为活动正常。通过对PA佐剂多肽E75疫苗注射部位局部观察,按照“局部刺激反应分级标准”记录注射部位局部的状态,E75+30 μg PA组、E75+100 μg PA组、E75+300 μg PA组、E75+1 000 μg PA组及E75组及空白对照组的评分均为0分,表明PA佐剂多肽E75疫苗对注射部位局部没有刺激性。E75+30 μg PA组、E75+100 μg PA组、E75+300 μg PA组、E75+1 000 μg PA组及E75组小鼠首次给药后,取小鼠心、肺、脾、肾和肝脏进行病理切片,均未见病理性改变。结果表明,PA佐剂多肽E75疫苗对小鼠无急性毒性。
2.2 体质量监测结果
给药后,各组小鼠体质量变化见图1。PA佐剂多肽E75疫苗组、E75单独免疫组与空白对照组小鼠体质量均随时间延长而增加,体质量增长率接近,并且在各时间点,PA佐剂多肽E75疫苗各组小鼠平均体质量及单独E75单独免疫组与空白对照组比较无显著性差异(P>0.05),表明PA佐剂多肽E75疫苗对小鼠体质量无影响。
2.3 各组E75特异性脾淋巴细胞增殖率的比较
免疫后的小鼠分别用E75多肽、PHA再刺激,使其脾淋巴细胞体外增殖,结果见图2。与阴性对照组相比,阳性对照组刺激指数明显升高(P<0.05),E75组小鼠脾淋巴细胞未出现明显增殖效应(P>0.05)。与E75组相比,E75+30 μg PA组和E75+100 μg PA组脾淋巴细胞的增殖效应明显增强(P<0.05),且E75+100 μg PA组增殖效应最强。E75+300 μg PA组与E75+PA 1 000 μg组小鼠脾淋巴细胞增殖效应降低,且与E75组相比无统计学差异(P>0.05)。由此表明,E75多肽刺激脾细胞产生免疫效应需要佐剂辅助,而合适浓度的PA作为免疫佐剂可以在体内明显辅助增强E75的免疫效应。

图1 PA各次免疫后各组小鼠体质量变化Figure 1 The weight variation of mice in different groups after each immunization
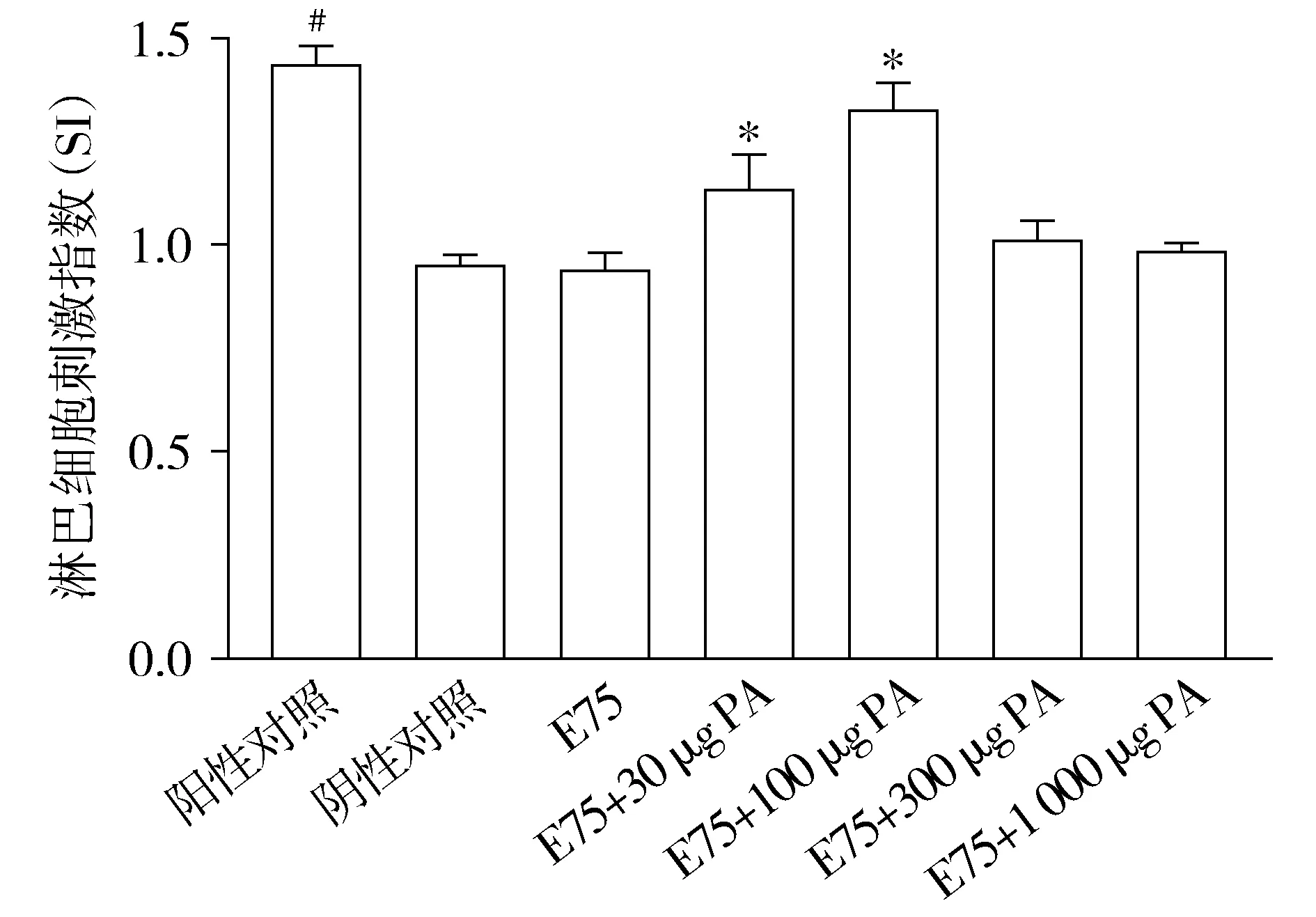
与阴性对照组相比,#P<0.05;与E75组相比,*P<0.05图2 免疫计划完成后各组小鼠E75特异性脾淋巴细胞增殖效应Figure 2 E75-specific splenocytes proliferative responses of mice in different groups after the last immunization
2.4 各组特异性细胞因子IFN-γ的比较
第3次免疫后,取各组小鼠的脾细胞经E75再刺激,产生的效应细胞会针对特异性抗原(E75)产生细胞因子IFN-γ,结果见图3。通过利用ELISA对不同处理组细胞炎症因子IFN-γ的分泌水平进行检测,结果表明,与空白对照组相比,E75多肽单独免疫组小鼠脾细胞IFN-γ含量无明显变化(P>0.05)。然而,与E75组相比,E75+30 μg PA组和E75+100 μg PA组IFN-γ分泌明显增加(P<0.05),且E75+100 μg PA组IFN-γ的分泌水平最高;E75+300 μg PA组与E75+1 000 μg PA组脾淋巴细胞IFN-γ分泌减低,且低于E75组(P<0.05)。此结果进一步说明在体内PA可作为免疫佐剂辅助增强E75的免疫效应。

与E75组相比,*P<0.05图3 免疫计划完成后各组小鼠脾细胞IFN-γ分泌水平Figure 3 IFN-γ Levels of mice splenocytes in different groups after the last immunization
2.5 各组淋巴细胞亚群分析
通过流式细胞术对免疫后各组小鼠外周血淋巴细胞亚群进行定量检测,结果见图4。与阴性对照组相比,E75组的小鼠外周血淋巴细胞亚群比例无显著差异(P>0.05)。PA协同E75多肽的佐剂疫苗组中,E75+30 μg PA组、E75+100 μg PA组与E75组相比CD4+T细胞的比例明显增加(P<0.05),且在E75+100 μg PA组达到峰值;E75+300 μg PA组与E75+1 000 μg PA组CD4+T细胞比例降低,但仍高于E75组(P<0.05)。佐剂疫苗组的CD8+T细胞比例与E75组相比明显增高(P<0.05),E75+30 μg PA组与E75+100 μg PA组的CD8+T细胞比例均达到峰值,且两组间无显著差异(P>0.05)。因此,PA作为佐剂能够一定程度同时刺激机体的细胞免疫及体液免疫。
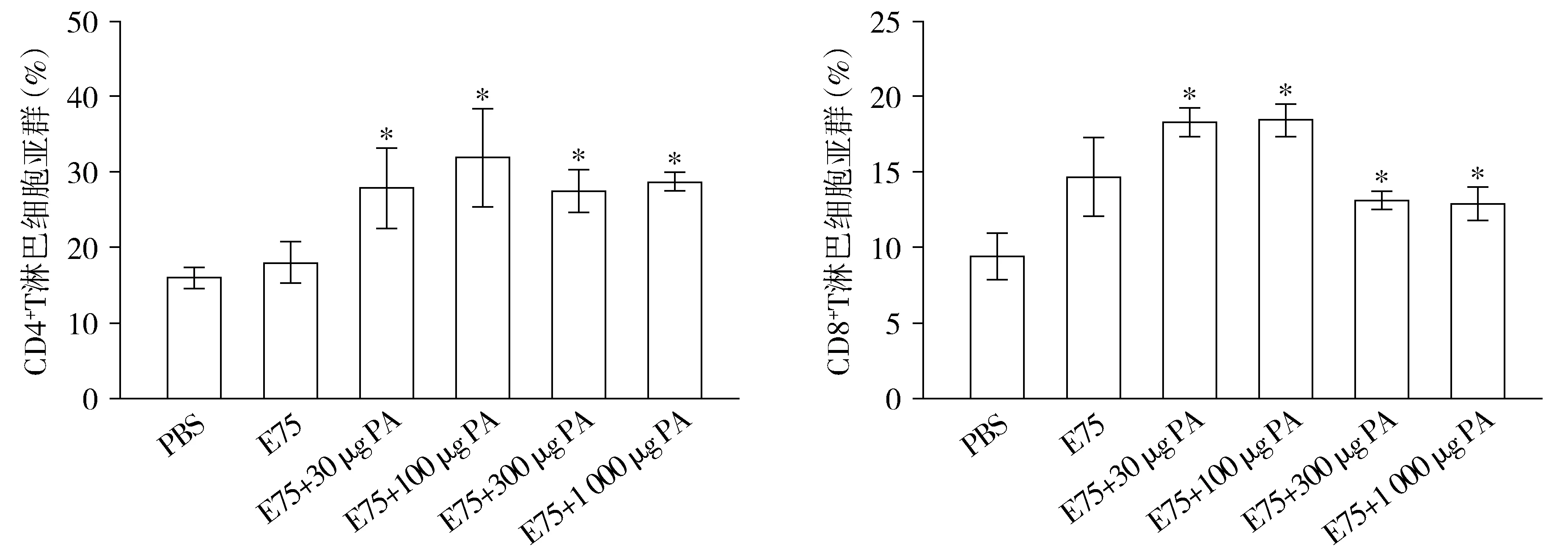
与E75组相比,*P<0.05图4 免疫计划完成后各组小鼠外周血CD4+、CD8+T淋巴细胞亚群分析Figure 4 Analysis of T lymphocyte subsets in peripheral blood of mice in different groups after the last immunization
3 讨论
肿瘤疫苗免疫是利用肿瘤抗原或肿瘤相关抗原、免疫细胞或免疫分子激活免疫系统,诱导机体特异性免疫应答的一种治疗方法,已成为抗肿瘤免疫治疗的研究热点。基于合成多肽的肿瘤疫苗,因为具有高的安全性、能诱导高特异性免疫应答、不引起自身免疫反应或免疫抑制的优点,受到愈来愈多的关注[8]。肿瘤抗原多肽能够结合抗原呈递细胞(antigen presenting cell,APC)表面的主要组织相容性复合体(major histocompatibility complex,MHC)分子,形成肽-MHC-T细胞受体(T cell receptor,TCR)复合物,引起相应的细胞毒性T淋巴细胞(cytotoxic T lymphocyte,CTL)免疫反应,从而靶向杀伤肿瘤细胞[9]。但是,肿瘤多肽疫苗通常表位小,免疫原性弱,难以引起高强度的免疫应答[8,9],有必要寻找高效安全的佐剂来增强此类肿瘤多肽疫苗的免疫原性,提高患者机体对疫苗的免疫应答。E75多肽疫苗是由来源于HER2/neu蛋白的合成肽E75及细胞因子佐剂粒细胞巨噬细胞集落刺激因子(rhGM-CSF)组成的肿瘤多肽疫苗,对预防HER2/neu过表达的乳腺癌治疗后的复发转移是安全、有效的[6,7]。该疫苗能刺激患者自身的免疫系统,产生E75特异性的CD8+CTL,并对过表达HER2/neu蛋白的乳腺肿瘤细胞进行靶向杀伤。由于E75是仅含9个氨基酸的小分子多肽,虽然不易诱导自身免疫反应,但其免疫原性弱,需加入佐剂增强其免疫原性。本研究中,E75多肽单独免疫的小鼠与阴性对照组相比,脾淋巴细胞经抗原再刺激后,其淋巴细胞增殖率、IFN-γ分泌水平和淋巴细胞亚群比例无统计学差异,但加入特定浓度的PA佐剂的实验组各项指标均有提高。本研究结果再一次证实,免疫原性弱的小分子肿瘤多肽疫苗需要加入佐剂提高机体对疫苗的免疫应答。本课题选用的E75多肽,其作用原理明确,临床实验结果有效,可以除外由抗原无效导致的不确定因素,明确PA的佐剂效应。因此,采用E75辅助研究PA作为细胞免疫新型佐剂的可行性是合理的。
在我国,PA作为一种免疫增强剂已有30余年的临床应用史,可以广泛作用于各类免疫组织与免疫细胞,增强患者的抵抗力以及对抗原的应答效应,其调节免疫的功能已得到证实,并在肿瘤患者的辅助性治疗中取得了良好的效果[10,11]。PA在增强肿瘤患者免疫反应性方面存在明显的优势,有作为佐剂应用于肿瘤多肽疫苗研发的可能性。本研究中,以PA为佐剂的E75多肽疫苗,采用HLA-A2+转基因小鼠体内递呈E75多肽,刺激小鼠产生免疫反应,被免疫小鼠无局部刺激性和急性毒性,其应用是安全的。实验结果表明,特定浓度范围内的PA作为佐剂能够辅助多肽E75在小鼠(HLA.A2转基因)体内产生明显的免疫应答。免疫完成后,CD8+的CTL作为抗肿瘤的效应细胞,其比例在佐剂PA浓度为30 μg/0.1 ml和100 μg/0.1 ml时显著升高;并且再接受E75抗原刺激后,其分泌的IFN-γ水平也相应增高,在佐剂PA浓度为100 μg/0.1 ml时达到峰值。CD4+T细胞比例也在佐剂浓度为100 μg/0.1 ml时达到峰值。前期研究表明,体内的肿瘤抗原表位特异性的免疫应答,需要通过抗原呈递细胞递呈肿瘤抗原和严格的CD4+T细胞交叉激活,活化的CD4+辅助性T细胞是维持CTL应答的必要条件[9,12]。因此,有效的以细胞免疫为基础的肿瘤多肽疫苗需同时刺激CD4+T、CD8+T细胞的活化,本研究中小鼠的免疫应答强度对PA佐剂存在剂量依赖,在佐剂PA浓度为100 μg/0.1 ml所显示的免疫效应达到峰值,进一步证实了PA的佐剂作用。
本研究初期设计,欲通过动物实验整体观察PA佐剂疫苗的免疫效应,检验PA作为基于细胞免疫的多肽肿瘤疫苗佐剂的假说是否成立,基于对实验有效性与经济性的考虑,根据量效实验等比设计的原则,设置了多个跨度较大的佐剂浓度梯度。其中,筛选出了PA佐剂的最佳剂量,在浓度为100 μg/0.1 ml时能够同时刺激CTL与辅助性T淋巴细胞增殖,达到最佳的免疫状态。然而,当PA浓度为300 μg/0.1 ml和1 000 μg/0.1 ml时,虽然CD8+T细胞亚群比例升高,但其针对特异性抗原(E75)产生细胞因子IFN-γ与单独疫苗组相比并无统计学差异。分析原因,可能为高浓度的PA佐剂抑制了CD8+T细胞的活性,但高浓度的PA是否会抑制CTL对靶细胞的杀伤作用还需进一步确认。
综上所述,本研究关于PA可作为基于细胞免疫的多肽类肿瘤疫苗的佐剂的假说是成立的。进一步选择人体细胞进行体外实验是可行的,但需筛选HLA-A2基因显性表达的个体,细化PA的浓度梯度,监测多个免疫细胞如CD4+、CD8+T细胞以及抗原递呈细胞树突细胞等指标。α-甘露聚糖肽作为有自主知识产权的药物,在我国已广泛应用于临床的多个领域,如果能把PA作为佐剂应用于基于细胞免疫的肿瘤多肽疫苗,扩展PA的应用范围,将为患者提供更为经济安全的用药选择。
