姜黄素诱导小鼠腹腔巨噬细胞向替代激活M2表型极化的机制研究
2020-07-14陈方圆白晓君李娟利袁祖贻
陈方圆,田 刚,白晓君,李娟利,袁祖贻
(西安交通大学第一附属医院心血管内科,西安 710061;*通讯作者,E-mail:chenfy-608@163.com)
巨噬细胞是维持机体免疫系统内环境稳定的主要细胞,通过增强免疫应答对感染做出反应,参与机体炎症免疫反应的全过程。静止状态的巨噬细胞称为M0表型,根据活化方式及活化后的功能,巨噬细胞能极化成两种不同的表型:经典活化炎症表型M1型和替代激活抗炎表型M2型[1]。巨噬细胞也是可塑性细胞,具有随微环境中刺激因素的变化而从一种表型向另一种表型转换的能力,在特定条件下,已经分化的M1和M2表型巨噬细胞之间也可以相互转化[2]。在炎症发生发展过程中,由于不同细胞因子及信号通路的影响,两种表型巨噬细胞处于一个动态平衡,因此,巨噬细胞向何种表型极化决定了炎症的最终转归[3],在进展期炎症性疾病中以M1表型巨噬细胞为主。上述机制对一些炎症免疫性疾病的治疗有一定的指导意义。
过氧化物酶体增殖物激活受体-γ(peroxisome proliferator activated receptor-gamma,PPAR-γ)活化在巨噬细胞极化过程发挥重要的作用,活化的PPAR-γ能促进巨噬细胞向M2表型极化,而缺乏PPAR-γ巨噬细胞则向M1表型极化[4]。据报道姜黄素是PPAR-γ的天然活化剂[5]。我们前期研究发现,姜黄素可通过活化PPAR-γ诱导M1表型巨噬细胞向M2表型转换[6],同时炎症反应减轻。本文旨在探讨姜黄素是否也能通过活化PPAR-γ直接诱导巨噬细胞向M2表型极化从而发挥其抗炎及免疫调节作用。
1 材料与方法
1.1 主要试剂
DMEM高糖培养基加入10%胎牛血清(美国,Hyclone公司);姜黄素、噻唑蓝(MTT)、GW9662(PPAR-γ阻断剂)(美国,Sigma公司);白细胞介素-4(IL-4)(美国,Peprotech公司);总RNA提取试剂盒(上海飞捷公司);逆转录试剂盒及real time PCR试剂盒(大连,TaKaRa公司);兔抗KLF4(Kruppe样因子4)抗体(美国,cell signal公司)、兔抗FIZZ1(found in inflammatory zone 1)抗体(美国,Abcam公司)、兔抗PPAR-γ抗体(美国,Santa Cruz公司)、兔抗GAPDH抗体(美国,Proteintech公司)、抗兔二抗(美国,Santa Cruz公司)。
1.2 小鼠腹腔巨噬细胞的分离、培养、诱导及鉴定
6-8周清洁级C57/BL6小鼠颈椎脱臼处死(实验室保种),75%酒精侵泡5 min,从尾部提起小鼠保持倒立姿势同时腹腔注入无血清DMEM培养液5 ml,仰卧平放并轻揉小鼠腹部2-3 min,静置5-7 min,无菌条件下打开小鼠腹腔,观察肠管变扁且腹腔液为淡黄色时,用注射器抽取腹腔液4-4.5 ml,离心洗涤后显微镜下计数,常规DMEM培养液(含10%胎牛血清),调整细胞至所需浓度,置于培养箱中,培养12 h换液,去除掉少数未贴壁细胞[7]。IL-4(10 ng/ml)干预巨噬细胞12 h诱导巨噬细胞呈抗炎表型M2巨噬细胞[6]。
经前面所述方法分离出来的小鼠腹腔巨噬细胞(M0)经过流式细胞仪进行鉴定。小鼠巨噬细胞表面特异标记有F4-80和CD11b[8]。F4-80用FITC标记,CD11b用PE标记。选择这两个指标同时对提取的小鼠腹腔巨噬细胞进行鉴定,双标记阳性则鉴定为小鼠腹腔巨噬细胞。
1.3 实验分组
①观察姜黄素对小鼠腹腔巨噬细胞表达M2表型标志分子的影响:不同浓度姜黄素(0,6.25,12.5,25 μmol/L)干预提取的小鼠腹腔巨噬细胞(M0)12 h,这些处理组分别称为:对照组(M0)、6.25M0、12.5M0、25M0组;②观察姜黄素对经IL-4诱导M2表型小鼠腹腔巨噬细胞表达M2表型标志分子的影响:不同浓度姜黄素(0,6.25,12.5,25 μmol/L)干预经IL-4 10 ng/ml诱导的腹腔巨噬细胞(M2)12 h,这些处理组分别称为:对照组(M0)、M2、6.25M2、12.5M2、25M2组;③探明姜黄素对小鼠腹腔巨噬细胞表达M2表型标志分子影响的机制:20 μmol/L GW9662与25 μmol/L姜黄素共同干预巨噬细胞12 h,这些处理组分别称为:对照组(M0)、25M0、GW9662+25M0组。
1.4 MTT法检测腹腔巨噬细胞活力
将提取好的腹腔巨噬细胞按每孔2 000个细胞数接种于96孔板,按照前述细胞培养条件培养至细胞贴壁,换用无血清培养基培养12 h,分别给予0,6.25,12.5,25,30,50 μmol/L姜黄素分别干预6,12,24 h。吸去培养液,每孔加入MTT(5 g/L)20 μl,37 ℃孵育4 h,弃去上清,每孔加入二甲基亚砜100 μl,避光置于37 ℃摇床10 min,全自动酶标仪测定490 nm处各孔的吸光值。
1.5 real time-PCR测定M2表型标志分子mRNA表达
按照1.3的实验分组干预巨噬细胞结束后,根据试剂盒说明提取总RNA,用紫外分光光度法测定RNA的纯度与浓度。按照逆转录试剂盒操作步骤将各组mRNA反转录为cDNA。按照RT-PCR试剂盒步骤进行实验,PCR扩增条件:95℃ 30 s,95℃ 5 s、60℃ 30 s,共40个循环。基因表达定量采用双δ方法(2δδCt)。由北京奥科公司合成引物,序列见表1。
表1 引物序列
Table 1 Primer sequences

基因名称引物序列 KLF4上游:5′-AACAGCCACCCACACTTG-3′下游:5′-GCCTGGTCAGTTCATCGG-3′FIZZ1上游:5′-GCTACTGGGTGTGCTTGTG-3′下游:5′-CTGGGTTCTCCACCTCTTC-3′MGL1上游:5′-TCTCTGAAAGTGGATGTGGAGG-3′下游:5′-GGAGGTGTAGGTGAAAGTCTCT-3′GAPDH上游:5′-AGCAGTCCCGTACACTGGCAAAC-3′下游5′-TCTCCTGTAAATGTAGTGGTGTCT-3′
1.6 Western blot检测KLF4、FIZZ1和PPAR-γ蛋白表达
按照1.3的实验分组干预巨噬细胞结束后,用RIPA裂解液裂解提取细胞总蛋白。BCA蛋白定量试剂盒测定各组样品蛋白浓度后加入蛋白上样缓冲液煮沸备用。10% SDS-PAGE分离蛋白(FIZZ1需用12%凝胶),半干转膜仪转膜。一抗:KLF4(1 ∶1 000)、FIZZ1(1 ∶500)、PPAR-γ(1 ∶200)、GAPDH(1 ∶5 000),以GAPDH作为内参;二抗(1 ∶5 000)。化学发光法检测,图像采集,ImageJ软件进行图像分析。
1.7 统计学分析
使用SPSS13.0软件进行统计学分析,计量资料用均数±标准差表示。组间比较采用独立样本t检验方法,多组数据比较用方差分析。P<0.05表示差异具有统计学意义。所有试验均进行3次。
2 结果
2.1 小鼠腹腔巨噬细胞的鉴定
用流式细胞仪对提取的小鼠腹腔巨噬细胞进行鉴定。根据细胞大小选取合适的流式细胞仪记录门,排除杂质及细胞碎片的影响,流式细胞仪记录提取细胞的散点图(见图1A);提取的巨噬细胞表面高表达F4-80和CD11b,提取的纯度可达95%以上(见图1B)。
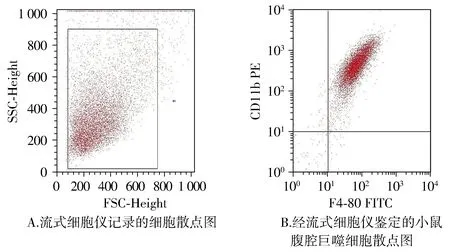
图1 流式细胞仪对提取的小鼠腹腔巨噬细胞进行鉴定Figure 1 Identification of murine peritoneal macrophages using flow cytometry
提取的小鼠腹腔巨噬细胞在普通的光学显微镜下观察(×20)发现,刚分离出来时细胞呈圆形,未贴壁,培养10-12 h观察基本已全部贴壁。细胞形状大部分多角形,少数细胞有伪足伸出(见图2)。
2.2 姜黄素对小鼠腹腔巨噬细胞细胞活力的影响
为了排除姜黄素对小鼠腹腔巨噬细胞细胞活力的影响,用MTT法检测不同浓度姜黄素(0,6.25,12.5,25,30,50 μmol/L)干预巨噬细胞6,12,24 h的细胞活力,为后续的研究获取合适的干预浓度和干预时间。结果提示,0-25 μmol/L姜黄素干预巨噬细胞6 h和12 h对细胞活力无明显影响,但是12.5,25,30,50 μmol/L姜黄素干预24 h细胞活力明显被抑制(见图3)。因此后续实验中选取6.25,12.5,25 μmol/L姜黄素作用12 h进行干预。

图2 分离提取的小鼠腹腔巨噬细胞贴壁后形态 (×20)Figure 2 Appearance of murine peritoneal macrophages after adherent culture (×20)
2.3 姜黄素上调小鼠腹腔巨噬细胞M2表型标志分子的表达
不同浓度姜黄素干预小鼠腹腔巨噬细胞(M0)12 h,M2表型标志分子KLF4、FIZZ1和MGL1在mRNA水平上调(见图4),KLF4和FIZZ1在蛋白水平表达上调(见图5),各组间差异具有统计学意义(P<0.05)。

与0 μmol/L比较,*P<0.05图3 姜黄素对腹腔巨噬细胞活力的影响Figure 3 The effect of curcumin on peritoneal macrophages vitality
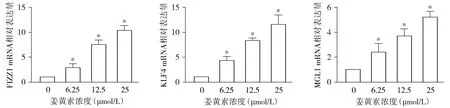
与0 μmol/L比较,*P<0.05图4 姜黄素上调小鼠腹腔巨噬细胞M2表型标记分子mRNA表达Figure 4 Curcumin upregulated the mRNA levels of M2 phenotype molecules in murine peritoneal macrophages
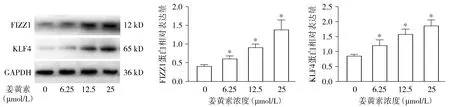
与0 μmol/L比较,*P<0.05图5 姜黄素上调小鼠腹腔巨噬细胞M2表型标记分子蛋白表达Figure 5 Curcumin upregulated the protein expression of M2 phenotype molecules in murine peritoneal macrophages
2.4 姜黄素对经IL-4诱导的小鼠M2表型腹腔巨噬细胞M2标志分子表达无影响
与对照组(M2)比较,不同浓度姜黄素干预IL-4 10 ng/ml诱导的小鼠腹腔巨噬细胞(M2)12 h,M2表型标志分子KLF4、FIZZ1在mRNA水平表达及KLF4和FIZZ1在蛋白水平表达无明显改变,差异无统计学意义(P>0.05),PPARγ蛋白表达也无明显改变,差异无统计学意义(P>0.05,见图6)。
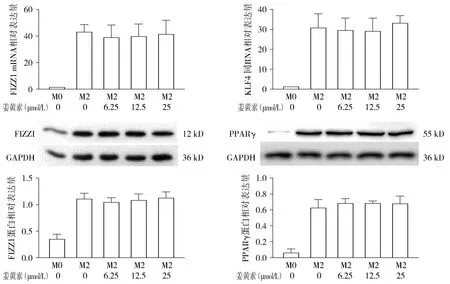
图6 姜黄素对IL-4诱导的M2型巨噬细胞FIZZ1和KLF4 mRNA表达以及FIZZ1和PPAR-γ蛋白表达的影响Figure 6 Effect of curcumin on mRNA levels of KLF4 and FIZZ1 and protein expression of FIZZ1 and PPAR-γ in murine peritoneal macrophages induced by IL-4
2.5 姜黄素促进小鼠腹腔巨噬细胞向M2表型极化的机制
不同浓度姜黄素均能上调小鼠腹腔巨噬细胞(M0)PPARγ蛋白表达,各组间具有统计学差异(P<0.05,见图7)。用PPAR-γ阻断剂20 μmol/L GW9662与25 μmol/L姜黄素共同干预小鼠腹腔巨噬细胞(M0)12 h,M2表型标志分子KLF4和FIZZ1在mRNA和蛋白水平表达下调,差异具有统计学意义(P<0.05,见图8)。

与0 μmol/L比较,*P<0.05图7 姜黄素上调小鼠腹腔巨噬细胞PPAR-γ蛋白表达Figure 7 Curcumin upregulated the expression of PPAR-γ protein in murine peritoneal macrophages

与0 μmol/L姜黄素比较,*P<0.05;与25 μmol/L姜黄素比较,#P<0.05图8 GW9662在mRNA和蛋白水平上抑制姜黄素诱导的小鼠腹腔巨噬细胞M2标志分子的表达Figure 8 GW9662 downregulated mRNA and protein levels of M2 phenotype molecules induced by curcumin
3 讨论
姜黄素是从天南星科、姜科植物的根茎中提取出的一种具有二酮结构的化学单体成分,是传统中药姜黄的主要成分[9]。研究发现,姜黄素具有抗炎、抗氧化、抗病毒、抗肿瘤、抗凝血抗动脉粥样硬化和降血脂的药理作用[10]。
巨噬细胞作为主要的免疫细胞参与免疫炎症反应发生发展的全程[1]。与其他的免疫细胞一样,巨噬细胞不是静止的,而能对各种来自微环境的复杂刺激作出相应的反应,表现出高度的可塑性和异质性[11]。M1表型巨噬细胞可诱导产生各种炎症介质(例如TNF-α、IL-6、IL-1β、IL-12等)增加和维持炎症反应进程,但持续诱导M1表型极化则能造成组织损伤及抑制伤口愈合。与M1巨噬细胞不同,M2型巨噬细胞能促进组织修复和伤口愈合,M2巨噬细胞其他重要的功能是刺激血管生成、碎片清除和抑制免疫反应[12]。既往研究发现,姜黄素可通过活化PPAR-γ诱导RAW264.7源性M1巨噬细胞向M2表型极化[6],证明姜黄素的抗炎机制可能是通过是逆转巨噬细胞M1向M2表型转换实现的。本研究结果提示,不同浓度姜黄素均可诱导静止状态小鼠腹腔巨噬细胞(M0)表达M2表型标志分子在RNA和蛋白水平增加,并且能使PPAR-γ蛋白表达增加,当加入PPAR-γ阻断剂GW9662后,上述作用被抑制,表明姜黄素也可通过活化PPAR-γ直接诱导巨噬细胞向M2表型极化;但同时研究结果提示,姜黄素对于已经极化成M2表型的巨噬细胞的表型转换无影响,考虑经IL-4诱导极化的M2表型巨噬细胞已经为巨噬细胞活化的最佳状态,PPAR-γ已充分活化,再给予PPAR-γ激动剂姜黄素后也不能诱导更多的PPAR-γ表达。
目前又有许多研究相继报道了比较新的诱导巨噬细胞向M2表型极化的条件,如低强度运动、脂联素、阿奇霉素、替米沙坦、罗格列酮等可以诱导巨噬细胞向M2型方向分化[13-15]。本研究的新意在于提示姜黄素也能直接诱导静止状态巨噬细胞(M0)表达M2表型标志分子增加,促进巨噬细胞向M2表型极化。因为M2表型巨噬细胞具有抗炎、修复、促进伤口愈合的作用,姜黄素促进巨噬细胞向M2表型极化进一步也支持了姜黄素的抗炎、修复、促进胶原合成的作用。
综上所述,姜黄素可通过活化PPAR-γ诱导M1表型巨噬细胞向M2表型极化,而且也可以通过活化PPAR-γ直接将静止状态小鼠腹腔巨噬细胞(M0)诱导成M2表型。本研究结果为姜黄素的抗炎、修复、免疫调节机制的研究在细胞水平上提供了新的理论支持,为相关疾病的新药治疗提供了线索。
