miRNA-30e-5p抑制骨肉瘤细胞增殖、转移的机制研究
2020-07-14马锐祥史国光尚希福
徐 泽,黄 威,马锐祥,史国光,尚希福,朱 晨
(中国科学技术大学附属第一医院,安徽省立医院骨科,合肥 230001;*通讯作者,E-mail:zhuchen19790820@sina.com)
骨肉瘤是常见的原发性恶性肿瘤,好发于长骨干骺端,0-19岁儿童和青少年发病率较高。临床常见表现为关节肿胀、疼痛、活动受限以及肌肉萎缩等症状[1]。骨肉瘤的主要治疗方法是手术切除、辅助化疗和放射治疗。在过去20年中治疗效果已取得了很大的进步,非转移性骨肉瘤患者的5年生存率已提升至65%左右[2,3]。然而不幸的是,大多数患者确诊时已是晚期,预后差且病死率较高。故而,寻找新的生物标志物和治疗靶点对骨肉瘤的治疗具有重大意义。微小RNA(microRNA,miRNA)是近年来发现的一种内源性的小分子RNA,在肿瘤、代谢、内分泌系统、胚胎干细胞等方面具有多种功能[4-6]。虽然miRNA不能编码蛋白质,但其可通过与下游靶基因3’-UTR区的碱基互补配对来降解mRNA或直接阻断蛋白质翻译[7,8]。miRNA-30e-5p作为miRNA-30家族中的一员,已经证实在前列腺癌、头颈部肿瘤和膀胱癌组织中表达下调,发挥肿瘤抑制因子的作用[9-11]。但miRNA-30e-5p在骨肉瘤中的作用仍不明确。因此,本研究将分析miRNA-30e-5p对骨肉瘤细胞增殖、转移的影响并探究其分子机制,以期为骨肉瘤的临床治疗提供新的方法和思路。
1 材料和方法
1.1 临床标本
选择2018-09~2019-09由中国科学技术大学附属第一医院骨科手术室收集的30对骨肉瘤组织和癌旁正常组织,所有的组织快速冷冻于液氮,其后于-80 ℃长期保存用于后续实验。所有入选患者均无放疗和化疗史。
1.2 细胞株和主要试剂
人骨肉瘤细胞株U2OS、Saos-2、MG-63和人成骨细胞hFOB购于ATCC细胞库(美国)。CCK-8试剂盒、Trizol试剂由合肥飒英斯生物试剂公司提供。Transwell小室由Corning公司(美国)提供。Lipofectamine 2000转染试剂盒由Abcam生物公司(英国)提供。RPMI-1640和胰酶溶液由Hyclone公司(美国)提供;opti-MEM和胎牛血清由Gibco生物公司(美国)提供。miRNA-30e-5p mimics(模拟物)、miRNA-30e-5p inhibitor(抑制物)、mimics NC(模拟物阴性对照)、inhibitor NC(抑制物阴性对照)和实验中所有引物均由安徽(滁州)通用生物公司提供。USP22、E-cadherin、N-cadherin、GAPDH抗体由CST生物公司(美国)提供。
1.3 细胞培养
将液氮中冻存的的骨肉瘤和成骨细胞取出,迅速在37 ℃恒温水浴锅摇晃,使其快速融化,随后转移至15 ml无菌离心管中并加入5 ml培养基重悬、离心。用含有10%胎牛血清和1%双抗(100 U/ml青霉素、100 μg/ml链霉素)的RPMI-1640培养基,置于37 ℃、5% CO2培养箱中培养。当单层细胞生长至70%-90%,胰酶消化细胞,传代继续培养备用。
1.4 细胞转染
用PBS洗涤对数生长期的细胞,胰酶消化后重悬、计数。将6×105个细胞接种于6孔板,继续培养24 h进行转染。分别构建miRNA-30e-5p过表达细胞模型,分为mimics NC组(模拟物阴性对照)和miRNA-30e-5p mimics组;构建miRNA-30e-5p敲低细胞模型,分为inhibitor NC组(抑制剂阴性对照)和miRNA-30e-5p inhibitor组。分别用250 μl opti-MEM稀释mimics NC、miRNA-30e-5p mimics、inhibitor NC和miRNA-30e-5p inhibitor,同时使用250 μl opti-MEM稀释Lipofectamine 2000,将两组轻柔混匀,室温静止20 min。加500 μl转染复合物至6孔板,继续培养4 h,更换新鲜培养基,继续培养48 h,用于miRNA-30e-5p转染效率的检测。
1.5 qRT-PCR检测miRNA表达情况
Trizol法抽提组织和细胞中RNA,使用天根生物反转录试剂盒对miRNA进行加尾和反转录。用荧光定量试剂盒检测样品中miRNA-30e-5p表达量,以U6作为内参。miRNA-30e-5p上游引物:5′-GGCGTGTAAACATCCTTGACTG-3′,下游引物:5′-GTGCAGGGTCCGAGGT-3′;U6上游引物:5′-GCTTCGGCAGCACATATACTAAAAT-3′,下游引物:5′-CGCTTCAGAATTTGCGTGTCAT-3′。反应程序为:95 ℃ 5 min,95 ℃ 10 s,60 ℃ 30 s,40个循环。
1.6 CCK-8法检测细胞增殖
将转染后的U2OS细胞消化计数、调整细胞密度为1×105/ml的细胞悬液,取100 μl接种至96孔板。在细胞培养箱中继续培养24,48,72 h,每天同一时间每孔中加入10 μl CCK-8溶液,培养箱中继续培养2 h,酶标仪检测450 nm时吸光度OD值。
1.7 克隆形成实验
将转染后的U2OS细胞消化计数、调整细胞密度为2×104/ml的细胞悬液,取100 μl接种至6孔板,并补齐培养基至2 ml。在细胞培养箱中继续培养10 d至肉眼可见克隆形成,终止培养,PBS洗涤后中性甲醛固定30 min,0.1%结晶紫染色1 h,流水洗净烘干,显微镜下观察计数。
1.8 Transwell检测细胞转移能力
转染后生长状态良好的骨肉瘤U2OS细胞消化计数,用无血清培养基重悬成单细胞调整细胞密度,接种4×104个细胞于Transwell上室,下室加入10%血清的培养基。培养箱继续培养24 h,0.1%结晶紫染色后用棉签轻柔擦去上室内的基质胶和细胞,显微镜下随机选取5个视野进行计数,取平均值进行分析。
1.9 Targetscan网站进行靶基因预测
采用Targetscan网站在线进行miRNA-30e-5p靶基因预测。
1.10 Western blot检测蛋白表达
将转染后的U2OS细胞冰上裂解,提取总蛋白,进行变性处理。蛋白质经电泳、转膜至PVDF膜上,脱脂牛奶室温封闭1 h,PBST洗膜3次,每次5 min;USP22、E-cadherin、N-cadherin、GAPDH(稀释比均为1 ∶1 000,稀释液为5%脱脂牛奶)一抗4 ℃冰箱过夜,PBST洗膜3次,每次5 min;兔二抗(稀释比均为1 ∶5 000,稀释液为5%脱脂牛奶)室温孵育1 h,PBST洗膜3次,每次5 min;采用ECL发光试剂进行曝光。
1.11 统计学分析
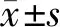
2 结果
2.1 miRNA-30e-5p在骨肉瘤组织和细胞中低表达
首先检测骨肉瘤临床标本中miRNA-30e-5p的表达水平,qRT-PCR结果表明与癌旁正常组织相比,肿瘤组织中miRNA-30e-5p水平显著降低(P<0.05,见图1)。随后,分析了人成骨hFOB细胞和骨肉瘤U2OS、Saos-2、MG-63细胞中miRNA-30e-5p的表达情况,qRT-PCR结果表明其在骨肉瘤细胞中也显著低表达(P<0.05,见图1)。
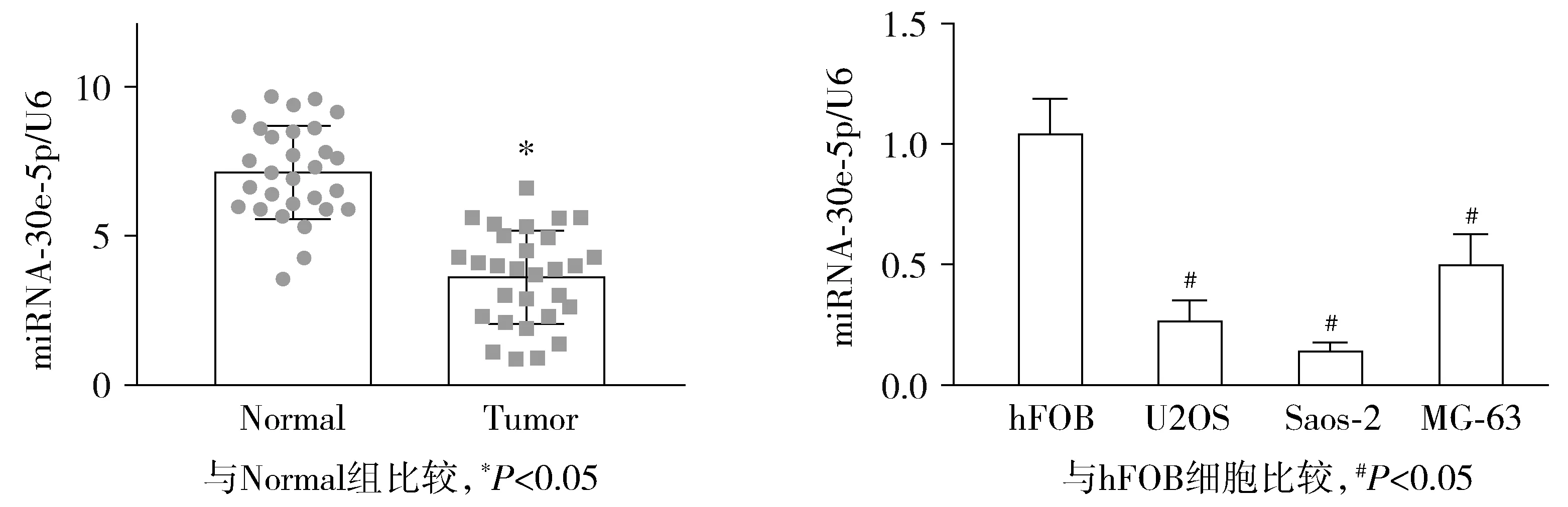
图1 miRNA-30e-5p在骨肉瘤组织和细胞中的表达情况Figure 1 Expression of miRNA-30e-5p in osteosarcoma tissues and cells
2.2 过表达miRNA-30e-5p抑制U2OS细胞的增殖、转移
U2OS细胞转染miRNA-30e-5p mimics后,与对照组相比,过表达组miRNA-30e-5p显著升高(P<0.05,见图2A)。克隆形成和CCK-8实验表明,过表达组细胞存活率和克隆数量显著降低(P<0.05,见图2B、C)。Transwell实验表明,相比于对照组,过表达组细胞转移数目明显减少(P<0.05,见图2D)。
2.3 下调miRNA-30e-5p表达促进U2OS细胞的增殖、转移
U2OS细胞转染miRNA-30e-5p inhibitor后,相比与对照组,抑制组miRNA-30e-5p显著降低(P<0.05,见图3A)。克隆形成和CCK-8实验表明,抑制组细胞存活率和克隆数量显著升高(P<0.05,见图3B、C)。Transwell实验表明,抑制组细胞转移数目明显增加(P<0.05,见图3D)。
2.4 miRNA-30e-5p能抑制USP22表达
使用在线预测网站对miRNA-30e-5p的靶基因进行分析,结果显示miRNA-30e-5p可能与USP22存在靶向关系(见图4)。通过Western blot实验发现,过表达miRNA-30e-5p能抑制USP22的表达(见图4);抑制miRNA-30e-5p能增加USP22的蛋白水平(见图4)。证实miRNA-30e-5p能够靶向抑制USP22的表达。
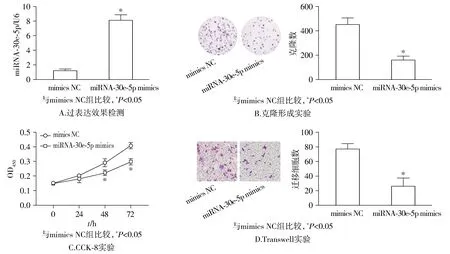
图2 过表达miRNA-30e-5p对骨肉瘤U2OS细胞增殖、转移的影响Figure 2 Effect of miRNA-30e-5p overexpression on the proliferation and metastasis of osteosarcoma U2OS cells
图3 抑制miRNA-30e-5p表达对骨肉瘤U2OS细胞增殖、转移的影响Figure 3 Effect of inhibition of miRNA-30e-5p expression on the proliferation and metastasis of osteosarcoma U20S cells

图4 miRNA-30e-5p对USP22的调控作用Figure 4 Regulation of miRNA-30e-5p on USP22
2.5 miRNA-30e-5p能抑制U2OS细胞EMT过程
Western blot实验证实,过表达miRNA-30e-5p后E-cadherin蛋白水平上调、N-cadherin蛋白水平下调(见图5)。相反,抑制miRNA-30e-5p表达后E-cadherin蛋白水平下调、N-cadherin蛋白水平上调(见图5)。证实miRNA-30e-5p能够抑制骨肉瘤U2OS细胞的EMT过程。

图5 miRNA-30e-5p对EMT相关蛋白表达的影响Figure 5 Effect of miRNA-30e-5p on E-cadherin and N-cadherin protein expression
3 讨论
miRNA在肿瘤发展过程中对调节细胞功能和生物学过程具有显著作用。研究发现,miRNA-21、miRNA-320a、miRNA-210-5p等异常表达会影响骨肉瘤细胞的增殖、转移及不良预后[12-14],说明miRNA与骨肉瘤的恶性进展密切相关。已有研究表明miRNA-30e-5p在头颈部鳞状细胞癌[11]、前列腺癌[15]、神经胶质瘤[15]等多种肿瘤中低表达,并能抑制肿瘤的发生发展,但目前尚无有关miRNA-30e-5p在骨肉瘤中的潜在功能和机制的研究。本研究首次证实,miRNA-30e-5p在骨肉瘤组织和细胞中低表达,初步表明其在骨肉瘤的恶性发展中可能发挥抑癌功能。细胞生物学实验表明miRNA-30e-5p能够抑制骨肉瘤U2OS细胞的增殖和转移。
miRNA是一种长度约为22个核苷酸的内源性非编码RNA,在机体生物学过程中发挥重要作用。miRNA通过碱基互补的方式与靶基因mRNA的3′-UTR结合,抑制mRNA的翻译,从而负调控靶基因表达[16]。有研究报道,前列腺癌中miRNA-30e-5p可抑制CTHRC1表达,进而降低细胞的增殖、转移能力[17]。本研究通过生物信息学预测表明miRNA-30e-5p能够与USP22的mRNA结合,Western blot实验表明骨肉瘤细胞中miRNA-30e-5p确能下调USP22的蛋白表达。初步证实miRNA-30e-5p可调控USP22表达进而抑制骨肉瘤的恶性进展。
USP22是一种新的去泛素化酶,属于泛素水解酶蛋白质家族的一员,能够通过去泛素化组蛋白残基调控基因转录。USP22最初是由Glinsky等[18]在基因微阵列的研究中发现的,它被认为在许多生理和病理过程中具有重要作用,如细胞周期、细胞增殖和肿瘤侵袭。已经发现USP22在不同类型的癌症中异常表达,与各种癌症患者的肿瘤复发、远处转移、不良预后和治疗失败有关[19]。已有研究表明,USP22可通过调控COX-2和p53结合蛋白MDMX来促进非小细胞肺癌的发生发展[20]。此外,已有研究证实USP22在骨肉瘤中过表达,并且能够促进骨肉瘤细胞的增殖、转移[21]。本研究表明miRNA-30e-5p能够靶向USP22,并负调控其表达。进一步证实miRNA-30e-5p在抑制骨肉瘤增殖和转移中具有重要作用。
EMT是指上皮细胞失去细胞极性,降解细胞间连接,增加细胞运动性并获得侵袭特性,成为间充质细胞的生物过程。EMT过程的异常激活被认为是促进肿瘤转移的关键,因为它增加了癌细胞的活力、侵袭性和迁移性[22]。研究发现EMT过程在骨肉瘤发生发展中具有重要作用,靶向调控EMT过程的相关转录因子有望成为骨肉瘤临床治疗的新策略[23]。本研究证实,miRNA-30e-5p能上调E-cadherin蛋白表达,下调N-cadherin蛋白表达,进而抑制EMT过程。此外,已有研究证实USP22在骨肉瘤中可以激活EMT过程[21],初步说明miRNA-30e-5p可通过USP22调控EMT过程。诚然,USP22在骨肉瘤中调控EMT过程的具体分子机制仍需在未来深入研究。
本研究首次证实miRNA-30e-5p可下调USP22表达抑制EMT过程,从而影响骨肉瘤的恶性进展,以期为骨肉瘤的临床治疗提供新的策略。
