经后腹腔途径与经腹腔途径腹腔镜下肾部分切除术治疗肾门肿瘤的疗效比较
2020-07-13殷波陆伟廖科学古丹梅
殷波,陆伟,廖科学,古丹梅
信阳市中心医院泌尿外科,河南 信阳464000
肾肿瘤是常见的泌尿生殖系统的肿瘤之一,男性多发于女性,既往中国相关调查研究显示,肾肿瘤占全身恶性肿瘤死因的0.3%,病死率约为0.32/10万[1]。肾肿瘤对放疗、化疗、激素疗法等均不太敏感,所以手术则为治愈肾肿瘤的有效措施,肾门肿瘤即指位于肾门区域,影像学显示肿瘤与肾动脉、肾静脉直接接触(距离<5 cm)的肿瘤,其位置特殊,操作难度大,围手术期风险高,术中因血管损伤被迫切除肾脏的风险较高,术后并发症较多,因此对其行肾单位保留手术具有一定困难[2]。随着临床对肾肿瘤生理学及生物学认识的不断加深,肾部分切除术如今已成为肾肿瘤的标准治疗方式。腹腔镜技术的不断发展,使其逐渐取代开放性手术,具有创伤小、出血量少、术后康复快等优势[3-4],但腹腔镜下肾部分切除术对肾门肿瘤仍具有一定挑战性。如今,已有较多文献报道了腹腔镜下肾部分切除术治疗肾门肿瘤的研究,证实了腹腔镜下肾部分切除术治疗肾门肿瘤的可行性[5-6]。依据其入路方式不同可分为经后腹腔途径与经腹腔途径,不同入路方式存在不同的优缺点,既往亦有相关研究比较两种入路方式对于肾肿瘤的疗效及安全性[7]。本研究基于既往文献报道,并创新选取肾门肿瘤这一特殊肾肿瘤患者及免疫功能指标,回顾性分析80例肾门肿瘤患者的临床资料,旨在探讨比较经后腹腔途径与经腹腔途径腹腔镜下肾部分切除术治疗肾门肿瘤的有效性及对免疫功能的影响,现报道如下。
1 资料与方法
1.1 一般资料
收集2015年1月至2019年1月信阳市中心医院收治的肾门肿瘤患者的病历资料。纳入标准:①经影像学证实为肾门肿瘤;②未局部或远处转移;③均于信阳市中心医院行腹腔镜下肾部分切除术;④病历资料及随访资料完整。排除标准:①肾转移癌、尿路上皮癌、肾静脉及下腔静脉癌、其他器官的肾脏转移瘤、孤立肾肾肿瘤;②病灶多发;③心、肺、肝等器官严重病变或功能障碍;④合并解剖变异或畸形;⑤既往行肾切除或肾部分切除术;⑥术中同时实施其他手术;⑦血肌酐、尿素氮等肾功能指标异常;⑧凝血功能障碍。根据纳入、排除标准,共纳入80例肾门肿瘤患者,按腹腔镜入路方式不同分为经腹腔入路组和经后腹腔入路组。经腹腔入路组43例,男性31例,女性12例;年龄25~68岁,平均(51.26±7.39)岁;肿瘤大小1.5~5.5 cm,平均(3.11±0.97)cm;左肾肿瘤25例,右肾肿瘤18例。经后腹腔入路组37例,男性28例,女性9例;年龄23~70岁,平均(50.89±7.54)岁;肿瘤大小1.5~5.8 cm,平均(3.07±1.03)cm;左肾肿瘤21例,右肾肿瘤16例。两组患者性别、年龄、肿瘤大小、肿瘤部位比较,差异均无统计学意义(P>0.05),具有可比性。
1.2 手术方法
1.2.1 经腹腔入路 患者取健侧卧位,全身麻醉及气管插管,垫腋卷以升高腰桥,于腰部行常规无菌消毒后铺无菌手术巾单,膀胱镜下插入导尿管,于患者脐旁切开皮肤1 cm,气腹后置入10 mm Trocar,通过腹腔镜,于腋前线平脐水平和腹直肌外缘肋缘下2 cm处置入5 mm Trocar,腋前线平骼嵴水平置入10 mm Trocar。充分游离肾动脉、肾静脉及输尿管,分别标记血管吊带,纵行切开肾周脂肪囊,暴露肾门肿瘤,判断肾门血管、输尿管与肿瘤之间的位置关系。运用无损伤血管阻断夹阻断肾动脉,由肾蒂远端向肾门方向切除肿瘤,锐性切除,钝性分离,使瘤体分离出肾蒂血管表面。用可吸收线缝合肾脏创面,由肾蒂处向远离肾血管方向缝合。连续严密缝合完毕后松开血管夹,检查切口出血,拔除Trocar,开放循环。针对较大创面可进行创面对合缝合;针对较大的肾门肿瘤,采取倒刺线缝合肾脏创缘实质侧,血管侧创缘使用止血纱布缝合填塞压迫有效止血并闭合创面。术后留置肾周引流。
1.2.2 经后腹腔入路 患者取健侧卧位,术前操作同经腹腔入路组,分别于腋后线肋缘下、腋前线肋缘下、腋中线髂前上嵴2横指处置入3个10 mm Trocar。沿肾周脂肪囊外分离,切开肾周筋膜,逐步分离显露肾动脉,显示肾门肿瘤。手术操作同经腹腔入路组。
1.3 观察指标
1.3.1 手术相关指标 记录两组患者围手术期相关指标(手术时间、术中出血量、肾动脉阻断时间、术后肠道功能恢复时间、住院时间)。
1.3.2 肾功能 手术前及手术后24 h,取两组患者空腹静脉血3~5 ml,3000 r/min离心10 min后收集血清,于-20℃低温保存,采用苦味酸法检测血清肌酐(creatinine,Cr)浓度。采用单光子发射计算机断层机(SPECT)及固有的采集处理程序测定两组患者手术前及手术后24 h的肾小球滤过率(glomerular filtration rate,GFR),患者取坐位或仰卧位,探头贴紧背部,并使双肾及膀胱位于探头视野内,静脉注射显像剂,进行动态采集。
1.3.3 炎性因子 手术前及手术后24 h,采用全自动血细胞分析仪及配套试剂检测白细胞(white blood cell,WBC)水平,采用酶联免疫法检测血清C反应蛋白(C-reactive protein,CRP)水平。
1.3.4 免疫功能 手术前及手术后24 h,采用流式细胞仪检测血液CD4+、CD8+水平,并计算CD4+/CD8+值。
1.4 随访
术后进行为期1年的随访,每个月进行一次门诊复查,包括血常规、尿常规、肝肾功能、计算机断层扫描(CT)等检查项目,比较两组并发症及复发转移情况。
1.5 统计学方法
采用SPSS 22.0统计软件分析数据,计数资料以例数和率(%)表示,组间比较采用χ2检验,计量资料以均数±标准差(±s)表示,组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 围手术期指标的比较
经后腹腔入路组患者手术时间、术后肠道功能恢复时间、住院时间均明显短于经腹腔入路组,差异均有统计学意义(P<0.01);两组患者术中出血量、肾动脉阻断时间比较,差异均无统计学意义(P>0.05)。(表1)

表1 两组患者围手术期指标的比较
2.2 肾功能指标的比较
手术前及手术后,两组患者Cr、GFR比较,差异均无统计学意义(P>0.05);手术后,两组患者Cr均上升,GFR均下降,差异均有统计学意义(P<0.05)。(表2)
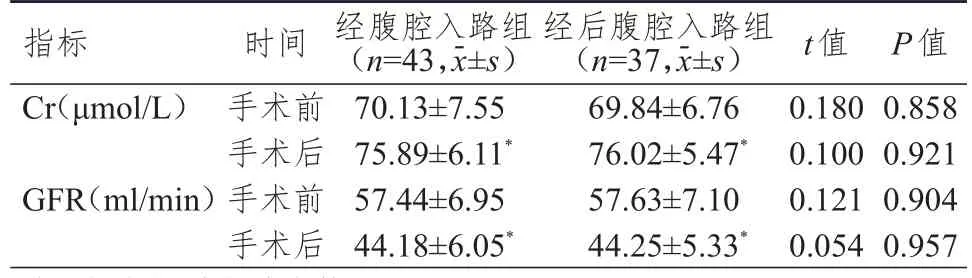
表2 两组患者肾功能指标的比较
2.3 炎性因子的比较
手术前,两组患者WBC、CRP比较,差异均无统计学意义(P>0.05);手术后,两组患者WBC、CRP均上升(P<0.05),且经腹腔入路组患者WBC、CRP明显高于经后腹腔入路组(P<0.01)。(表3)

表3 两组患者炎性因子的比较
2.4 免疫功能指标的比较
手术前,两组患者 CD4+、CD8+、CD4+/CD8+比较,差异均无统计学意义(P>0.05);手术后,两组患者CD4+、CD4+/CD8+均下降,CD8+均上升(P<0.05),且经后腹腔入路组患者CD4+、CD4+/CD8+均明显高于经腹腔入路组(P<0.01)。(表4)
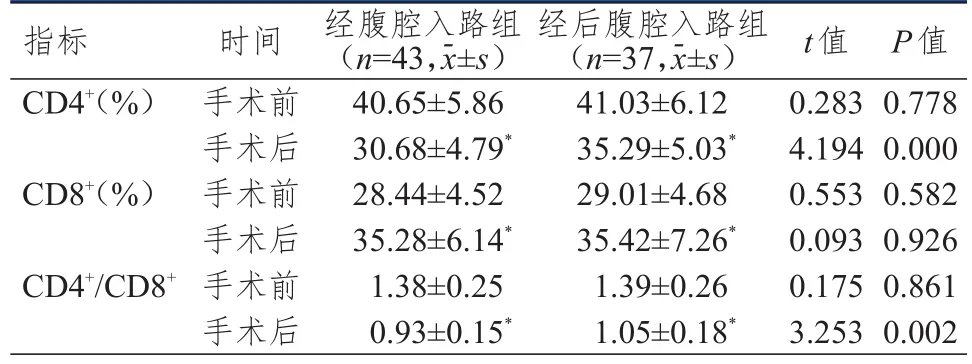
表4 两组患者免疫功能指标的比较
2.5 随访
经腹腔入路组患者并发症总发生率为20.93%(9/43),与经后腹腔入路组患者的21.62%(8/37)比较,差异无统计学意义(χ2=0.006,P>0.05)(表5)。截至随访终点,经腹腔入路组有1例患者CT复查发现膀胱肿瘤,后行经尿道膀胱肿瘤电切术,其余患者无复发转移,经后腹腔入路组患者复查结果均显示正常,肾功能及肾显影检查良好。

表5 两组患者并发症发生情况
3 讨论
肾门肿瘤较为复杂,手术难度与并发症较其他位置肿瘤显著提高。临床针对一些复发性肾肿瘤,国内外研究亦进行诸多探讨,认为肾部分切除术具有切缘阴性、无围手术期并发症、保护肾功能等优势[8-9],因此推荐采取肾部分切除术治疗复杂性肾肿瘤,能获得良好的肿瘤学效果及肾功能,且不增加围手术期并发症。肾部分切除术既能选择性切除肿瘤组织,又能尽可能保留患者肾脏功能,而相较于传统开放手术,腹腔镜下肾部分切除术创伤小、失血少、术后恢复快,预后效果明显优于传统开放手术,如今亦成为肾肿瘤的常用术式。本研究选取肾门肿瘤这一复杂性肾肿瘤患者为研究对象,不仅手术难度具有较大的挑战性,且术后患者肾功能、肿瘤切除效果亦值得探讨。
腹腔镜下肾部分切除术有两种入路方式,经腹腔入路即经腹腔将器械插入腹腔内,能够明显观察腹腔解剖位置,具有较大的操作空间,处理大肿瘤时操作方便,且处理术中损伤更加容易,但该入路方式需尽可能分离腹膜,整理肠道系膜,因此术后易并发肠梗阻、肠麻痹等,且术中肿瘤组织长时间暴露,患者术后恢复受到影响[10]。另一种入路方式则为经后腹腔入路,即经腹膜后将器械插入腹腔,该入路方式进入视野时间短,且游离腹膜、系膜较少,因此手术时间更短,术后肠道功能恢复快,能够缩短恢复进程,但经后腹腔入路的手术视野较狭窄,解剖标志并不显著,因此该入路方式对于医师的操作要求较高[11]。本研究回顾性分析两组患者手术相关指标,发现经后腹腔入路患者手术时间、术后肠道功能恢复时间、住院时间均明显短于经腹腔入路患者,说明相较于经腹腔入路方式,经后腹腔入路能够显著缩短手术时间,加快康复进程,可能原因是经后腹腔入路进入视野快,需要游离的腹膜、系膜少,因此手术时间短,术后肠道功能恢复快,能够缩短进食时间及住院时间,与吕香君等[12]研究结果相似。
本研究比较两组患者肾功能及1年后复发转移情况,手术后24 h,两组患者Cr均上升,GFR均下降,两种入路方式对肾脏功能均有一定程度损伤,导致术后肾功能有所下降[13],但两组比较差异无统计学意义,说明经腹腔入路与经后腹腔入路方式对肾脏功能的损伤程度相当,且未存在广泛的肾脏损害。而通过随访1年后两组复发转移情况可知,经腹腔入路组有1例患者CT复查发现膀胱肿瘤,行经尿道膀胱肿瘤电切术后恢复良好,而经后腹腔入路组患者复查结果均显示正常,说明两种入路方式均具有较好的疗效,患者术后复发率低,应依据肿瘤位置选取手术入路方式,若肿瘤位于肾蒂腹侧、肾静脉表面,则适宜经腹腔入路,其手术操作空间大、解剖标志清晰,但发生尿瘘尿液会进入腹腔及肠道干扰;若肿瘤位于肾蒂背侧、肾动脉表面,则适宜经后腹腔入路,对腹腔干扰较少,术后肠道恢复快,但开始操作空间狭窄,需逐步清理腹膜外脂肪、切开肾周筋膜及脂肪囊等扩大空间[14-16]。
腹腔镜手术虽然创伤小,但手术切口仍会刺激机体免疫系统反应,其中WBC能够防御、吞噬外来病原体,可作为评价创伤程度的基本指标[17];CRP是一种急性期反应蛋白,机体感染或组织损伤时会急剧升高,具有激活补体、增强吞噬细胞的作用,与患者临床预后密切相关[18];T淋巴细胞亚群则是机体发挥免疫防御功能的重要因素,CD4+能够诱导和辅助体液免疫,CD8+能够抑制B细胞产生抗体及细胞毒,从而抑制体液免疫,二者通过相互制约维持机体免疫平衡[19-20]。本研究中,术后两组患者WBC、CRP、CD8+均上升,CD4+、CD4+/CD8+均下降,且相较于经腹腔入路组,经后腹腔入路组WBC、CRP、CD4+、CD4+/CD8+变化幅度更小,提示两种入路方式均会对肾部分切除术患者免疫功能造成一定影响,导致机体发生应激反应,但后腹腔入路创伤更小,对机体刺激作用较少,因此其对免疫功能的抑制作用相对较轻。比较两组并发症发生情况可知,两组患者并发症发生率比较差异无统计学意义,说明两种入路方式具有相当的安全性。
综上所述,经腹腔入路与经后腹腔入路腹腔镜下肾部分切除术治疗肾门肿瘤均具有较好的疗效,术后复发转移较少,但两组入路方式各有优缺点,相较于经腹腔入路,经后腹腔入路手术时间短、术后恢复快,且具有免疫功能保护作用。但本研究仍存在不足,如样本量较少、随访时间较短且为回顾性研究,因此还有待广大学者扩大样本量、延长随访时间做进一步深入研究。
