胃肠道间质瘤肝转移患者肝转移和预后的影响因素分析
——基于SEER数据库的回顾性研究
2020-07-13郭倩倩秦艳茹
郭倩倩,秦艳茹
郑州大学第一附属医院肿瘤科,郑州450052
胃肠道间质瘤是常见的消化道间叶组织来源肿瘤,具有独特的临床病理和遗传学特征,可以发生在食管至肛门的任何部位,极少数发生于胃肠道以外的脏器如肝脏、肠系膜等部位[1-3]。胃是胃肠道间质瘤最常见的发生部位,占40%~60%;小肠是第二常见发病部位,发生率为20%~40%[4]。通过免疫组化法可以检测到大约85%的胃肠道间质瘤患者出现基因突变,60%~80%的突变源于KIT基因的获得性突变,另外20%~40%的KIT基因突变阴性患者会出现血小板衍化生长因子受体α(platelet derived growth factor receptor alpha,PDGFRA)基因突变[1-2]。靶向药物出现之前,手术治疗是局限性胃肠道间质瘤的主要治疗方法,但复发很常见,复发部位主要为肝或腹膜[5-6]。以KIT基因或PDGFRA基因为靶点的某些酪氨酸激酶受体的小分子选择性抑制剂伊马替尼的应用是治疗胃肠道间质瘤患者的一项重大突破[7-8]。研究结果显示,在转移性胃肠道间质瘤患者使用伊马替尼后,患者的总生存时间(overall survival,OS)从不超过1年提高到5~6年,且不良反应及毒性的发生都在可控制范围内[3,9-10]。有研究报道肝是胃肠道间质瘤最常见的转移部位,而且肝是胃肠道间质瘤最易复发的部位[5,11-12]。影响胃肠道间质瘤预后因素的报道较少,并且对其预后因素的研究结果不一致。肝转移是影响胃肠道间质瘤生存的主要因素。寻找影响胃肠道间质瘤的预后因素对其治疗及预后有重要意义。
1 资料与方法
1.1 一般资料
通过监测、流行病学、最终结果(Surveillance,Epidemiology,and End Results,SEER)软件(版本号8.3.5)收集SEER数据库中2010—2015年初诊为Ⅲ+Ⅳ期胃肠道间质瘤的患者。纳入标准:①病理诊断为胃肠道间质瘤;②初诊时临床病理分期为Ⅲ+Ⅳ期;③初诊年龄20~79岁;④确诊时间为2010—2015年;⑤分化程度、核分裂数及病理资料完整;⑥治疗情况及随访信息完整(随访截至2015年12月)。排除标准:①多源性肿瘤;②原位癌;③良性胃肠道间质瘤。根据纳入、排除标准,共纳入2684例患者,191例(7%)患者出现了肝转移,1745例(65%)患者胃肠道间质瘤发生在胃,768例(29%)患者发生在小肠,中位随访时间为20.5个月(0~67个月)。根据是否发生肝转移,将胃肠道间质瘤患者分为肝转移组和非肝转移组。分析胃肠道间质瘤患者的临床特征:诊断年龄、性别、人种、婚姻状态、原发部位、肿瘤大小、肿瘤分化、淋巴结转移情况、核分裂数等。
1.2 统计学方法
采用SPSS 21.0软件进行统计分析,计数资料以例数及率(%)表示,组间比较采用χ2检验;多因素分析采用Logistic回归模型及Cox比例风险模型;采用Kaplan-Meier法绘制生存曲线,生存率的比较采用Log-rank法;以P<0.05为差异有统计学意义。
2 结果
2.1 胃肠道间质瘤发生肝转移的影响因素分析
2.1.1 单因素分析 肝转移组与非肝转移组患者性别、肿瘤大小及肿瘤分化、淋巴结转移情况比较,差异均有统计学意义(P<0.01);肝转移组与非肝转移组患者年龄、种族、肿瘤位置及核分裂数比较,差异均无统计学意义(P>0.05)。(表1)
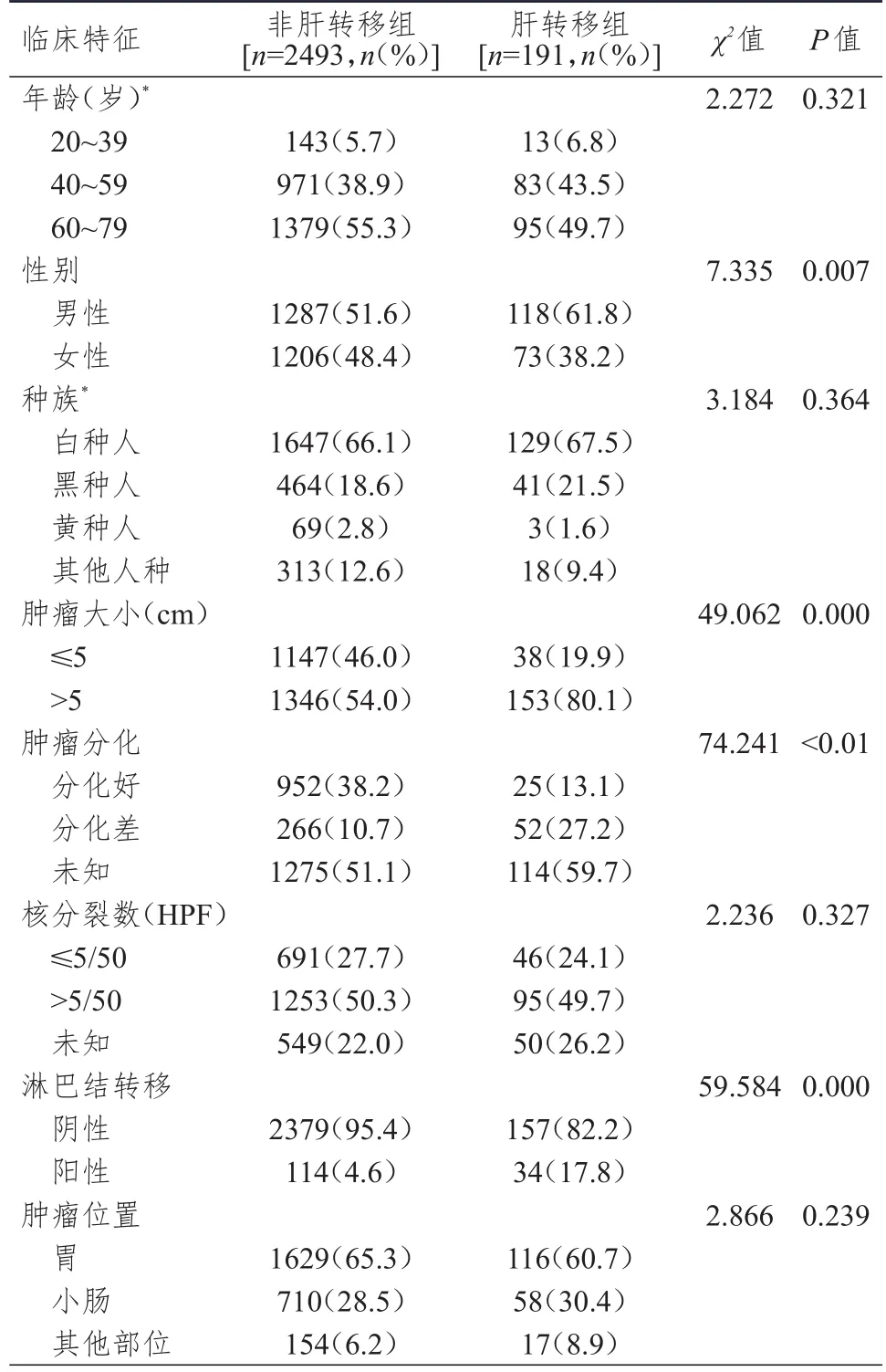
表1 肝转移与非肝转移组胃肠道间质瘤患者临床特征的比较(n=2684)
2.1.2 Logistic回归分析 将上述单因素分析中差异有统计学意义的因素纳入Logistic回归分析,结果显示,肿瘤分化差、肿瘤大小>5 cm、有淋巴结转移是影响胃肠道间质瘤肝转移发生的不利因素(P<0.01)。(表2)
2.2 生存分析
191例肝转移患者,中位OS为65个月,1年生存率为87%,3年生存率为60%;2493例非肝转移患者,中位OS为160个月,1年生存率为96%,3年生存率为78%。肝转移与非肝转移患者生存情况比较,差异有统计学意义(χ2=88.003,P<0.01)。(图1)

表2 胃肠道间质瘤肝转移发生影响因素的多因素Logistic回归分析
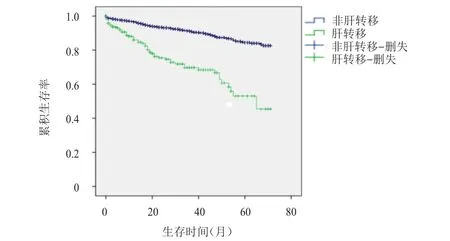
图1 肝转移(n=191)与非肝转移(n=2493)患者的生存曲线
2.3 胃肠道间质瘤患者预后影响因素分析
单因素分析结果显示原发部位(χ2=7.766,P=0.021)、肿瘤分化(χ2=40.356,P=0.000)、肿瘤大小(χ2=33.191,P=0.000)、淋巴结转移(χ2=29.585,P=0.000)、肝转移(χ2=88.003,P=0.000)与患者OS有关。将单因素分析中差异有统计学意义的变量引入Cox比例风险模型中进行多因素分析,结果显示,肿瘤大小>5 cm(HR=1.881,95%CI=1.432~2.469,P=0.000)、淋巴结转移(HR=1.326,95%CI=1.031~1.706,P=0.028)、肝转移(HR=2.090,95%CI=1.615~2.703,P=0.000)是胃肠道间质瘤患者预后的危险因素。(表3)

表3 胃肠道间质瘤患者预后影响因素的多因素分析
2.4 亚组分析结果
按原发部位(胃、小肠、其他部位)不同,研究肝转移是否是亚组患者预后的独立危险因素。对于1629例原发部位在胃的胃肠道间质瘤患者,单因素分析结果显示肝转移(χ2=89.942,P=0.000)与胃间质瘤患者较差的预后有关,Cox回归分析结果显示肝转移(HR=3.791,95%CI=2.525~5.690,P=0.000)是胃间质瘤患者预后的独立危险因素;对于710例原发部位在小肠的胃肠道间质瘤患者,单因素分析结果显示肝转移(χ2=4.068,P=0.044)与小肠间质瘤患者较差的预后有关,Cox回归分析结果显示 肝 转 移(HR=1.758,95%CI=0.896~3.451,P=0.101)不是小肠间质瘤患者预后的独立危险因素;对于154例原发部位在其他部位的胃肠道间质瘤患者,单因素分析结果显示肝转移(χ2=1.290,P=0.256)与其他部位的胃肠道间质瘤患者较差的预后无关。按种族(白种人、黑种人、黄种人)不同,探究肝转移是否是亚组患者预后的独立危险因素。共1647例白种人,单因素分析结果显示:肝转移(χ2=24.562,P=0.000)与白种人的胃肠道间质瘤患者较差的预后有关,Cox回归分析结果显示肝转移(HR=2.262,95%CI=1.475~3.470,P=0.000)是白种人的胃肠道间质瘤患者预后的独立危险因素;464例黑种人,单因素分析结果显示:肝转移(χ2=52.695,P=0.000)与黑种人的胃肠道间质瘤患者较差的预后有关,Cox回归分析结果显示肝转移(HR=5.467,95%CI=2.953~10.119,P=0.000)是黑种人的胃肠道间质瘤患者预后的独立危险因素;69例黄种人,单因素分析结果显示肝转移(χ2=5.638,P=0.018)与黄种人患者较差的预后有关,Cox回归分析结果显示肝转移(HR=2.654,95%CI=0.896~7.860,P=0.078)不是黄种人的胃肠道间质瘤患者预后的独立危险因素。
3 讨论
本研究显示,2010—2015年SEER数据库收集的2684例患者中,191例(7%)患者出现了肝转移,肿瘤分化差、肿瘤大小>5 cm、淋巴结转移是胃肠道间质瘤肝转移发生的独立危险因素;肿瘤大小>5 cm、淋巴结转移、肝转移为影响胃肠道间质瘤患者预后的独立危险因素。亚组分析结果显示:肝转移是原发部位在胃、白种人和黑种人的胃肠道间质瘤患者预后的不利影响因素。
关于胃肠道间质瘤肝转移率的数据较少,Gaitanidis等[10]回顾性分析了SEER数据库中2757例胃肠道间质瘤患者,有276例患者出现肝转移,肝转移率为10%,其结果显示肿瘤大小、核分裂数、淋巴结转移为胃肠道间质瘤患者发生肝转移的独立危险因素,这一结果与本研究结果都显示肿瘤大小、淋巴结转移是肝转移发生的独立影响因素。王立平[12]报道肿瘤>10 cm有复发转移的潜在危险,这一报道也与本研究SEER数据库中得出的肿瘤大小是出现肝转移的独立影响因素的结果一致。核分裂数的结果不同可能是因为本研究中缺乏原发部位肿瘤的手术信息,另外,KIT基因以及PDGFRA基因突变信息的缺乏都可能导致结果出现不一致。胃肠道间质瘤肝转移患者中位OS短于非肝转移患者,差异有统计学意义(χ2=88.003,P<0.01)。肝转移与胃肠道间质瘤患者的生存有关,因此肝转移的及时发现极其关键。本研究结果与既往研究均显示肿瘤大小、淋巴结转移与胃肠道间质瘤肝转移风险有关。因此建议对于原发肿瘤大小>5 cm、出现淋巴结转移的胃肠道间质瘤患者行肝脏相关影像学检查。胃肠道间质瘤及胃肠道外间质瘤均可发生肝转移,主要症状有腹部包块、疼痛、纳差、消瘦等,影像学检查多表现为肝脏单发肿块,与肝脏分界较清,这有别于实体瘤肝转移(表现为肝脏多发占位并多呈浸润性边界)。胃肠道间质瘤肝转移患者外周血检查癌胚抗原和甲胎蛋白多无异常改变,上述资料将对胃肠道间质瘤肝转移的临床诊断提供线索[13]。
有关胃肠道间质瘤的预后报道不一,世界卫生组织2000年的报道认为与胃肠道间质瘤预后有关的主要因素为:肿瘤大小、核分裂数、浸润深度及是否转移[13]。已经有研究提出以肿瘤大小、核分裂数、肿瘤原发部位这些预后指标定义胃肠道间质瘤的危险度分层,这些指标是根据胃肠道间质瘤的临床特征而不是生物学机制提出的[5,18]。一项最新关于SEER数据库的文献研究显示淋巴结转移与胃肠道间质瘤较差的生存预后有关[15]。这与本研究得出的肿瘤大小、淋巴结转移、肝转移是影响胃肠道间质瘤预后的结果一致。本研究未显示核分裂数与患者生存有关,可能原因如下:①研究数据缺乏关于患者手术以及靶向药物使用相关信息,这些混杂因素在肝转移组内的不平衡导致结果出现偏差。②KIT基因以及PDGFRA基因突变信息的缺乏也会导致研究结果不一致,有研究显示KIT基因以及PDGFRA基因突变参与了胃肠道间质瘤疾病的发生与预后[19]。③本研究是一个关于数据库的研究,不限于某一种族以及某一具体部位,以往研究很可能是限于某一地区、某一具体部位而得出的结论,不同种族、发病部位均会影响核分裂数对患者预后的影响。对此,本研究进行了不同种族、不同发病部位患者预后的亚组分析,亚组分析结果显示肝转移是影响患者预后的独立危险因素,但仍未显示核分裂数是患者预后的独立危险因素,故这一潜在偏倚的影响不可忽视。因此,核分裂数结果的不一致可能是由于选择偏倚、相关信息缺乏引起的,故得出结论会与以往研究不同。酪氨酸激酶抑制剂如伊马替尼这类分子靶向治疗药物的出现改变了胃肠道间质瘤的治疗模式,引发了肝切除手术在胃肠道间质瘤肝转移治疗中价值的争议[14]。有研究报道胃肠道间质瘤发生转移的患者使用伊马替尼,最初的反应率高达76%,在6个月会达到平稳状态,但是至少50%的患者在治疗期间2年内发生获得性耐药[6,8]。最近很多研究显示:与仅使用伊马替尼治疗的患者相比,手术联合伊马替尼可显著延长患者的OS[14-16,20]。
本研究有不足之处,首先本研究是回顾性研究,回顾性研究会存在偏倚。其次,SEER数据库是较大的数据库,容易受到编码错误及删失数据的影响。更重要的是,SEER数据库缺乏关于KIT和PDGFRA突变状态、Ki-67、口服靶向药物伊马替尼、手术等信息,结果可能会受到影响。尽管这些限制,这一研究会对胃肠道间质瘤发生肝转移有更好的理解。后期需要更多前瞻性研究探讨手术、伊马替尼、KIT或PDGFRA突变状态对胃肠道间质瘤肝转移的发生、预后的影响。胃肠道间质瘤恶性潜能的分子机制仍旧未知,因此还需要有更多的研究探索胃肠道间质瘤转移与恶性潜能的分子机制。
综上所述,SEER数据库中2684例胃肠道间质瘤患者,191例(7%)患者出现了肝转移。肿瘤大小、淋巴结转移与肝转移发生风险有关。对于肝转移患者,应该在治疗和随访的过程中加强肝转移的相关检查,做到早发现、早治疗,一旦确诊肝转移,采取肝切除手术联合酪氨酸激酶抑制剂如伊马替尼这类分子靶向治疗药物的综合治疗[17]。
