高尿酸血症诱导NLRP3炎症小体活化GSDMD对血管内皮细胞的影响
2020-07-12蒋云沈成兴潘静薇王占成宋艳秋
蒋云,沈成兴,潘静薇,王占成,宋艳秋
高尿酸血症是排除糖尿病、高血压、肥胖等危险因素之外的又一可引起心血管疾病及慢性肾脏疾病发生的独立危险因素,患者血清炎症指标呈高表达,机体损伤的严重程度与机体的炎症反应直接相关[1]。近年来,在慢性肾脏疾病、痛风性关节炎、动脉粥样硬化等诸多疾病中均发现有亮氨酸富集的核苷酸结合寡聚结构域3蛋白(NLRP3)炎症小体的存在,NLRP是模式识别受体的一类,NLRP3是其中一种研究相对清楚的受体,该受体与凋亡相关点样蛋白及胱天蛋白酶-1前体结合后将发生寡聚生成NLRP3炎症小体[2]。该炎症小体在发生活化期间会加速caspase-1前体自我催化并生成活化caspase-1,活化的caspase-1又将剪切白细胞介素-1β等前体至成熟形式并向细胞外分泌,参加多种自身炎症性疾病的发病[3]。细胞焦亡是近几年才被发现的一种新的炎症性程序细胞死亡模式,多种外刺激信号会通过相关途径激活caspase-1,诱发细胞发生细胞焦亡,这种细胞焦亡虽有别于细胞凋亡,但其同时具备凋亡与坏死的特征[4]。炎症小体是经典细胞交往的模式,近几年随着生物学研究的进展,一种未被关注的蛋白质-gasdermin D(GSDMD)的出现为细胞焦亡机制的研究带来新的收获[5]。但该蛋白质对内皮细胞焦亡的具体诱导机制尚未明确,且相关研究也不多见。本研究主要观察高尿酸血症是否会诱导NLRP3炎症小体活化GSDMD导致内皮细胞焦亡,旨在为未来内皮细胞焦亡具体机制深入研究提供参考。现报道如下:
1 材料与方法
1.1 材料HUVEC培养基、内皮细胞(ECM)培养基。主要试剂:均由德国Sigma公司提供,包括Percoll P1644、Uric acid U2625 25 g、LPS L2630 10 mg、Anti-NLRP3 antibody、Anti-caspase3 antibody、Anti-caspase4 antibody、Anti-GSDMD antibody,尿酸粉末购自湖北鑫润德化工有限公司,批号:170612,cck-8试剂盒购自默沙克生物科技公司。主要缓冲液与其他试剂:ECM、PBS、D-Hank's、0.25%(或 0.125%)胰蛋白酶溶液、细胞冻存液、4%多聚甲醛、封闭用10%正常羊血清、RIPA裂解缓冲液、5*SD上样缓冲液、BSA、40%,Acr/Bic(37.5:1)、0.5MTris-HCL(PH6.8)、IMTris.HCL(PH7.5)、1.5MTrisHCL(PH8.8)、10%SDS、10%AP、Tris-甘氨酸电泳缓冲液、10x丽春红染色液、20%Tween-20(v/v)、封闭液(含5%脱脂奶粉的 TBST)。
1.2 实验材料的培养来源于ATCC细胞库的120份人脐静脉内皮细胞(HUVEC)。(1)HUVEC培养:将分离得到的HUVEC悬液的细胞密度调定为1×106/ml,取4 ml接种在25 cm2细胞培养瓶内,放置在5%二氧化碳、95%空气细胞培养箱内,37℃静置培养24 h。培养24 h后更换培养液,将未贴壁细胞去除,后每隔24 h半量更换培养液1次,指导细胞生长至融合状态。(2)HUVEC传代培养:①将无菌的PBS、0.125%的胰蛋白酶溶液、ECM预热至37℃。②将细胞生长至融合状态的25 cm2扩细胞培养瓶中的培养液吸弃,加入PBS清洗,后加入1 ml 0.25%胰蛋白酶。③显微镜观察,细胞皱缩迅速吸弃胰蛋白酶,加入含有FBS的ECM完全培养基中止消化。④处理后置于5%CO2/95%空气细胞培养箱中培养,时间为24 h。⑤培养结束后更换培养液,直至细胞生长成为融合状态。
1.3 实验材料处理方法(1)HUVEC冻存:①细胞冻存前24 h将培养液更换。②收集对数生长期HUVEC(无菌操作下),吸弃培养基使用PBS清洗,加入胰蛋白酶溶液消化。③显微镜观察,细胞皱缩吸弃胰蛋白酶,加速ECM完全培养基中止消化;④制作细胞悬液并进行细胞计数;⑤离心弃上清加入细胞冻存液,重悬细胞,保证细胞密度达到指定范围,并转存。⑥使用白胶布封闭冻存并标记。(2)HUVEC复苏:①取出冻存管,置入水浴箱,融化后取出擦拭消毒;②无菌操作转移细胞悬液至离心管;离心后加入ECM洗涤;③离心后弃上清,加速重悬细胞转移至培养瓶,在5%CO2/95%空气细胞培养箱内培养24 h;④更换培养液,指导细胞生长至融合状态;⑤HUVEC分离与培养至第4~7代,待融合90%,将上清液去除,使用PBS清洗,使用胰蛋白酶消化,用EGM-2终止消化,离心后去上清,细胞计数板计数,调制细胞悬液,分别将细胞悬液滴入6孔板,培养24 h吸出原培养液。
1.3 分组与处理方法
1.3.1 分组方法按随机数表法将培养的成功的120份HUVEC细胞分为3组。
1.3.2 尿酸-HUVEC细胞培养基配制称取尿酸粉末15 mg,置于无菌细胞培养瓶内,无菌操作,将培养基加入培养瓶,避光震荡混匀加入培养基50 ml,制成30 mg/dl尿酸培养基溶液;尿酸培养基制作完成后需避光保存,在保存期间定期使用倒置相差显微镜与偏振光显微镜观察尿酸-培养基的情况,若有异常情况发生则需要重新校正尿酸的浓度。实验前将尿酸培养液换算为μmol/L,分别制备500、1000、1500 μmol/l的尿酸溶液。
1.3.3 分组处理将分组后产生的3组细胞分别进行处理,每种浓度两个孔,HUVEC+ECM+500 μmol/L浓度尿酸,HUVEC+ECM+1000 μmol/L浓度尿酸,HUVEC+ECM+1500 μmol/L浓度尿酸。
1.3.4 培养基与细胞处理收集培养基在2 ml EP离心管内,经13000 r/min转速离心10 min,使用PBS液冲洗,将细胞刮下,使用2 ml EP管采集细胞,在4℃条件下经10000 r/min转速离心3 min,弃上清液。采用Western blot与免疫荧光测定细胞caspase-3、caspase-4、NLRP3及GSDMD表达;同时测定各组内皮细胞LDH释放量。使用CCK-8试剂盒检测各组各组尿酸浓度下内皮细胞的细胞活力,计算不同浓度内皮细胞活力下降率。
1.4 统计学处理应用SPSS 20.0统计学软件处理数据,以(±s)表示计量资料,三组间比较采用单因素方差分析检验,以百分比表示计数资料,用χ2检验,P<0.05表示差异具有统计学意义。
2 结果
2.1 高尿酸引起的血管内皮细胞活力下降分别使用不同浓度的尿酸(500、1000、1500 μmol/L)处理12 h、24 h,使用CCK-8试剂盒检测各组细胞的细胞活力后结果显示,在处理12 h的实验模型内,仅有1500 μmol/L浓度的尿酸能够明显降低HUVECS的细胞活力,细胞活力下降率为50.00%(20/40);在处理24 h的实验模型内,各浓度尿酸组HUVECS细胞的细胞活力均有下降,各组细胞活力下降率分别为25.00%(10/40)、65.00%(26/40)、80.00%(32/40),可见随着尿酸浓度增加,HUVECS细胞的细胞活力随之下降,各浓度间比较,差异有统计学意义(χ2=26.335,P<0.001)。
2.2 不同尿酸浓度制备内皮细胞caspase-3、caspase-4、NLRP3及GSDMD表达比较随着尿酸浓度的升高,内皮细胞caspase-3、caspase-4、NLRP3及GSDMD表达随之升高,组间比较差异有统计学意义(P<0.05)(表1)。各尿酸浓度下各蛋白表达对照见图1。
表1 不同尿酸浓度制备内皮细胞caspase-3、caspase-4、NLRP3及GSDMD表达比较(±s)
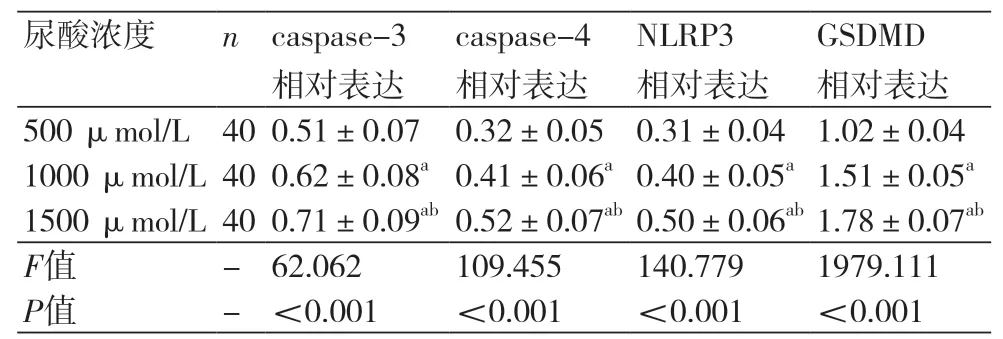
表1 不同尿酸浓度制备内皮细胞caspase-3、caspase-4、NLRP3及GSDMD表达比较(±s)
注:与500 μmol/L比较,aP<0.05;与1000μmol/L,bP<0.05
尿酸浓度 n caspase-3相对表达GSDMD相对表达500 μmol/L 40 0.51±0.07 0.32±0.05 0.31±0.04 1.02±0.04 1000 μmol/L 40 0.62±0.08a 0.41±0.06a 0.40±0.05a 1.51±0.05a 1500 μmol/L 40 0.71±0.09ab 0.52±0.07ab 0.50±0.06ab 1.78±0.07ab F值 - 62.062 109.455 140.779 1979.111 P值 - <0.001 <0.001 <0.001 <0.001 caspase-4相对表达NLRP3相对表达

图1 不同尿酸浓度下各蛋白相对表达情况
3 讨论
尿酸是由内源性核酸分解后及食物内摄入嘌呤经核苷酶分解后形成的次黄嘌呤,在黄嘌呤产生的氧化酶作用下转化为黄嘌呤后,进一步降解生成的[6]。当机体血清尿酸浓度超过0.07 g/L(男性)或0.06 g/L(女性)时,即可诱发高尿酸血症。流行病学研究指出,血尿酸高水平表达与高血压、糖尿病、代谢综合征、肾脏损害等心血管疾病发生紧密相关[7]。
血管内膜表面有血管内皮覆盖,血管内皮不仅仅只是对血管内膜产生保护之效,同时还是关键的内分泌与旁分泌器官,参加调节血管壁的透通性、维持血管舒缩功能平衡、调节凝血功能平衡与血管炎症反应等过程,对维持正常的心血管功能有着重要意义[8-10]。随着1973年“内皮功能障碍”假说的提出,后大量的研究认为,不管是血尿酸水平正常亦或是异常者,其血清水平与内皮细胞功能均呈负相关,即随着血清尿酸水平的升高,机体内皮功能将发生障碍,且功能障碍程度逐渐加重[12,13]。对于2型糖尿病患者及慢性心力衰竭患者而言,别嘌呤可以帮助内皮细胞改善,且二者之间的关系为剂量-效应关系。近期的研究指出,高尿酸血症具有氧化应激促内皮细胞凋亡及活化NLRP3炎症小体的作用[14]。
细胞焦亡作为炎性程序性细胞死亡新模式,体外多种刺激信号会通过各种途径对caspase-1、caspase-4、caspase-5等直接激活,从而导致细胞焦亡发生。细胞焦亡的形态学具有细胞死亡与凋亡的特点,但又与其有着明显的差别。细胞焦亡与细胞凋亡相似的是,二者均会出现细胞核浓缩及染色质DNA断裂等情况;而细胞焦亡与细胞凋亡的差异之处在于,细胞焦亡期间细胞膜将出现空隙,破坏细胞膜完整性,损伤细胞膜进出物质调控能力,溶解细胞膜,大量细胞内容物由空隙处释放,进而诱发炎症反应[15]。同时细胞焦亡发生期间还将释放出大量白介素-18及白介素-1β,二者均是炎症细胞介质,在募集更多的炎症细胞因子后,会扩大炎症反应。按照功能差异,可将Caspase分为炎性半胱氨酸蛋白酶与凋亡半胱氨酸蛋白酶,但需要注意的是,细胞焦亡不是一种经传统凋亡分子所介导的过程,其主要炎性半胱氨酸蛋白酶所介导,在人体中炎性半胱氨酸蛋白酶常见Caspase-4与Caspase-5。研究证实,无论是小鼠亦或是人体,均有两种途径的细胞焦亡模式,即经典细胞焦亡与非经典细胞焦亡,无论是哪种焦亡模式均在激活后参加了诸多疾病的发生发展[16]。
半胱氨酸蛋白酶-1前体与模式识别受体经接头蛋白间接连接形成的高分子复合物即炎症小体,在病原微生物的刺激下,炎症小体能加工无活性半胱氨酸蛋白酶-1前体,并发生裂解,从而形成诱惑性的Caspase-1,来诱导细胞膜穿孔发生,致细胞的溶解并死亡,细胞膜的不完整性将利于胞内物质外流,从而引发炎症[17]。上述机制是经典的细胞焦亡途径。随着现代生物学的发展,在2015年Nature上刊登了并报道了一种未被关注的蛋白质Gasdermin-D(GSDMD),该实验指出在未检出GSDMD小鼠内皮细胞内,由NLRP3等炎症小体介导的细胞焦亡未启动成功,提示内皮细胞焦亡可能有GSDMD活化的参与[18]。既往研究指出,受LPS刺激,Caspase-4、Caspase-5将直接结合LPS并启动细胞焦亡,使得细胞膜发生穿孔、溶解与死亡,从而诱发炎症反应[19]。这种依赖于Caspase-4、Caspase-5并发生在人体内细胞死亡模式是非经典细胞焦亡模式,其机制已经得到证实[20]。
因LPS刺激炎症反应导致的细胞焦亡已被证实是非经典的细胞焦亡模式,故本研究将其作为对照,来观察高尿酸血症诱导NLRP3炎症小体活化GSDMD是否会导致内皮细胞焦亡的发生。本研究结果显示,在受不同浓度尿酸刺激后,随着尿酸浓度的升高,内皮细胞caspase-3、caspase-4、NLRP3及GSDMD表达随之升高,该结果与受LPS刺激的细胞变化模式一致,可以推测高尿酸诱导的NLRP3炎症小体活化GSDMD参与并推动了内皮细胞焦亡,GSDMD是细胞焦亡发生进展的关键物质。这可能与活化的Gaspase-5、Caspase-5能够裂解GSDMD蛋白有关,GSDMD蛋白裂解后N端将介导细胞溶解与焦亡;此外,还可激活NLRP3炎症小体活化Caspase,生成IL-18、IL-1β等炎症介质,机体发生炎症反应后,活化的Caspase-5与Caspase-5将激活通道Pannexin-1,释放出大量的ATP从而导致细胞膜相关通道开放,使细胞膜形成小孔从而诱导细胞焦亡。但目前国内尚缺乏CSDMD介导内皮细胞焦亡的相关研究,故本研究所得结果并未得到较多的循证学依据证实,结果的真实性与可靠性还应在未来展开大量的实验研究加以验证。
综上所述,高尿酸血症可引起内皮细胞NLRP3炎症小体激活,诱发细胞炎症反应,通过介导细胞中GSDMD活性,从而引起内皮细胞焦亡的发生。
