基于3D打印的胸部个体化剂量验证体模设计
2020-07-10杨元佳童蕾钟安妮陈超敏
杨元佳,童蕾,钟安妮,陈超敏
1.广东省广宁县人民医院器械科,广东肇庆526300;2.广东机电职业技术学院,广东广州510515;3.南方医科大学生物医学工程学院,广东广州510515
前言
肺癌是我国最常见的恶性肿瘤之一,发病率呈明显上升趋势,在城市中居于首位。大多数患者在发现时已为局部晚期,需要接受包括放射治疗在内的综合治疗[1]。放射治疗的基本目的是最大限度地使射线集中在肿瘤靶区内而使周围正常组织免受照射。调强放射治疗(IMRT)技术及旋转调强放射治疗技术(VMAT)是目前放射治疗的主要方式,这些技术剂量分布与靶区形状高度适形,因此要求治疗剂量和位置都十分精确[2]。而整个放疗过程中每一个环节均有可能产生误差,导致患者接受的治疗产生误差,因此在治疗前要进行严密的质量保证(QA),包括在患者治疗前对放疗计划进行验证,以确保患者在治疗中接受的剂量与处方剂量一致[3]。20 世纪70年代,ICRU 发表了关于放射治疗计量学标准的报告,明确规定了从放射治疗设备的输出剂量到患者吸收剂量的测量方法与标准,以及放射治疗的治疗评估标准等。剂量验证是通过技术手段收集实际出束时的剂量数据,与计算得到的TPS 剂量数据进行比较,从而判断误差是否在接受范围内。验证过程中选择合适的体模尤其重要,目前常用的剂量验证体模有:均匀体模(各种水箱、有机玻璃水箱、固体水模),非均匀体模(标准男女仿真体模等)[4],但其无法精确地描述每个病人之间的差异。随着3D 打印技术、打印原材料技术的不断发展[5-7],3D 打印作为组织工程支架的方法具有巨大的潜力[8]。而且在不同的技术选择中,3D打印由于能够直接打印形状设计、化学控制和交互作用的多孔支架而成为热门技术[9]。本文提出一种基于3D打印技术的胸部个体化剂量验证体模设计方法,该方法根据病人的CT 图像重建并打印出病人的三维立体结构空壳,并依据CT 值选择组织辐射等效材料对各个器官进行填充,得到每个患者的个体化体模,并在制作过程中提前留置剂量仪通道完成剂量验证[10-12]。患者个体化定制的3D 模型在医学中应用越来越多[13]。
1 材料与方法
1.1 体模设计基本原理
CT 反映的是不同组织对X 射线的衰减率,国际上CT 值定义为影像中每个像素所对应的物质对射线线性平均衰减量大小,所以不同人体组织器官的CT值存在差异,实验中依据不同组织器官CT值的差异对获取的定位图像进行分割。肺、骨骼与周围其它组织CT 值差异明显,容易准确分割,而密度相近的软组织之间界限分辨不清(心脏、血管、肌肉等CT值相近),不易区分,但其对射线的衰减率相差不大,故可将其视为一个整体。本体模的设计目的是测量靶区吸收剂量,考虑节约成本只需要获得肿瘤周围部分胸部模型,然后对不同器官(肺、骨骼、肿瘤、软组织)进行三维重建,得到各个器官的三维立体空壳结构模型,并选择合适的材料对空壳结构填充得到含有患者结构特点的体模。
1.2 体模设计过程与方法
个体化体模设计的基本过程为:获取患者定位时的CT 图像,寻找合适的分割方法分割出不同组织结构,分别重建出各器官的三维立体结构,并对获得的立体结构进一步优化处理,最后导出.stl文件,将其输入到3D 打印机完成打印。体模设计流程如图1所示。
1.2.1 实验材料实验中采用南方医院放疗科CT 扫描数据,数据格式为DICOM,患者女,典型的左肺腺癌,真空垫固定。实验中使用的软件有:Mimics 软件、Geomagic studio 软件及Magics 软件。组织辐射等效材料原材料:PVC 树脂粉(S-65)、对苯二甲酸二辛酯、白色硅酸盐水泥、乙烯-醋酸乙烯酯共聚物(EVA28,其中乙烯乙酸VA28%)。
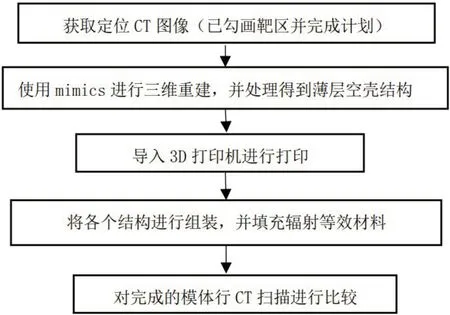
图1 体模设计流程图Fig.1 Flow diagram of phantom design
1.2.2 建立3D 模型医学3D 建模最为关键的一步在于图像分割。Mimics 有多种强大的图像分割工具[14],分割对象为导入软件中的连续断层图像,其中阈值分割方法是基于图像灰度的一种假设,对灰度值相差较大的组织可以很有效地分割,所以本文采用阈值分割方法来进行各器官分割。将患者CT 图像DICOM 文件导入Mimics 软件中,以CT 值为参考选择合适的阈值对其进行分割。为了更好地将肺、骨骼和肌肉分开,可以手动对阈值进行调整,最终选择的分割阈值分别为肺(-937 HU,-367 HU)、骨骼(-149 HU,1200 HU)、软组织(-178 HU,209 HU)。
上述所选择的病例用真空垫进行体位固定并行CT扫描,由于真空垫的CT值与肺组织、软组织相近,阈值分割时有部分地方出现误分,三维重建之前要先对蒙板进行手动编辑和平滑处理。经过处理之后,分别选中肺、骨骼、肌肉的蒙板,利用Mimics三维重建功能进行初步的重建得到实心模型。放疗中吸收剂量验证主要是针对肿瘤及周围危及器官,同时考虑到节约成本,因此胸部体模不需要过大的体积,故对得到的三维模型进一步处理,选取肿瘤附近的部分作为最终3D 打印的模型。此时模型仍然有瑕疵,Mimics 软件包含有一些优化功能,利用这些功能优化模型,主要包括:蒙板平滑、滤波、3D 模型编辑、蒙板编辑等方式。肺、骨骼、肌肉优化前后的模型对比,如图2所示。
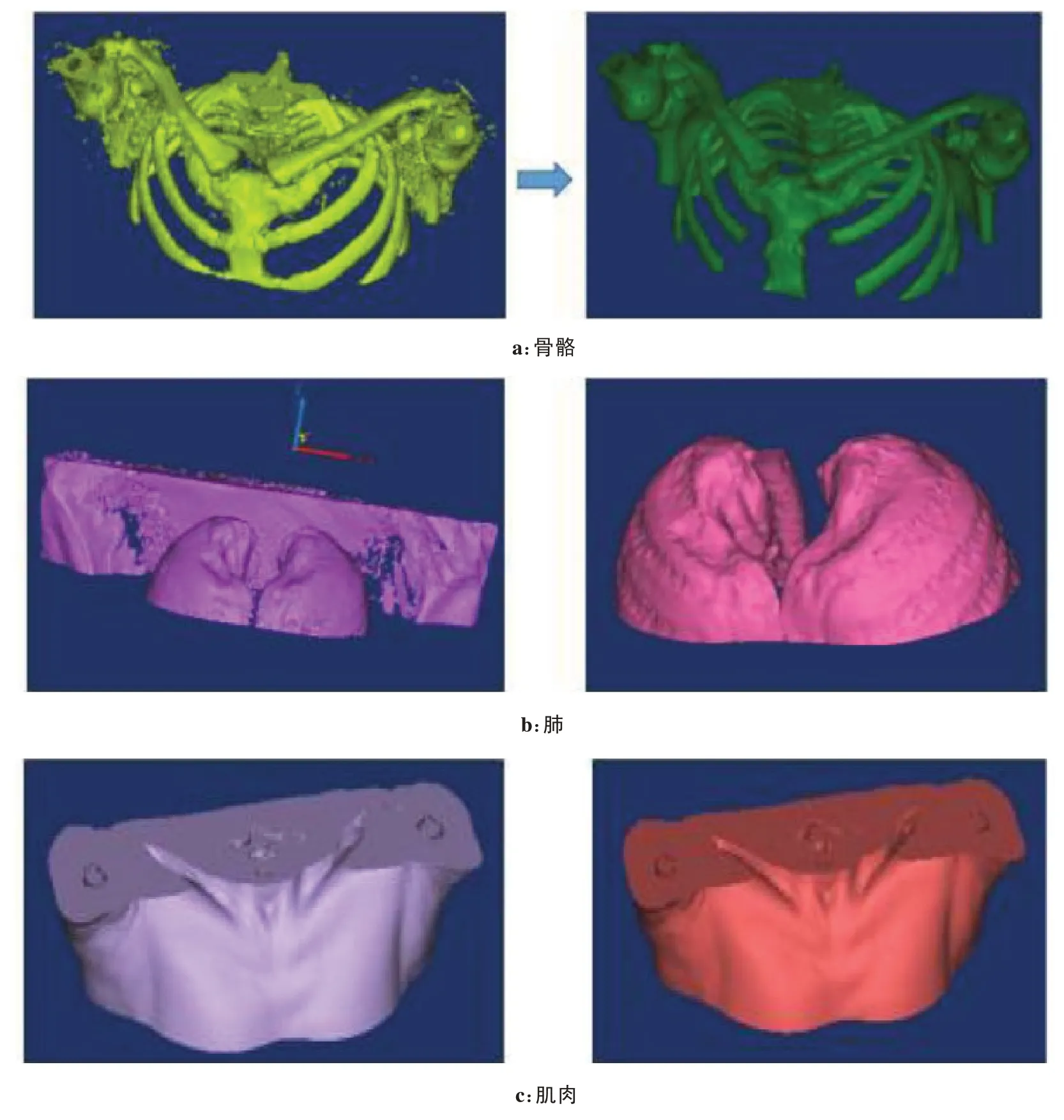
图2 Mimics优化前后模型Fig.2 Models before and after Mimics optimization
上述得到的模型依然为实心模型,由于目前3D打印的原材料还不够丰富,不能直接使用与各组织CT值相似的材料打印得到模型,因此需对模型做进一步处理将其做成一个空壳结构来填充组织等效材料。将Mimics导出的STL文件导入Geomagic studio软件,做进一步的优化,经过流形、去除特征、平滑、填充孔、截面等操作,使模型表面更顺滑。然后对上述实心模型进行抽壳、加厚操作,最终得到有一定厚度的空壳结构,本研究最终打印的壳层厚度为1.2 mm。依据3D打印技术的原理,需要将模型裁剪为上下两部分,同时为了保证各个器官之间的相对位置不变,也为了组装方便,打印之前将裁剪后的各部分进行布尔操作,将下半部分肺、肌肉,及肿瘤、电离室孔道作为一个整体。同时利用Mimics软件MedCAD模块制作填充组织等效材料的孔,完成上述所有操作的模型即为最终需要打印的模型。
1.2.3 打印3D模型将模型以STL格式导出,输入到锐打400光敏树脂打印机器上,选择需要打印的模型进行打印。本研究除了骨骼以外,其它模型均用光敏树脂材料进行打印,其密度约为1.1 g/cm3,只比水的密度稍大一点,可以模拟人的薄层皮肤组织。打印技术为光固化成型技术(SLA)。而骨骼用石膏粉末进行打印,用的是3DP技术,即三维打印粘结成型(喷墨沉积)技术。模型用光敏树脂打印,每块需要打印5~6 h。打印结束后,需要将模型取出,去除毛刺并进行去支撑处理,并用90%酒精将模型进行洗涤,利用相似相溶原理将模型表面的树脂洗干净,处理流程如图3所示。最后将模型放置于紫外光机器中进行照射,即完成打印操作。打印出的最后模型如图4所示。
1.3 组织辐射等效材料选择

图3 打印模型处理流程Fig.3 Model printing process

图4 打印出来的最后模型Fig.4 Final printed models
治疗计划剂量验证时,无法直接测量人体内剂量分布,通常用组织等效性体模替代,测量体模内剂量分布,这就要求体模和测量系统具有良好的组织等效性[14]。仿真辐照体模除要求具有和人体相似的外部形态和内部结构外,更重要的是在一定能量下与人体相同的辐射特性,因此组织辐射等效材料具备的选择是设计仿真辐照体模的关键技术之一。在现代医疗诊断和治疗中,CT 技术已经得到了普遍应用,CT值可以很好地反映射线(X或γ射线)对人体组织和器官的辐射综合效应。本文采用CT 值作为依据来寻找组织等效材料[15-17]。实际应用中,均以水的线性衰减系数作为基准,故CT 值可表述为被测人体组织的线性衰减系数与水的线性衰减系数的相对差值。组织辐射等效材料的CT 值与其线性衰减系数有必然的联系,当组织辐射等效材料CT 值与人体组织CT 值相同时,其线性衰减系数必然与人体组织线性衰减系数相同,说明CT 值可以直接反映线性衰减系数的变化。实验中选择了几种常见的材料在GE light speed 16排CT机进行扫描,扫描条件为120 kV、180 mA,并利用其自身软件测量了每种材料CT 值均值,测量结果如表1所示。

表1 几种常见材料的CT值实测值Tab.1 Measured CT values of several common materials
组织辐射等效材料中各种原材料的选定,主要取决于原材料中各元素的质量百分含量、原材料的密度,故合成组织辐射等效材料的关键在于原材料的选取。实验中根据胸部组织器官每部分的CT 值范围,直接选择或者用几种高分子材料配比合成最终的辐射等效材料。软件测量定位图像各组织结构CT 值范围,结果为骨骼900 HU、肺-757 HU、软组织24 HU、肿瘤-500 HU。根据文献[18-19]报道,当CT值范围在-10~100 HU 时,软组织等效材料可以用由PVC 树脂粉(S-65)和增塑剂(对苯二甲酸二辛酯)按一定比例加热混合组成。PVC 树脂粉,增塑剂混合比例和CT值之间存在线性关系:y=6.908 3x-65.564 5,其中y为CT 值,x为PVC 树脂粉和增塑剂的配比,本研究中软组织等效材料也选择PVC 树脂粉和增塑剂作为原材料填充。
2 结果
个体化胸部辐射等效体模主要用于靶区剂量的验证,所以其辐射特性是否与真实人体组织辐射特性相似是重要参考指标。线性衰减系数是一个与放射的能量和材料性质有关的参数,故采用线性衰减系数评价该体模的辐射等效性,而线性衰减系数又与CT值密切相关,因此选用CT值为评价指标来衡量体模的辐射等效性。分别取部分合成后的辐射等效材料在同样的条件下扫描,测量各结构等效材料的CT值。胸部剂量验证体模组织等效材料如图5所示。这些合成材料的CT值测量结果如表2所示。与定位时获取的图像CT值比较,进行误差分析,骨骼的误差为22%,肺组织误差为1.2%,软组织误差8%,肿瘤靶区误差5.8%。

图5 辐射等效材料Fig.5 Radiation tissue-equivalent material

表2 胸部剂量验证体模组织辐射等效材料CT值Tab.2 CT values of tissue-equivalent materials in thorax phantom for dose verification
3 讨论
本研究提出的基于3D打印的胸部个体化放射治疗剂量验证体模,是利用病人的CT 图像精确分割出各个器官并重建出三维立体结构,通过3D 打印及等效组织材料填充得到仿真体模。该3D打印体模与真实人体相比较,具有外形相似性、内部结构仿真性、组织辐射等效性等特点。可以精确仿真人体结构实际情况,帮助临床更精确地完成剂量,为病人治疗提供更加安全的保障。但是目前该体模设计还有缺陷,首先建立模型过程中,基于CT 值的分割并不是准确无误的,影像反映的结构并不一定是真实的解剖情况,另外还有体位固定装置与人体组织CT 值可能出现交叉,导致误分。例如肺组织其CT 值与定位时用的真空垫、周围空气相似可能出现误分,需要手动修改。真实情况下肺和肋骨会有相交的情况,而模型肺组织与骨头是分开建模,需要通过平滑操作消除相互影响,否则体模最后的组装没法进行。尽管该研究目前还有缺陷,但3D打印技术发展迅猛,在医学领域的应用也越来越广泛[20]。未来可以用于打印的材料会不断丰富,打印的技术也会越来越成熟,将来不需要重建空壳结构来填充完成,而是找到与人体各个器官CT 值相似的材料来直接打印器官模型,中间过程减少,制作也更简单,模拟仿真效果也会更好,将会更适用于临床研究。
