芪苈强心胶囊对慢性心力衰竭大鼠心肌巨噬细胞衍生趋化因子表达的影响
2020-07-09刘春红姜德友陈飞解颖王金贺王伟明孙许涛
刘春红, 姜德友, 陈飞, 解颖, 王金贺, 王伟明, 孙许涛
(1.黑龙江中医药大学,黑龙江哈尔滨 150040;2.黑龙江省中医药科学院,黑龙江哈尔滨 150040)
慢性心力衰竭(CHF)是多种病因引起的心肌收缩/舒张功能障碍,是诸多心血管疾病发展到终末期的共同转归即终点站,曾被世界心脏病学家Braunwald教授[1]比喻为“心脏病最后的战斗场”。CHF在世界各地的发病率越来越高,并且随着年龄的增加患病率亦明显上升,已成为当今影响人们健康的最主要心血管系统疾病之一[2-3]。目前,西药在治疗CHF方面虽然已取得良好的效果,但CHF的预后仍然较差,如β受体阻滞剂、血管紧张素转换酶抑制剂(ACEI)等尽管能够很好地抑制心室重塑[4-5],可对于肾功能不全、药物禁忌症或难以耐受药物的患者来说,其治疗仍有较大的局限性。故CHF的预防与治疗仍是国内外众多学者主要研究的问题。芪苈强心胶囊作为近年来中医药防治心血管疾病的重要发现之一,其在临床上已显示出很好的疗效[6-7]。研究表明,芪苈强心胶囊可有效缓解CHF的各种临床症状,具有利尿、强心、扩张血管,抑制肾素—血管紧张素—醛固酮系统(renin-angiotensin-aldosterone system,RAAS)的系统激活、心室重构,改善心功能,延缓CHF病程等作用[8-9]。课题组前期研究亦发现,“巨噬细胞衍生趋化因子(MDC)→趋化因子受体4(CCR4)→G蛋白”通路在CHF的发生发展及治疗过程中起到重要作用[10]。因此,为进一步指导临床用药,本研究观察了芪苈强心胶囊对CHF大鼠心肌组织MDC表达的影响,探讨其对改善CHF大鼠心功能的作用机制,现将研究结果报道如下。
1 材料与方法
1.1动物60只清洁级健康雄性Wistar大鼠,体质量(245±5)g,由黑龙江中医药大学动物实验中心提供,动物质量合格证号:SCXK(辽)2015-0001。饲养于黑龙江中医药大学基础医学院细胞分子生物实验室,温度(25±1)℃,相对湿度(50±5)%,通风及光照良好,环境适宜。适应性饲养1周。
1.2药物、试剂与仪器芪苈强心胶囊(石家庄以岭药业股份有限公司,批号:A1511014);地高辛片(上海信谊药厂有限公司,批号:020150808);阿霉素(adriamycin)(山西普德药业有限公司,批号:020150703)。大鼠MDC酶联免疫吸附分析(ELISA)96 Tests试剂盒、PV-6001 PowerVisionTMTwo Step免疫组织化学试剂盒(北京博奥拓达科技有限公司)。显微摄影成像系统(美国Thermo公司);UC-7超波切片机(德国Leica公司);病理图像分析系统(美国Thermo公司);JEM-1400PLUS透射电子显微镜(日本电子株式会社);Vivid7彩色超声诊断仪(美国GE公司)。
1.3分组、造模与给药从60只大鼠中随机选取15只作为空白组,其余45只制备CHF模型[11]。方法:用生理盐水配制成2 mg/mL的阿霉素溶液,按1.5 mg/kg的剂量进行腹腔注射,每周2次,共注射7周,建立CHF大鼠模型。空白组同期注射等体积生理盐水。将45只成模大鼠随机分为3组,即芪苈强心治疗组、地高辛对照组和模型组,分别对应给予芪苈强心胶囊溶液(剂量为0.09 g/kg,0.09 g即胶囊内容物质量)、地高辛混悬液(剂量为0.019 mg/kg),生理盐水(3 mL/只)灌胃,每天3 次[10],共灌胃28 d。
1.4大鼠超声心动图观察所有大鼠末次灌胃禁食12 h后,腹腔注射30 g/L戊巴比妥钠溶液(0.2 mL/kg)进行麻醉。成功麻醉之后,将大鼠仰卧固定于操作台。用剃毛器除去大鼠胸前毛发,充分暴露胸部。采用10 s探头的Vivid7彩色超声仪,探头频率为7~12 mHz。将涂抹耦合剂的探头置于大鼠胸骨左缘,对大鼠进行心脏超声扫查。分别测量左心室舒张末期内径(LVIDd)、左心室收缩末期内径(LVIDs)、左心室短轴缩短率(FS)、射血分数(EF)等指标,测量3次,取其平均值。
1.5大鼠心脏血流动力学指标检测大鼠心脏彩色超声检查后,用玻璃针慢慢将大鼠右侧颈总动脉剥离,彻底暴露动脉后用手术线将远心端颈动脉结扎;再向近心端方向插管,经压力转换器连接BL-420S生物机能实验系统,分别检测左心室收缩/舒张末期压力(LVSP/LVEDP)、左心室内压最大变化速率(±dp/dtmax)等指标。
1.6标本的采集及保存上述实验完成后,沿正中线切开胸壁,暴露出心脏后迅速摘取心脏,用冰盐水冲洗干净,去除多余水分后切取适量左心室组织,用电镜液保存,其余部分置于液氮中保存备用。
1.7大鼠心肌组织病理形态学观察
1.7.1 苏木素—伊红(HE)染色 将左心室组织放入体积分数4%甲醛溶液中固定,常规脱水后石蜡包埋,连续切片厚度约4μm,HE染色,观察心肌形态结构变化。
1.7.2 透射电镜 取心肌组织用体积分数2.5%戊二醛溶液(pH=7.0)固定,磷酸盐缓冲液漂洗6次,10 g/L锇酸固定后梯度脱水,包埋、固化、切片,醋酸双氧铀、柠檬酸铅进行双重染色。应用透射电镜观察,摄片。
1.8大鼠心肌组织MDC表达和含量测定
1.8.1 免疫组织化学法 按照PV-6001PowerVisionTMTwo Step试剂盒说明进行免疫组织化学染色。显微镜下每张切片随机挑选6个视野,用Image-pro plus 5.0图像分析系统测定MDC阳性积分光密度(IOD),取其平均值表示MDC表达水平。
1.8.2 ELISA法 心肌组织加入适量缓冲液进行研磨离心,取上清,按照MDCELISA 96 Tests试剂盒方法对浓度已均衡的左室心肌组织MDC含量进行检测。
1.9统计方法采用SPSS 17.0软件进行数据分析,计量资料以均数±标准差(±s)表示,进行正态性和方差齐性检验,多组比较采用单因素方差分析。进一步两两比较,若方差齐,采用Bonferroni检验,若方差不齐,采用Dunnett T3检验。以P<0.05为差异有统计学意义。
2 结果
2.1各组大鼠超声心动图观察指标比较图1结果显示:与空白组比较,模型组大鼠超声心动图参数LVIDd、LVIDs明显升高,EF、FS明显降低,差异均有统计学意义(P<0.05);与模型组比较,芪苈强心治疗组、地高辛对照组超声心动图参数LVIDd、LVIDs下降,EF、FS上升,差异均有统计学意义(P<0.05);芪苈强心治疗组LVIDd、LVIDs、EF、FS与地高辛组比较,差异均无统计学意义(P>0.05)。
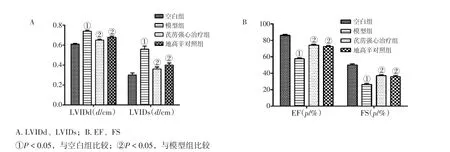
图1 各组大鼠超声心动图观察指标比较(±s)Figure 1 Comparison of the indexes observed by analysis of ultrasonic cardiogram in rats of various groups(-x ± s)
2.2各组大鼠心脏血流动力学变化比较图2结果显示:与空白组比较,模型组大鼠LVSP、+dp/dtmax、-dp/dtmax明显降低,LVEDP明显升高,差异均有统计学意义(P<0.05);与模型组比较,芪苈强心治疗组LVEDP明显下降,LVSP、+dp/dtmax、-dp/dtmax明显升高,差异均有统计学意义(P<0.05);芪苈强心治疗组LVSP、+dp/dtmax、-dp/dtmax、LVEDP与地高辛对照组比较,差异均无统计学意义(P>0.05)。
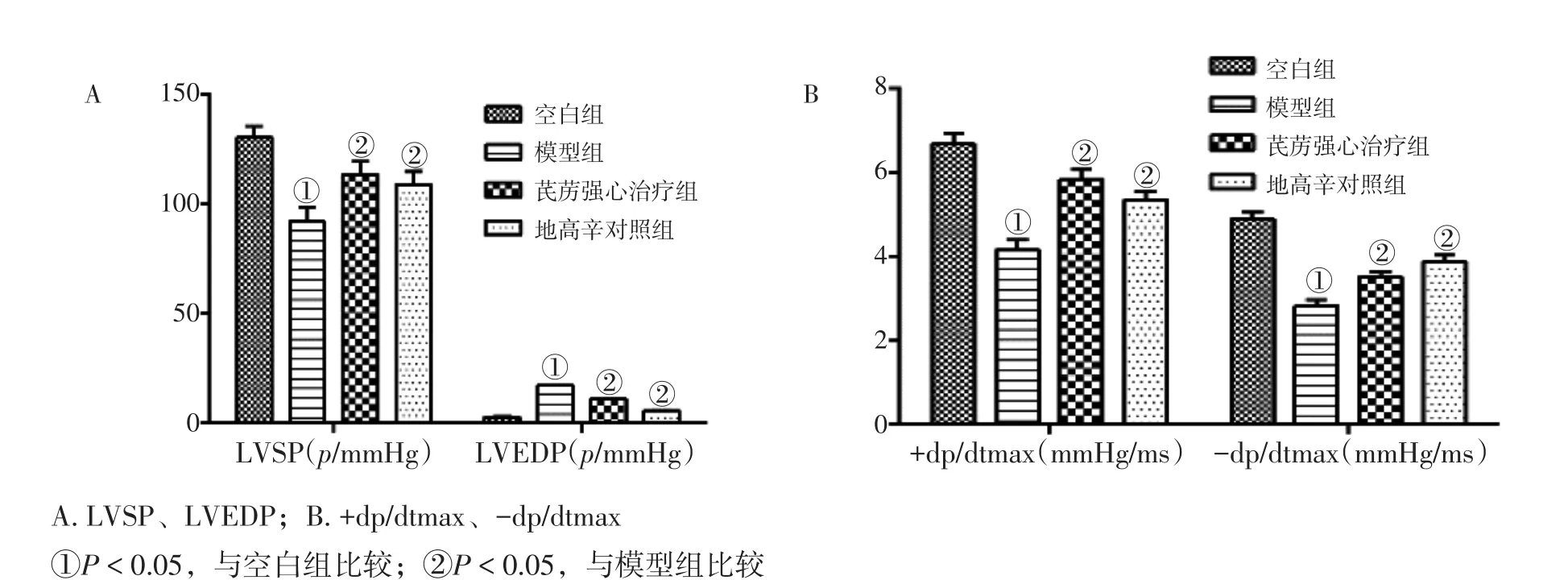
图2 各组大鼠心脏血流动力学指标比较(±s)Figure 2 Comparison of the cardiac haemodynamics indexes in rats of various groups(± s)
2.3各组大鼠心肌组织病理形态学变化比较
2.3.1 HE染色结果 图3结果显示:空白组心肌细胞排列整齐,胞核染色无固缩,胞质染色无肿胀,间质无扩张充血和炎细胞浸润;模型组大鼠心肌纤维组织排列明显紊乱,部分心肌胞核固缩深染,胞浆肿胀断裂浓染,间质增生充血并可见炎症细胞浸润;芪苈强心治疗组和地高辛对照组大鼠心肌组织病理形态较模型组均有不同程度改善,心肌纤维排列相对规整,胞核固缩数目明显减少,胞质肿胀明显减轻,间质无明显增生,无明显炎症细胞浸润。
2.3.2 透射电镜结果 图4结果显示:空白组心肌组织正常;模型组心肌组织内肌原纤维走形紊乱,肌节断裂,长短不一,肌丝灶性溶解、消失。核膜断裂,核固缩,肌浆网囊性扩张,核内可见空泡样变,坏死的心肌细胞附近出现成束的胶原纤维增生;芪苈强心治疗组和地高辛对照组大鼠心肌较模型组大有改善,肌原纤维排列相对整齐,肌节发育较好,肌丝结构尚可,心肌组织间质及核周围结构基本正常,无水肿。
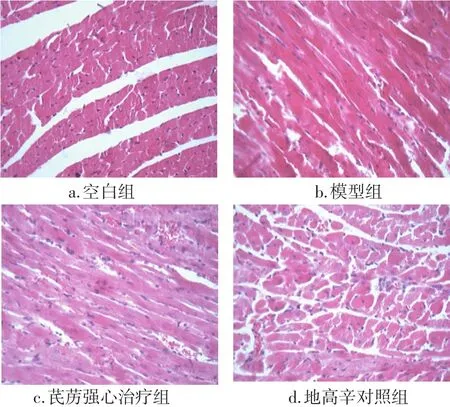
图3 各组大鼠心肌组织HE染色结果比较(×400)Figure 3 Comparison of HE staining results of myocardial tissue in rats of various groups(× 400)
2.4各组大鼠心肌组织MDC含量和表达比较图5~7结果显示:与空白组比较,模型组MDC含量和表达显著下降,差异有统计学意义(P<0.05);与模型组比较,芪苈强心治疗组与地高辛对照组MDC含量和表达显著增高,差异有统计学意义(P<0.05);芪苈强心治疗组MDC含量和表达与地高辛对照组比较,差异无统计学意义(P>0.05)。

图4 各组大鼠心肌组织透射电镜结果比较(×5 000)Figure 4 Comparison of transmission electronmicroscopical results of myocardial tissue in rats of various groups(× 5 000)

图5 各组大鼠心肌组织MDC含量比较(ELISA法,±s)Figure 5 Comparison of MDC content in rat myocardial tissue in various groups(by ELISA, -x±s)
3 讨论
本研究结合超声心动图、心脏血流动力学各项指标及光学显微镜结果,证明慢性心力衰竭(CHF)大鼠模型复制成功。而芪苈强心胶囊对CHF大鼠心脏超声心动图及心脏血流动力学中各项指标有明显的改善作用,但恢复程度不及空白组,表明芪苈强心胶囊可有效改善CHF大鼠心功能,但阿霉素致心脏损伤已不可逆。
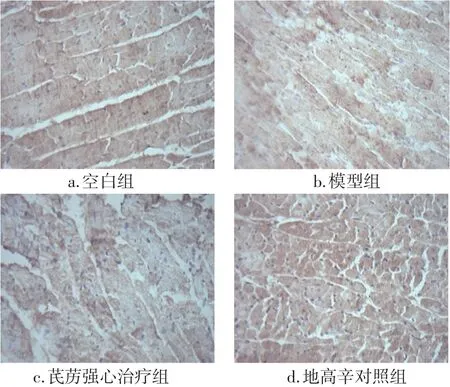
图6 各组大鼠心肌组织MDC阳性细胞分布比较(免疫组织化学法,×400)Figure 6 Comparison of the MDC-positive cell distribution in rat myocardial tissue in various groups(by immunohistochemistry,× 400)

图7 各组大鼠心肌组织MDC表达比较(免疫组织化学法,±s)Figure 7 Comparison of MDC expression in rat myocardial tissue in various groups(by immunohistochemistry,±s)
趋化因子是一类对白细胞有化学趋化作用的细胞因子,具有促细胞骨架重新排列引起细胞形态改变,促肌动蛋白板层足形成和退缩,升高活化白细胞内游离Ca2+浓度以及促进胞内颗粒内容物的释放等功能[12]。趋化因子主要分为4个亚家族,即CL、CCL、CXCL及CX3CL,目前已发现50余种。其中MDC,又称为CCL22,是CCL类趋化因子之一,其与胸腺活化调节因子(TARC)的基因编码位点相同,二者有32%相似的基因序列,并且都能够识别CC趋化因子受体4(CCR4)[13]。有研究表明,CCR4是G蛋白偶联受体,是公认的MDC受体。CHF发病过程中,由于抑制性G蛋白(Gi)增加、激动性G蛋白(Gs)降低、β1受体下调,从而导致Gs与β肾上腺素受体耦联障碍;另外,细胞内cAMP含量下降,导致肌浆网(SR)对Ca2+的摄取和释放障碍,最终影响心肌的舒缩功能。当MDC与CCR4受体特异性结合后,一方面激活G蛋白,使Ca2+活化,促进Ca2+细胞内流,增加细胞内Ca2+浓度而加强心肌收缩功能,另一方面又可以诱导磷酸接纳蛋白的磷酸化,从而促进肌浆网对Ca2+的摄取而改善心肌的舒张[14-19]。本课题组前期通过对CHF大鼠靶基因预测研究发现,MDC-CCR4相关的生物学通路达15种,其中包括“MDC→CCR4→G蛋白”通路[20]。而在本研究中结果显示:与空白组比较,模型组MDC含量和表达水平下调(P<0.05);与模型组比较,芪苈强心治疗组和地高辛对照组MDC含量和表达显著增高(P<0.05),且2个治疗组比较差异无统计学意义(P>0.05),提示芪苈强心胶囊可有效改善大鼠CHF,其机制可能与调节MDC蛋白含量和表达进而提高心功能有关。
综上所述,芪苈强心胶囊可能通过调节心肌MDC含量和表达而改善心肌舒缩功能,对CHF大鼠心脏起保护作用。
